鸭脂肪细胞中circ-FBLN2鉴定与功能预测
胡晓丹, 王来娣, 杨 婷, 白 皓, 江 勇, 王志秀, 王莎莎, 陈国宏, 常国斌
(扬州大学 动物科学技术学院,江苏 扬州 225009)
circRNA是由线性RNA的3′和5′端通过共价连接形成的封闭环状结构,在真核生物转录过程中广泛存在[1]。在20世纪70年代,Sanger等[2]首次在病毒RNA中发现circRNA。近年来,随着高通量测序技术及生物信息技术的飞速发展,使得更多的circRNA被发现,更多重要的circRNA的功能被解析。不少研究学者发现大量circRNA广泛存在于人和动物的体内[3],多种植物如水稻、拟南芥等中也鉴定出成千上万个circRNA[4]。大多数环状RNA主要存在于真核生物的细胞质中,少部分存在于细胞核中。Salzman等[5]和Liang等[6]的研究表明,circRNA表达具有组织特异性,其生成效率有时比线性同源mRNA更高,更稳定,具有一定的保守性且一般不具有翻译功能[7],所以也具有较高的诊断价值。
circRNA可通过多种途径发挥作用,其不仅可以充当与miRNA结合的竞争性内源RNA(ceRNA)从而调控靶基因的表达,还能与RNA结合蛋白相互作用,具有编码多肽等功能[8-9]。郭行雅[10]研究发现,小鼠circRNA-0046367与miR-34a竞争性结合可消除PPARα的表达抑制,从而降低脂代谢相关基因的表达,减轻肝脂肪变性。张贞贞[11]研究发现,miR-103是调控脂肪细胞的一种重要的miRNA,circARF3可通过吸附miR-103调节NF-κB信号通路从而促进线粒体自噬来抑制脂肪炎症。关于非酒精性脂肪肝研究表明,circ-SCD1的异常表达影响肝细胞脂质化程度,并通过JAK2/STAT5途径促进脂肪肝疾病的发生[12]。因此,推测circRNA可能在脂肪发生过程中发挥重要作用。
鸭脂肪沉积机制复杂,一方面脂肪组织对于维持机体稳态,改善肉品质有重要作用,而另一方面脂肪的异位过度沉积又会影响饲料转化率,且与疾病发生密切相关。目前有关circRNA在家禽上的研究主要集中于肌肉发育[13-14]和繁殖性能[15]上,在家禽脂肪细胞分化中的作用机制研究相对较少。鉴于此,本研究从RNA-Seq中筛选获得在脂肪细胞分化后显著下调的circ-FBLN2作为目标circRNA,旨在验证circ-FBLN2在鸭脂肪细胞中的存在特性,并通过生物信息学分析预测可能的调控机制,为探索circRNA在鸭脂肪细胞分化过程中的作用奠定基础。
1 材料与方法
1.1 实验材料
本实验以樱桃谷鸭胚为材料,由沭阳众客种鸭有限公司提供,设置孵化箱温度37.8 ℃、相对湿度60%,孵化20 d后进行前脂肪细胞分离培养,40只7日龄的雏鸭屠宰采集心脏、肝脏、脾脏、肺脏、肾脏、胸肌、腿肌、脂肪组织,-80 ℃保存用于RNA提取。Trizol购自Invitrogen 公司(美国);2×Taqpolymerase Mix购自诺唯赞(中国);FastKing一步法除基因组cDNA第一链合成预混试剂购自天根(中国);TB Green qPCR Premix购自TaKaRa(中国);RNase R购自Epicenter;琼脂糖购自Bio-Rad(美国);PBS,DMEM购自Hyclone(美国);胎牛血清,Ⅰ型胶原酶购自Gibco(美国),其余试剂均为进口或国产分析纯。
1.2 实验方法
1.2.1 引物设计
基于前期筛选的鸭前脂肪细胞分化的测序结果,筛选circ-FBLN2进行验证。利用primer5 软件设计针对circ-FBLN2的接合序列和线性序列的向外引物(divergent primer)和向内引物(convergent primer),向外引物亦可用做定量,设计用于FBLN2、GAPDH的qRT-PCR的定量引物,见表1。
1.2.2 鸭前脂肪细胞的分离与培养
按照Ding等[16]的方法做了部分改良,具体方法如下:取孵化20 d的鸭种蛋(E20),无菌条件下分离腿部皮下脂肪组织,转入含有双抗预热PBS的平皿中,PBS清洗3次,用眼科剪剪碎组织到1 mm3体积大小,用1 mL枪头吸取剪碎的脂肪组织到含有2 mg·mL-1的Ⅰ型胶原蛋白酶的离心管中,脂肪组织与消化酶体积比为1∶2,于37 ℃消化70~90 min,每5 min振荡摇晃一次。观察混合液消化成流沙状,加入预热的完全培养基终止消化,用枪头吹打至终止完全。分别经50、200、400目不锈钢筛网过滤,滤液转入无菌离心管1 000 r·min-1,离心10 min。弃去上清,加入3 mL预热的红细胞裂解液重悬沉淀,室温静置15 min后1 000 r·min-1,离心10 min。细胞沉淀用预热的培养基重悬,1 000 r·min-1离心10 min,弃上清,随后用培养基重悬细胞沉淀,将细胞吹打重悬,吹匀后接种到25 cm2的细胞培养瓶中,置于5%的CO2培养箱中,24 h后换液。

表1 实验引物设计
1.2.3 前脂肪细胞的传代与诱导分化
当鸭前脂肪细胞融合度达90%时进行传代,按106铺板至6孔板,生长会合至90%,将培养基更换为诱导培养基(0.5 mmol·L-1IBMX,1 μm·L-1DEX,10 μg·μL-1insulin,1 μmol·L-1罗格列酮,300 μmol·L-1油酸),每2 d更换一次培养液,连续培养5 d。
1.2.4 PCR扩增
使用Trizol传统法提取细胞或组织的RNA,用2%琼脂糖凝胶电泳和Nano drop2000 浓度测定仪验证RNA的完整性、纯度和浓度。而后用反转录试剂盒将RNA 反转录成cDNA,并以反转录产物进行qRT-PCR 扩增。扩增结束将结合序列切胶回收后送至公司进行焦磷酸测序。
1.2.5 RNase R消化抗性
将收集到的总RNA 分为对照组与RNase R处理组,RNase R处理组用RNase R (Epicenter)在37 ℃下消化线性RNA 15 min(3U RNase R/μg RNA),再进行纯化,反转录为cDNA后进行qRT-PCR定量检测。
1.2.6 核质分离
将细胞用胰酶消化后收集1 000 r·min-1离心5 min,用PBS洗涤细胞,将细胞移至1.5 mL离心管中离心2~3 min,去上清后晾干,PBS将细胞稀释为1×106μL-1,加入预冷的CERI(100 μL CERI/10 μL),涡旋振荡15 s,冰上孵育10 min,再加入预冷的CERⅡ(5.5 μL CERⅡ/10 μL)涡旋振荡5 s,冰上孵育1 min后涡旋振荡5 s,12 000 r·min-1离心15 min,立即将上清即细胞质提取液转至新的预冷管后-80 ℃保存。将不溶性沉淀(含细胞核)加入NER(50 μL NER/10 μL)涡旋振荡15 s后放置冰上,每隔10 min涡旋振荡,连续4次后12 000 r·min-1离心10 min,立即将上清即核萃取物转至新的预冷管中,-80 ℃保存备用。将核、质提取物进行RNA纯化后反转录为cDNA,进行qRT-PCR定量检测。
1.2.7 生物信息学分析
采用Miranda (http://cbio.mskcc.org/microrna_data/miRanda-aug2010.tar.gz) 软件预测circ-FBLN2具有靶向作用的miRNA及其对应的靶基因,利用Cytoscape 3.7.1 (https://cytoscape.org/download.html) 构建circ-FBLN2/miRNA/mRNA ceRNA网络图,运用DAVID 6.8 (http://david.abcc.ncifcrf.gov)[17]对预测的靶基因进行GO 和KEGG分析。
1.2.8 数据处理与分析
荧光定量PCR数据结果采用2-ΔΔCt方法进行分析,采用SPSS 22.0软件进行单因素方差分析结果,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 樱桃谷鸭脂肪分化的circ-FBLN2鉴定及亚细胞定位
FBLN2主要位于鸭13号染色体,circ-FBLN2是由外显子1首尾插接形成的环状RNA。以cDNA为模板经PCR扩增获得接合序列的产物以及线性产物,而以基因组DNA为模板PCR扩增未获得接合序列产物,获得线性产物(图1),且将接合序列产物经焦磷酸测序获得与高通量测序结果一致的序列,证明了circ-FBLN2的存在(图2)。利用RNase R 处理消化掉线性RNA后定量结果显示大部分线性的FBLN2被消化,而circ-FBLN2具有消化抗性,处理后依然存在,进一步证明circ-FBLN2的环状特性(图3)。核质分离结果显示circ-FBLN2大部分位于细胞质(图4)。
2.2 circ-FBLN2在鸭脂肪细胞分化过程中及组织中的表达情况
在前脂肪细胞诱导分化不同时期分别采用qRT-PCR检测circ-FBLN2和FBLN2的表达量,结果显示,circ-FBLN2在脂肪细胞诱导分化5 d时表达量显著降低,而FBLN2在分化3 d时显著降低,分化5 d时显著升高,circ-FBLN2和FBLN2的表达量变化趋势无明显相关性(图5)。由图6可知,circ-FBLN2在8种不同组织样中均有不同程度的表达且差异较大,其中circ-FBLN2在脂肪、腿肌中表达量相对较高,肝脏次之,在心、肾和胸肌中不表达。
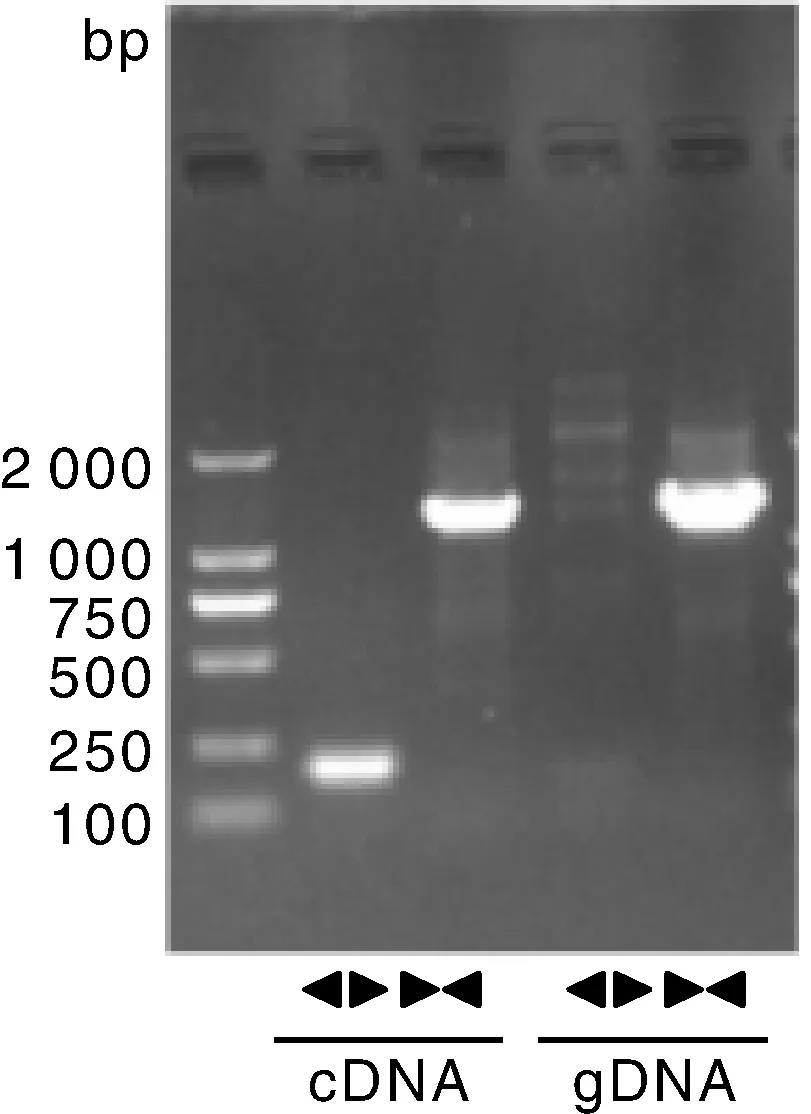
图1 circ-FBLN2琼脂糖凝胶电泳Fig.1 circ-FBLN2 agarose gel electrophoresis

图2 circ-FBLN2模式图及接合序列测序峰图Fig.2 circ-FBLN2 Pattern maps and conjugated sequence sequencing peaks
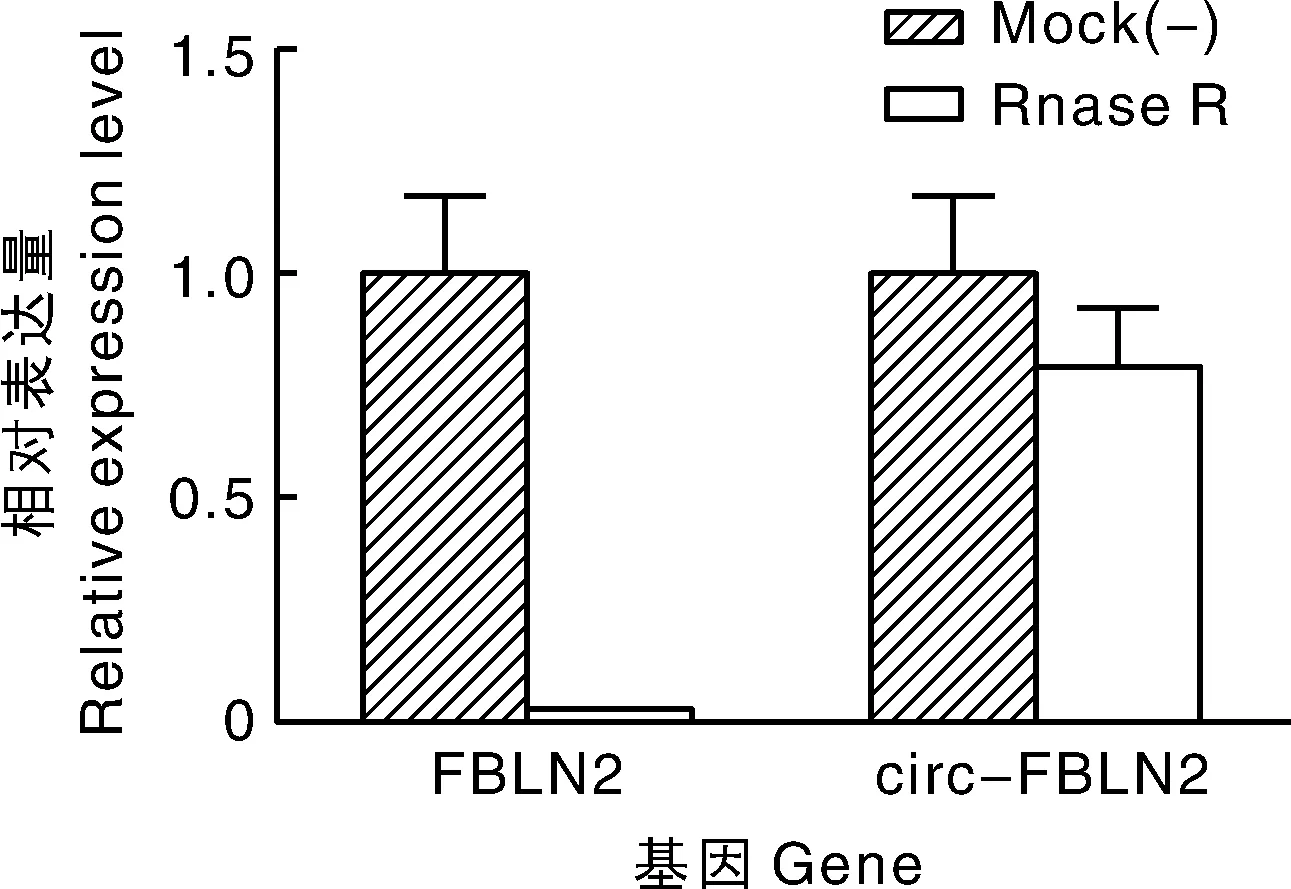
图3 circ-FBLN2在RNase R处理组与对照组的相对表达量比较Fig.3 The relative expression of circ-FBLN2 in the treatment of RNase R and control group

图4 circ-FBLN2亚细胞定位Fig.4 circ-FBLN2 subcellular localization

同一基因不同字母表示差异显著(P<0.05)。Different letter of the same gene means siginificant difference(P<0.05).图5 樱桃谷鸭脂肪细胞分化过程中circ-FBLN2及主基因表达规律Fig.5 circ-FBLN2 and major gene expression during adipocyte differentiation in Cherry Valley duck
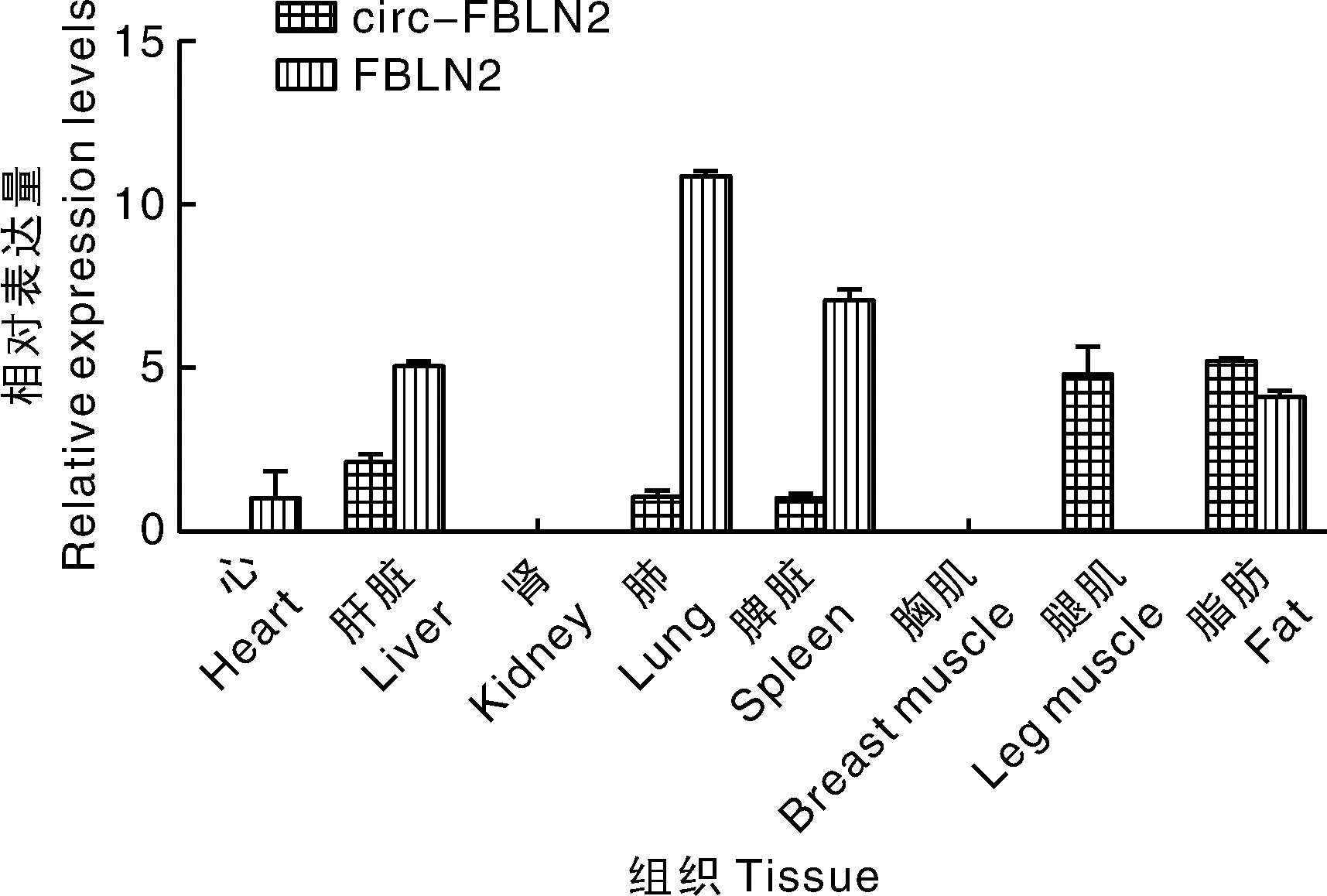
图6 circ-FBLN2基因在樱桃谷鸭不同组织中的表达情况Fig.6 Expression of circ-FBLN2 gene in different tissues of Cherry Valley duck
2.3 circ-FBLN2的功能预测
为了进一步探索circ-FBLN2的潜在功能,利用Miranda预测circ-FBLN2具有靶向作用的miRNA及mRNA,分析发现gga-miR-15c-5p、gga-miR-22-3p与circ-FBLN2可能存在靶向作用,而这两个miRNA又具有107个潜在的靶基因。利用Cytoscape构建circ-FBLN2-miRNA-mRNA调控网络(图7),表明通过预测网络circ-FBLN2可能产生较广泛的影响。
通过David数据库对107个靶基因进行GO和KEGG分析,预测其功能,GO分析主要从分子功能(MF)、细胞组件(CC)和生物学进程(BP)3个方面对基因功能进行分析。结果如图8所示,circ-FBLN2的靶标基因的作用主要有调节运输(regulation transport)、细胞定位调节(regulation of cellular localization)、囊泡(vesicle)、结合细胞器囊泡(membrane-bounded vesicle)、肌动蛋白结合(Actin binding)、细胞骨架蛋白结合(cytoskeletal protein binding)等。
KEGG通路富集分析表明,circ-FBLN2的靶基因主要富集在Toll样受体信号通路(Toll-like receptor signaling pathway)、鞘脂代谢(Sphingolipid metabolism)、内质网蛋白加工(protein processing in endoplasmic reticulum)、吞噬体(phagosome)、MAPK信号通路(MAPK signaling pathway)、溶酶体(lysosome)、细胞因子与受体相互作用(cytokine-cytokine receptor interaction)等通路。

图7 ceRNA(circ-FBLN2-miRNA-mRNA)网络图Fig.7 ceRNA(circ-FBLN2-miRNA-mRNA) network diagram

图8 一百零七个靶标基因GO 分析结果图Fig.8 GO analysis of 107 target genes

图9 一百零七个靶标基因KEGG 分析结果图Fig.9 KEGG analysis of 107 target genes
3 讨论
目前有关家禽circRNA表达谱的研究多集中于鸡物种,主要有正常生长过程中circRNA表达谱的变化,如在鸡卵泡发育颗粒细胞中的动态表达及功能分析[18],肝脏中circRNA表达研究[19],以及在染病情况下的表达谱研究如ALV-J抗性鸡和ALV-J敏感鸡肝脏组织circRNA表达研究[20]。Chen等[21]从测序结果中筛选出circHIPK3进行验证研究,其在11胎龄(E11)、16胎龄(E16)和孵化后1天(D1)的鸡骨骼肌中差异表达,并分析其在鸡成肌细胞的增殖与分化过程中通过靶向miR-30a-3p发挥作用。王海棠[22]研究表明,小鼠通过运动训练可以促进白色脂肪组织中的外泌体circ0011487的释放增加,从而促进白色脂肪棕色化。任航江等[23]报道了肝脏脂肪变性与357个环状RNA相关,认为脂素1 (LPIN1)介导circRNA从而造成白色脂肪组织棕色化,以此来调节能量代谢稳态。Arcinas等[24]研究发现,从脂肪组织来源的circTshz2-1和circArhgap5-2与脂代谢和脂肪分化有关,干扰后导致脂分化相关标志物基因下调,从而影响脂肪分化的效率。王莎莎[25]在鸭上对7个差异表达的circRNA进行验证,发现其大量富集在与脂肪有关的不饱和脂肪酸、类固醇的生物合成、PPARγ信号通路等过程中,为进一步研究鸭前脂肪细胞分化和脂肪细胞成脂机制奠定了基础。因此circRNA可能在鸭脂肪细胞分化过程中也发挥了重要作用。
Fibulin-2 (FBLN2)是一种分泌的细胞外基质糖蛋白,与组织的发育和重构有关[26],可作为动脉粥样硬化或肺癌肿瘤发生及转移性肺癌的潜在生物标志物[27-28],且FBLN2已被确定为鼻咽癌的候选抑癌基因[29]。Hergeth等[30]的研究表明,人成骨细胞能合成较多的FBLN2蛋白,FBLN2基因在原代成骨细胞中过表达,而在骨肉瘤细胞系中FBLN2表达水平下降,该蛋白对细胞增殖率和细胞的黏附性能具有负面影响。本研究结果显示,在鸭前脂肪细胞分化过程中FBLN2 mRNA表达水平先降低再升高,但具体功能尚不清楚。由前期测序结果[31]发现,其外显子1可以通过首尾插接形成circ-FBLN2,且在分化后的脂肪细胞中表达显著下调,在本实验中成功验证,所用方法与Li等[32]研究类似。
通过生物信息学分析发现,gga-miR-15c-5p、gga-miR-22-3p为circ-FBLN2的潜在靶基因,有研究发现,miR-22-3p可作为肥胖相关的miRNAs[33],而有关miR-15c-5p的研究较少。ceRNA分析获得107个潜在靶基因,主要富集在Toll样受体信号通路(Toll-like receptor signaling pathway)、MAPK信号通路(MAPK signaling pathway)、细胞因子-细胞因子-受体相互作用(cytokine-cytokine receptor interaction)、溶酶体(lysosome)等通路。有研究发现,猪肌内脂差异circRNA的靶基因主要富集在MAPK通路、细胞因子受体相互作用等通路,鸡肌肉组织中脂肪酸代谢也主要富集在MAPK通路、,ErbB通路和Herpes simplex infection通路中[34-35],与本研究结果类似。安格斯牛和南阳牛肌内脂肪组织中差异表达circRNAs分析显示,circRNAs在牛脂肪沉积和脂质代谢过程中发挥着一定的调控作用[36],circRNA_26852及其靶基因、circRNA_11897及其靶基因的CircRNA-miRNA-mRNA与脂肪细胞分化和脂质相关,推测circRNA可能调控成脂分化和脂质代谢,为进一步研究脂肪沉积机制提供了理论依据[37]。本研究中ceRNA网络分析以及靶基因富集分析结果显示,circ-FBLN2可能通过复杂的网络对鸭脂肪细胞分化过程中的MAPK,Toll样受体以及细胞因子与受体互作通路进行调控。
4 结论
本研究在鸭脂肪细胞水平验证了circ-FBLN2,其主要表达于鸭脂肪组织、腿肌中,在鸭胚原代脂肪细胞分化过程中circ-FBLN2随着分化时间的增加呈显著下调,结合生物信息学分析结果推测circ-FBLN2可能参与调控鸭脂肪细胞的分化过程,具体作用机制还需进一步的实验验证。

