雌性罗氏鼢鼠肠道微生物群落与功能预测的初步分析
陈晓宁 封 托 侯 祥 安晓雷 王 京 常 罡
(陕西省动物研究所,西安,710032)
罗氏鼢鼠(Myospalaxrothschildi)主要生存在我国西北地区,其环境适应性较强,严重损害农林牧的水土保持[1]。调查显示,成年罗氏鼢鼠的身长通常为150—215 mm,体重为114—365 g。体型较其他鼢鼠偏小。四肢短而粗壮,有尖锐的爪子。前脚爪更发达,像镰刀一样向外弯曲。罗氏鼢鼠每天进食时间较长,不冬眠,常年在地下挖洞寻找食物。罗氏鼢鼠主要伤害幼树,吃掉幼树的根,引起秃顶并导致死亡[2]。
在中国天然药库的陕西省镇巴县,鼢鼠危害问题逐年加剧。该地区主要害鼠为罗氏鼢鼠[3]。例如根据作者的调查,在镇巴县内泾洋镇的建邑种植场,每年约50%的药材植株被罗氏鼢鼠损坏,对当地脱贫致富工作造成了影响。因此,有必要研究当地罗氏鼢鼠与特殊环境因素的相互关系。
肠道内容物的微生物种群结构与啮齿类动物种类有密切关系,可以反映出环境对啮齿动物的相互作用,确认其在生态系统中的位置,对于鼠害防控具有重要指导意义[4]。啮齿动物肠道内容物中的微生物的种类功能与宿主的生理状态组成动态平衡系统,与宿主的新陈代谢也有紧密联系。有研究显示,啮齿类动物的不同肠道段内微生物在门水平上以分解利用植物的种类为优势种群(厚壁菌门Firmicutes 和拟杆菌门Bacteroidetes),占比达89%。十二指肠与其他肠道的微生物比例差异较大,而盲肠中厚壁菌门更多[5]。肠道微生物可以帮助啮齿类动物应对植物次生代谢物的有毒成分,通过研究沙漠林鼠(Neotomalepida)肠道微生物的稳态,发现肠道微生物能协助宿主适应植物性食物中的有毒成分,拓展了宿主的饮食生态位。对小林姬鼠(Apodemussylvaticus)肠道微生物16S RNA测序分析,发现随着季节变化,乳杆菌属(Lactobacillus)微生物比例下降,另枝菌属(Alistipes),螺杆菌属(Helicobacter)比例升高,相应的宿主食物由虫子转变为植物种子[6]。分析高原鼠兔的肠道内容物发现微生物组成越复杂,微生物系统稳定性越好[7]。一方面,优势种群的肠道细菌会影响宿主的很多生理反应[8];另一方面,宿主的物种属性、生存状态、食物组成和胃肠道生理结构反过来会调节肠道微生物的群落和组成。这种关系对宿主很重要[9-10]。昼夜的变化也会对啮齿类动物肠道微生物数量造成影响,大多数白天处于休眠状态,肠道乳杆菌含量较高,有利于胃肠蠕动,机体解毒,感知环境。而在夜间,厚壁菌和拟杆菌数量增加,能量代谢与细胞生长发育水平增强。对特定光暗循环期间收集的小鼠粪便进行宏基因组测序发现,某些肠道基因组数量差异较大,表明存在特定时间段微生物功能群[11]。有研究显示,小型哺乳类动物的肠道菌群通过调节宿主的能量代谢来影响宿主的社会性行为[12],有可能通过调控肠道微生物多样性来影响啮齿类动物的觅食与繁殖行为。啮齿动物的性别与饮食结构差异也会影响到肠道微生物多样性,雌性鼢鼠的肠道微生物群落组成很接近,而雄性鼢鼠的肠道微生物多样性比较复杂[5]。近年来,使用不育饵料对鼠害控制取得一定进展[13]。研究罗氏鼢鼠肠道微生物的多样性,可能帮助我们进一步理解罗氏鼢鼠与特定环境适应的机制。
现有研究多利用微生物分离与培养、克隆文库构建等分子生物学方法探索肠道细菌多样性[14-16]。但是,这些方法也有一定缺陷,可能会遗漏某些肠道微生物的种类。肠道内容的微生物本身就具有复杂的多样性,而且有些菌种还依赖厌氧环境。随着检测技术的迅速发展,为了克服传统针对微生物鉴定与分析方法的缺点,新一代的高通量测序技术广受关注和利用[17],由于肠道微生物基因结构的特点非常适合该技术的使用,尤其是高通量测序技术促进了肠道内容物中微生物多样性分析的深度和广度。研究罗氏鼢鼠肠道微生物菌群结构和功能,对鼠害防治将有重要参考价值。
本研究针对陕西省镇巴县中草药种植区的罗氏鼢鼠样品,采用Illumina高通量测序技术,分析雌性罗氏鼢鼠肠道细菌多样性,探究该地区罗氏鼢鼠肠道细菌对宿主食物资源的参与模式,并对菌群对宿主代谢功能的关系进行预测,以期为防治罗氏鼢鼠提供参考。
1 材料和方法
1.1 样品的采集与保存
3只罗氏鼢鼠活体捕捉自陕西镇巴县大池镇(海拔:823 m;地理位置:32°23′N,107°36′E;年均气温:13.8℃),性别均为成年雌性,体重为(172.22±17.91)g(mean±SD)。在野外临时实验室内,将活体样本经过戊巴比妥钠(质量浓度1%)麻醉,在无菌环境下实施解剖,解剖罗氏鼢鼠的盲肠,收集内容物,用灭菌冻存管保存待用,利用液氮罐带回实验室,冻存于-80℃冰箱备用。
1.2 肠道微生物 DNA 的提取
使用无菌药勺在超净工作台里从收集的每个罗氏鼢鼠的盲肠内容物冻存管里取100—150 mg样本,用干冰快递送至华大基因公司做DNA的提取与分析。DNA提取基本流程是加液氮研磨,DNA试剂盒提取细菌总DNA(QIAGEN,德国)[18]。提取的DNA利用NanoDrop和琼脂糖凝胶电泳进行质量检测以及完整性检测,合格的样品进行测序。
使用TIANamp Stool DNA Kit(TIANGEN,China)对罗氏鼢鼠的盲肠内容物总基因组DNA进行提取,具体步骤见试剂盒说明书。使用通用引物338F-806R(338F:5′-ACTCCTACGGGAGGCA GCAG-3′,806R:5′-GGACTACHVGGGTWTCTAA T-3′)对16S rRNA基因V3-V4区进行扩增。20 μL反应体系如下:模板DNA 10 ng,5×FastPfu缓冲液4 μL,dNTPs(2.5 mmol/L)2 μL,FastPfu聚合酶0.4 μL,BSA 0.2 μL,正反引物(5 μmol/L)均为0.8 μL,添加ddH2O补足反应体系。然后使用以下条件扩增DNA:95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 45 s,循环25次;72℃ 10 min。在Illumina MiSeq平台上对纯化的PCR产物进行测序(华大基因)。
1.3 生物信息学分析
下机数据过滤,剩余高质量的clean data用于后期分析;通过reads之间的overlap关系将reads拼接成tags;将tags聚类成OTU并与数据库比对、物种注释;基于OTU和注释结果进行样品物种复杂度分析,组间物种差异分析,以及关联分析与模型预测等[19]。α多样性指数结果进行统计分析,即单因素方差分析和LSD分析。
使用PICRUSt软件预测菌群的功能[20]。PICRUSt 软件备份了greengene ID 对应的KO(KEEG Orthology,KEGG 直系同源)信息。PICRUSt 首先标准化OTU 丰度表,即去除16S 标记基因对样品基因组中的拷贝数的影响。然后通过每个OTU对应的GreenGene ID,获得OTU对应的KO,并通过KO对应的OTU丰度总和计算该KO的丰度。根据KEGG数据库的信息和OTU丰度信息计算各功能类别的丰度。此外,针对Pathway,运用PICRUSt 分析代谢通路的信息,并分别得到丰度表。PICRUSt软件备份了GreenGene ID 对应的 COG(clusters of orthologous groups of proteins,直系同源序列聚类)信息。因为不同种属菌种的16S拷贝数不相同,PICRUSt首先标准化16S测序数据的种属数量。然后,16S的种属信息比对数据库中的功能基因,产生预测结果。
2 结果与分析
2.1 肠道微生物多样性
通过对罗氏鼢鼠肠道内容物样品测序得到Tag数据量有50 000个。从α多样性指数分析结果(图1,Chao1指数)看出不同样品的罗氏鼢鼠肠道内容物菌群多样性有一定差异。对罗氏鼢鼠样品α多样性指数结果进行统计分析(表1),Chao1指数和Ace指数在样本1和2,及样本1和3之间有显著性差异,而样本2和3之间无显著性差异。显示样品1的肠道菌落多样性要高于样本2和样本3。
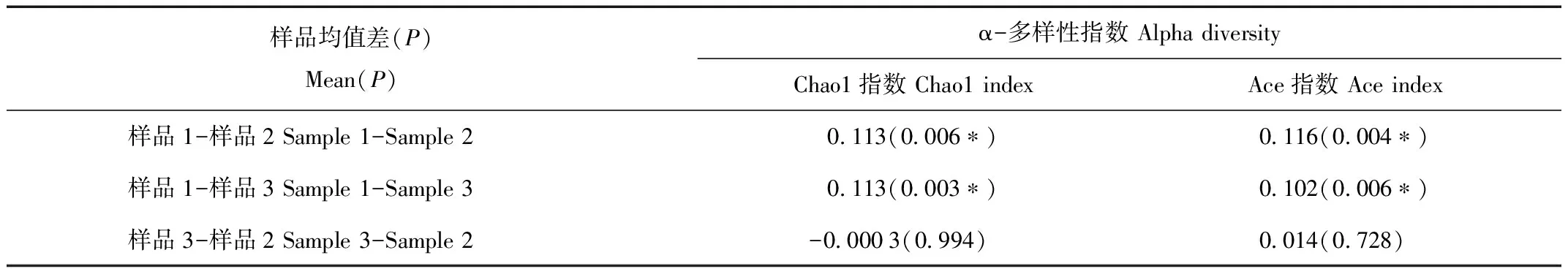
表1 罗氏鼢鼠肠道样品ɑ多样性指数LSD分析表
2.2 分析罗氏鼢鼠的肠道菌群的物种组成
从图2可以看出,OTUs稀释曲线随着测量深度的增加而趋于平坦,说明测量数据量比较合理。通过曲线的曲率判断出测序的结果较为完整,所测的数据量可以包含肠道内容物所有微生物成分。但样品3的测序深度可能不够,多样性指数曲线还在增长,还没有到饱和期。样品3的稀释曲线相对另2个样品斜率较大,可能是由于肠道样品采取位置不同影响的,需要进一步调整测序方法,提高文库覆盖度。
OTU序列分类的结果(相似度设置为97%)显示罗氏鼢鼠的肠道细菌隶属10门9纲11目13属。主要由放线菌门(Actinobacteria)(3.9%±4.2%)、变形菌门(Proteobacteria)(29.8%±37.9%)、拟杆菌门(31.4%±19.7%)、厚壁菌门(33.8%±15.3%)、柔膜菌门(Tenericutes)(0.06%±0.04%)、蓝细菌门(Cyanobacteria)(0.007%±0.006%)、螺旋体菌门(Spirochaetes)(0.59%±0.65%)、迷踪菌门(Elusimicrobia)(0.09%±0.13%)、候选门辐射类群(TM7)(0.39%±0.31%)和互养菌门(Synergistetes)(0.003%±0.004%)等组成。通过图3的结果反映出,革兰氏阴性菌的变形菌门和革兰氏阳性菌的厚壁菌门的菌类在总体上(门级别)及拟杆菌门,是罗氏鼢鼠盲肠中的优势菌群。从图4可以看出,样品3中埃希氏杆菌属(Escherichia)以及梭杆菌属(Clostridium)丰度较高,样品1和2中革兰氏阳性厌氧的瘤胃球菌属(Ruminococcus)和颤螺旋菌属(Oscillospira)是次一级分类水平的优势群落(属级别)。样品3微生物丰度与另外2个样品有差别,可能是样品收集位置差异的影响。对比盲肠,啮齿类动物十二指肠内变形菌门的细菌丰度会增加,而厚壁菌门丰度相对较少[21]。图5为肠道细菌丰度热图,3个样品差别不大。罗氏鼢鼠肠道微环境内的微生物多样性及丰度的差别有必要进作一步的研究。
2.3 功能预测
PICRUSt软件广泛用于功能基因研究,并将菌群多样性与宿主代谢情况联系起来。经过分析,罗氏鼢鼠肠道细菌的很多基因与代谢相关,并且发现有与聚酮类化合物和萜类化合物代谢相关的基因(图6)。KEGG通路分析预测出很多基本代谢功能基因,主要涉及神经系统、免疫系统、循环系统、内分泌系统、萜类和聚酮类化合物的代谢、信号转导、外源性生物降解与代谢、遗传信息处理、核苷酸代谢、辅助因子和维生素的代谢等。利用COG数据库比对功能分析表明,在罗氏鼢鼠肠道细菌基因功能涉及糖类、脂类、蛋白质代谢(图7)。
在门分类水平上显示,罗氏鼢鼠肠道优势菌群主要帮助宿主分解利用植物源食物。罗氏鼢鼠肠道细菌多属于厚壁菌门和调节肠道糖代谢的拟杆菌门。
3 讨论
经分析发现,在门的水平,罗氏鼢鼠肠道细菌能够分解利用植物类资源。主要有放线菌门、变形菌门、拟杆菌门、厚壁菌门等,显示罗氏鼢鼠具有很强的植物源食物适应性。奇蹄目(Perissodactyla)的马(Equus)和驴(Equus)肠道菌群与罗氏鼢鼠的相似[22]。厚壁菌门细菌有助于代谢肠道中的多糖,而拟杆菌门细菌能够帮助宿主从难以消化的食物中获得能量,并保持动物肠道的健康[23]。高脂肪饮食会显著地改变雌性小鼠的肠道微生物多样性,厚壁菌门及该菌门中Leptum菌种的相对丰富度均显著下降,可能雌性激素和肠道微生物相互作用有关[24]。
有研究显示,植物性食物中的纤维素以及半纤维素在动物胃肠道中依靠Firmicutes和Bacteroidetes帮助消化[25]。长江中下游的草食性白额雁(Anseralbifrons)肠道多样性由放线菌构成、豆雁(Anserfabalis)肠道微生物主要是变形菌,鸿雁(Ansercygnoides)的肠道微生物种由厚壁菌门占主要组成,这些菌类帮助雁类获取薹草属(Carex)、禾本科(Gramineae)等草本植物里的能量[26]。在属的水平上出现的瘤胃球菌属(厚壁菌门)能帮助消化纤维素和半纤维素为主的植物食物资源,瘤胃球菌属还有纤维素酶,具有溶解微晶纤维素的功能[27]。草食性动物肠道普遍含有颤螺旋菌属,可以分解宿主体内的葡萄糖产生丁盐酸参与代谢[28]。而罗氏鼢鼠的肠道内的Escherichia可能是参与宿主碳水化合物代谢[29],这可能与在春节捕获样品有关,食物来源比冬季更多,造成罗氏鼢鼠肠道内埃希氏杆菌属丰度增加[30]。宿主本身的年龄变化也会导致肠道结构改变,从而能影响肠道菌群的组成,在幼年期以兼性厌氧菌为主,例如优势菌为拟杆菌、梭菌等。随着年龄增加,好氧菌逐步转变为厌氧菌,主要是拟杆菌丰度的持续增加。成年哺乳动物肠道微生物主要类群为厚壁菌门和拟杆菌门。老年动物肠道中的拟杆菌门和双歧杆菌属(Bifidobacterium)无论是数量还是多样性都在下降,肠杆菌科(Enterobacteriaceae)、葡萄球菌科(Staphylococcaceae)、链球菌科(Streptococcaceae)等细菌数量上升。宿主基因型会通过免疫系统影响肠道菌群的组成[31]。猪类的回肠黏膜菌群组成会受宿主基因型影响而改变[32]。上述结果展现出环境因素可能对罗氏鼢鼠肠道微生物多样性有明显的影响,详细的机制仍需更多的研究。
利用PICRUSt可以研究肠道微生物-宿主-环境之间的关系[33]。借助与KEGG的比较搜索,该研究发现罗氏鼢鼠的肠道菌群编码的大多数基因与代谢有关,其次是涉及遗传和环境信息处理。通过预测找到了和萜类化合物以及聚酮类化合物代谢相关的通路(图6)。作者调查发现镇巴县当地多种植党参和黄芪,此类药材中普遍含有萜类化合物[34-35]。真菌和植物共同作用可以合成聚酮类物质,具有药用性能[36]。这显示罗氏鼢鼠的肠道微生物可能参与调节宿主对中药材类食物以及特殊环境的适应性。
COG功能分类统计表明,罗氏鼢鼠肠道细菌中参与糖类、脂类、蛋白质代谢的功能基因具有较高丰度,多属于一些保守功能[37]。厚壁菌门的微生物具有降解纤维素的功能,帮助鼢鼠调节糖代谢[27]。拟杆菌门和变形菌门中很多微生物也会导致宿主患病而死亡,又可能间接影响鼢鼠的种群数量[38]。有报道显示,鼢鼠的肠道微生物种类更接近哺乳动物[5],因此有必要在搜集更多哺乳动物全基因组编码蛋白质序列进行系统发育分析。本研究通过高通量分析肠道菌群的多样性和菌株在宿主上的功能,对于探索罗氏鼢鼠对环境的适应性具有重要参考价值[39],其他环境以及雄性遗传因素对肠道菌群与罗氏鼢鼠的相互作用的影响有待进一步研究。
致谢:感谢镇巴县泰昌农牧有限公司朱艳琴、张生协助捕获实验鼠。

