血根碱抑制肺腺癌A549细胞生长及机制初探
李小娜 李开瑞 何迎春 徐朝军 宋岚
〔摘要〕 目的 研究血根碱(sanguinarine, SAN)对肺腺癌A549细胞增殖、凋亡和细胞周期的影响,并探讨其可能的作用机制。方法 将肺腺癌A549细胞随机分为空白组、SAN不同浓度(1.25、2.5、5、10 μmol/L)组、阳性组。采用噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, thiazolyl blue tetrazolium bromide, MTT]法和实时无标记动态细胞分析技术(real time cellular analysis, RTCA)检测细胞增殖;采用流式细胞术检测细胞周期分布;采用Annexin V-FITC/PI双荧光染色法检测细胞凋亡;采用蛋白免疫印迹(Western blot)法检测增殖相关蛋白(PCNA)、周期相關蛋白(Cyclin D1、Cyclin D3、CDK4)、凋亡相关蛋白(Bax、XIAP、Survivin)表达水平。结果 MTT法和RTCA检测结果均显示,不同浓度SAN均能够抑制肺腺癌A549细胞增殖(P<0.01)。流式细胞术检测结果显示,不同浓度SAN(2.5、5 μmol/L)处理肺腺癌A549细胞24 h后,其G1期比例显著增加(P<0.01)。AnnexinV-FITC/PI双荧光染色法结果,经SAN(2.5、5 μmol/L)处理24 h后的肺腺癌A549细胞凋亡率明显增加(P<0.01)。Western blot结果显示,经SAN干预后的肺腺癌A549细胞的增殖相关蛋白PCNA(P<0.01)、周期相关蛋白Cyclin D1、Cyclin D3、CDK4(P<0.01)、抗凋亡蛋白Survivin、XIAP(P<0.05或P<0.01)表达水平均显著降低,促凋亡蛋白Bax(P<0.01)表达水平明显提高。结论 SAN能抑制肺腺癌A549细胞增殖,将其细胞周期阻滞于G1期,并可诱导其细胞凋亡。
〔关键词〕 血根碱;肺腺癌A549细胞;增殖;凋亡;细胞周期
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.01.011
〔Abstract〕 Objective To investigate the effects of sanguinarine (SAN) on proliferation, apoptosis and cell cycle of lung adenocarcinoma A549 cells and to explore its mechanism. Methods Lung adenocarcinoma A549 cells were randomly divided into the blank group, different concentrations of SAN (1.25, 2.5, 5, 10 μmol/L) groups and the positive group. 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,thiazolyl blue tetrazolium bromide (MTT) and real-time cellular label free dynamic analysis (RTCA) were used to detect the cell proliferation. Flow cytometry was performed to evaluate the cell cycle distribution. Annexin V-FITC/PI double fluorescent staining was used to detect the cell apoptosis. Western blot was used to detect the expression levels of proliferation-related protein (PCNA), cell cycle-related proteins (Cyclin D1, Cyclin D3, CDK4), and apoptosis-related proteins (Bax, XIAP, Survivin) Results The results of MTT and RTCA showed that SAN at different concentrations could inhibit the proliferation of lung adenocarcinoma A549 cells (P<0.01). Flow cytometry showed that the G1 phase proportion of lung adenocarcinoma A549 cells was significantly increased (P<0.01) after treated with different concentrations of SAN (2.5, 5 μmol/L) for 24 h. Annexin V-FITC/PI double fluorescent staining showed that the apoptosis rate was significantly increased (P<0.01) after treated with SAN (2.5, 5 μmol/L) for 24 h. Western blot showed that, the expression of proliferation-related protein PCNA (P<0.01), cell cycle-related protein Cyclin D1, Cyclin D3 and CDK4 (P<0.01), and anti apoptotic protein Survivin and XIAP (P<0.05 or P<0.01) were decreased, while the expression of pro-apoptotic protein Bax was significantly increased (P<0.01). Conclusion SAN can inhibit the proliferation and arrest the cell cycle in G1 phase, and induce apoptosis of lung adenocarcinoma A549 cells.
2.5 Annexin V-FITC/PI双荧光染色法检测细胞凋亡率
分组同“2.4”,药物处理24 h后,消化、离心、收集沉淀移至EP管,各组加入100 μL 1×binding buffer重悬细胞,再分别加入5 μL FITC和10 μL PI,避光染色15 min后再加入100 μL 1×binding buffer终止染色,轻轻混匀,防止因混匀力度较大而出现细胞碎片,于荧光双染流式细胞仪检测细胞凋亡率,实验重复3次。
2.6 Western blot检测相关蛋白表达水平
将处于对数生长期的肺腺癌A549细胞悬液均匀平铺于10 cm的培养皿中,分组同“2.4”。SAN处理24 h后,每皿加入100 μL裂解液,放置冰上裂解,用细胞刮将细胞及混合液刮至皿边缘,再用移液枪移至1.5 mL EP管中,放置4 ℃冰箱裂解30 min,进行离心(12 000 r/min,10 min,离心半径15 cm),收集细胞上清,用BCA蛋白试剂盒测蛋白浓度,配置样品并放置金属浴(100 ℃/10 min)进行蛋白变性,进行SDS-PAGE电泳,按照顺序为滤纸+胶+PVDF膜+滤纸进行湿转。加入25%脱脂牛奶,放置摇床封闭1 h,用TBST洗净残余的封闭牛奶液,根据目的条带位点孵育一抗过夜(β-Actin、PCNA、Bax、XIAP、Survivin、Cyclin D1、Cyclin D3、CDK4均按照1∶1 000稀释),洗膜3次,避光孵育各自荧光二抗2 h,于摇床上避光洗3次,于Odyssey-CLX进行显影,实验重复3次。
2.7 统计学处理方法
采用SPSS 17.0统计学软件对数据进行分析,计量资料数据用“x±s”表示,若符合正态性及方差齐性,选择单因素方差分析,若不满足时,选择秩和检验。以P<0.05为差异有统计学意义。
3 结果
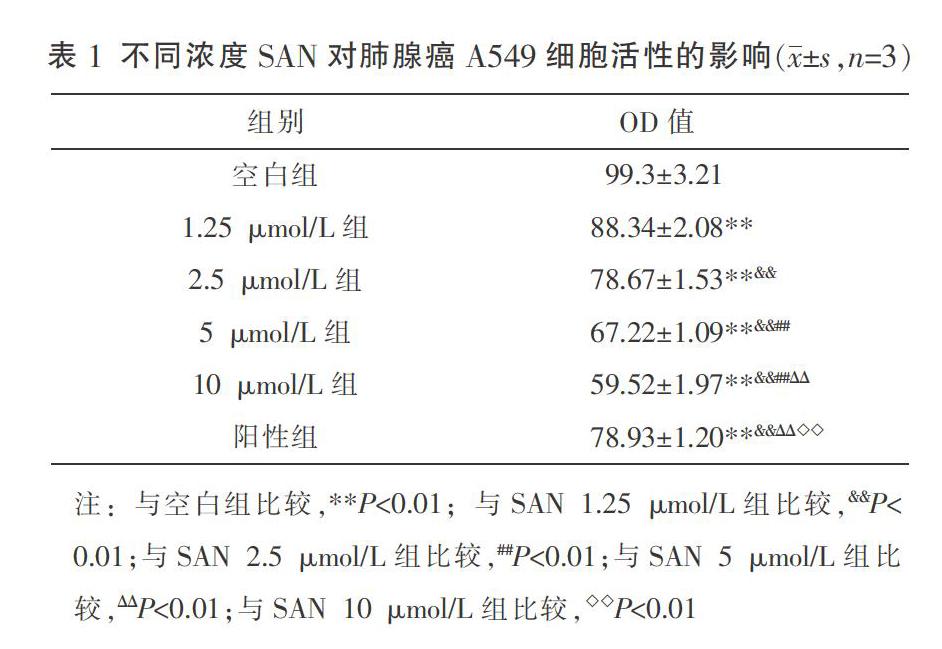
3.1 SAN对肺腺癌A549细胞增殖的影响
MTT和RTCA实验结果显示,与空白组相比,经不同浓度SAN干预后的肺腺癌A549细胞的生存活力明显降低(P<0.01)。结合上述实验结果,选择抑制增殖较好的低浓度SAN(2.5、5 μmol/L)处理肺腺癌A549细胞24 h后进行后续实验。与空白组相比,SAN 5 μmol/L组及阳性组细胞增殖相关蛋白PCNA表达显著下降(P<0.01)。见表1、图1、图2。
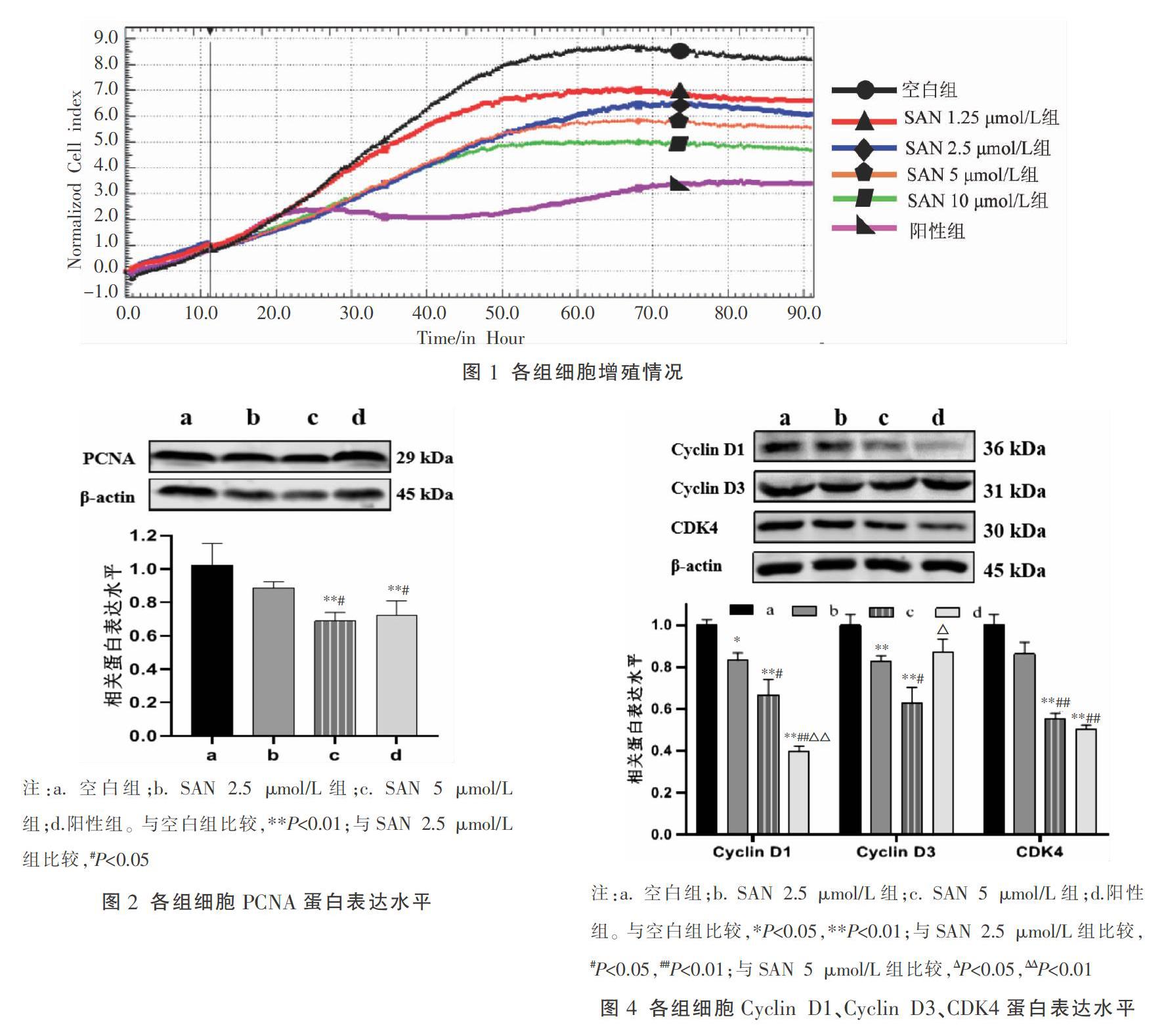
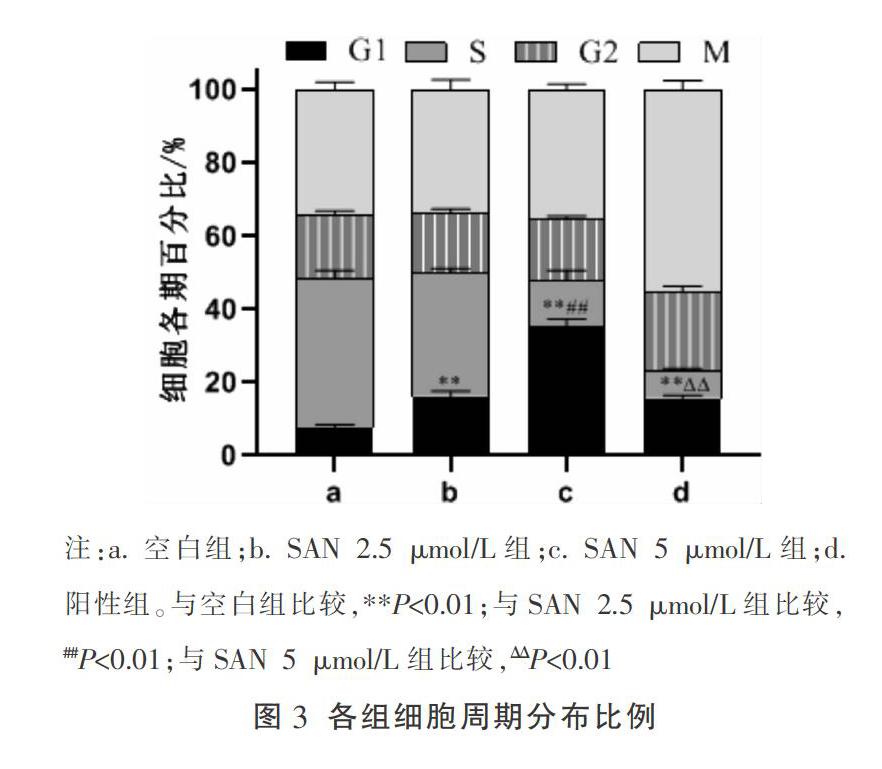
3.2 SAN对肺腺癌A549细胞周期的影响
与空白组比较,SAN(2.5、5 μmol/L)组细胞周期G1期所占比例提高(P<0.01),且随着SAN浓度的升高,G1期所占比例也呈增加趋势。与空白组比较,SAN 5 μmol/L组A549细胞的周期相关蛋白Cyclin D1、Cyclin D3、CDK4的表达量显著降低,差异有统计学意义(P<0.05);SAN 2.5 μmol/L组A549细胞的周期相关蛋白Cyclin D1、Cyclin D3的表达量显著降低,差异有统计学意义(P<0.05)。见图3、图4。
3.3 SAN对肺腺癌A549细胞凋亡的影响
与空白组比较,SAN(2.5、5 μmol/L)组细胞凋亡率明显增加,且以早期凋亡为主,细胞的凋亡率随着药物浓度的提升而增加(P<0.01)。与空白组比较,SAN5 μmol/L组及阳性组凋亡蛋白Bax的表达水平明显增强,抗凋亡相关蛋白XIAP、Survivin的表达水平显著降低(P<0.05或P<0.01)。见图5、图6、图7。
4 讨论
在我国,肺癌的发病率与死亡率均居于癌症首位,每年约有80万人被确诊为肺癌,近5年的生存率仅为20%[9]。某些抗癌治疗手段会使免疫系统遭到破坏而导致患者体质变差,且治愈率较低[10]。当前研究[11]证明,中医药不仅可以减轻放疗及化疗的不良反应,还可以有效控制肿瘤恶变程度,在肿瘤康复领域发挥重要作用。因此,从中药中筛选高效、低毒的新型抗癌药物,是目前治疗肺癌相关研究的重要组成部分。
中药单体SAN是从传统草药白屈菜及博落回等罂粟科植物中发现的苯并菲啶类生物碱[3],已被证实具有较好的抗癌活性。已有研究[12-15]证实,SAN在胃癌、肝癌、宫颈癌等多种肿瘤中均有抗肿瘤作用,其机制可能与抑制细胞增殖、促进细胞凋亡及阻滞细胞周期有关。本实验采用MTT法和RTCA法检测SAN对A549细胞增殖的影响,实验结果显示不同浓度SAN处理肺腺癌A549细胞24 h后的增殖率均低于空白组。Western blot结果表明,SAN组肺腺癌A549细胞PCNA蛋白明显降低,PCNA可反映DNA复制的状态,经常作为肿瘤细胞活性标志物。
肿瘤细胞失控性生长的原因之一是细胞周期调控机制发生紊乱,因此采用流式细胞术检测SAN对肺腺癌A549细胞周期的影响,发现A549细胞周期被SAN阻滞于G1期,且药物浓度越高、G1期比重越高。SAN组肺腺癌A549细胞周期相关蛋白Cyclin D1、Cyclin D3、CDK4的表达均降低。在细胞周期中,具有代表性的Cyclin D1和Cyclin D3可促使细胞增殖加快[16]。蛋白激酶CDK4在细胞进入增殖周期时首先被激活,可与Cyclin D1/Cyclin D3紧密结合,形成Cyclin/CDK激酶复合物,加快细胞从G1期到S期进程[17-18]。综上所述,SAN可能通过改变细胞周期相关蛋白表达,使肺腺癌A549细胞周期阻滞于G1期,抑制其增殖。
Annexin V-FITC/PI双荧光染色法是观察SAN对肺腺癌A549凋亡的影响比较直观的实验方法,其检测结果表明,SAN可诱导肺腺癌A549细胞凋亡,且随着药物浓度的增加凋亡率也增加。Bax是具有代表性的促凋亡基因,属于Bcl-2家族,当Bax表达量激增时,会使神经细胞凋亡蛋白酶(Caspases)激活,诱导细胞凋亡;而且编码的Bax蛋白可与Bcl-2结合形成异二聚体,加速肿瘤细胞的凋亡[19-20]。凋亡抑制因子XIAP可通過抑制Caspases活性调节肿瘤细胞的凋亡[21]。Survivin具有肿瘤特异性,只表达于肿瘤和胚胎组织,其表达水平越高提示预后越差[22]。
上述实验结果表明,SAN能抑制肺腺癌A549细胞增殖、诱导其凋亡,但其具体机制需要更深入的研究。
参考文献
[1] HERBST R S, MORGENSZTERN D, BOSHOFF C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689):446-454.
[2] YADAV S, AGRAWAL S, DIVYA RAVALI S S, et al. Lung cancer: analysis of biomarkers and methods of diagnostic and prognostic value[J]. Cellular and Molecular Biology (Noisy-le-Grand, France), 2017, 63(6):88-92.
[3] SEHAMUDDIN G, ANEES R, SIRAJ P, et al. Molecular targets and anticancer potential of sanguinarine-a benzophenanthridine alkaloid[J]. Phytomedicine, 2017,34:143-153.
[4] FU C X, GUAN G P, WANG H B. The anticancer effect of sanguinarine: A review[J]. Current Pharmaceutical Design, 2018, 24(24):2760-2764.
[5] ACHKAR I W, MRAICHE F, MOHAMMAD R M, et al. Anticancer potential of sanguinarine for various human malignancies[J]. Future Medicinal Chemistry, 2017, 9(9):933-950.
[6] 杨 佳,陈 旻,李明花,等.血根碱对人肺腺癌细胞迁移、侵袭和Wnt/β-catenin信号通路的影响[J].肿瘤防治研究,2019,46(12):1057-1061.
[7] YU Y, LUO Y, FANG Z, et al. Mechanism of sanguinarine in inhibiting macrophages to promote metastasis and proliferation of lung cancer via modulating the exosomes in A549 cells[J]. OncoTargets and Therapy, 2020, 13:8989-9003.
[8] 李開瑞,刘 洁,李小娜,等.齐墩果酸对肺腺癌A549细胞增殖及凋亡的影响及机制[J].中国医药导报,2019,16(31):4-9,181.
[9] WANG Z, LI S, WU L, et al. Effect of acupuncture on lung cancer-related fatigue: study protocol for a multi-center randomized controlled trial[J]. Trials, 2019, 20(1): 625-633.
[10] OBERNDORFER F, MüLLAUER L. Molecular pathology of lung cancer: Current status and perspectives[J]. Current Opinion in Oncology, 2018, 30(2):69-76.
[11] 李小江,邬明歆,孔凡铭,等.中药有效成分抗肿瘤活性及作用机制研究进展[J].中草药,2020,51(9):2587-2592.
[12] 胡 灿,金建伟,陆仲夏,等.血根碱抑制人胃癌SGC-7901细胞增殖、迁移和细胞周期的研究[J].中国药理学通报,2019,35(6):844-849.
[13] 张素仙,王妍妍,张 琴,等.血根碱对紫杉醇耐药卵巢癌A2780/Taxol细胞生长及TGF-β1/Smad通路抑制的影响[J].中国中西医结合杂志,2018,38(6):717-720.
[14] 杨艺萱,郭文静,马承旭,等.血根碱通过诱导活性氧促进HepG2细胞凋亡的机制研究[J].中国药理学通报,2018,34(3):370-375.
[15] 李贞彩,姜 平,王秋宇,等.血根碱对宫颈癌细胞增殖、凋亡、侵袭、迁移能力影响机制研究[J].重庆医学,2017,46(22):3039-3042.
[16] CHEN J, LI X, CHENG Q, et al. Effects of cyclin D1 gene silencing on cell proliferation, cell cycle, and apoptosis of hepatocellular carcinoma cells[J]. Journal of Cellular Biochemistry, 2018, 119(2):2368-2380.
[17] LI Y, XIAO X, CHEN H X, et al. Transcription factor NFYA promotes G1/S cell cycle transition and cell proliferation by transactivating cyclin D1 and CDK4 in clear cell renal cell carcinoma[J]. American Journal of Cancer Research, 2020,10(8):2446-2463.
[18] 谢华夏,徐志远,郑国淀,等.槐耳清膏联合顺铂改变胃癌SGC7901细胞周期分布的实验研究[J].浙江医学,2017,39(14):1155-1157,1174.
[19] FENG S, ZHU J, XIA K, et al. Cantharidin inhibits anti-apoptotic Bcl-2 family proteins and induces apoptosis in human osteosarcoma cell lines MG-63 and MNNG/HOS via mitochondria-
dependent pathway[J]. Medical Science Monitor, 2018,24:6742-6749.
[20] L OSUWANNARAK N, SRITULARAK B, CHANVORACHOTE P. Cycloartobiloxanthone induces human lung cancer cell apoptosis via mitochondria-dependent apoptotic pathway[J]. In Vivo, 2018, 32(1):71-78.
[21] YOO J K, LEE J M, KANG S H, et al. The novel microRNA
hsa-miR-CHA1 regulates cell proliferation and apoptosis in human lung cancer by targeting XIAP[J]. Lung Cancer, 2019, 132: 99-106.
[22] LING X M, ZHU F H, ZHOU X M, et al. Survivin is critically involved in VEGFR2 signaling-mediated esophageal cancer cell survival[J]. Biomedicine Pharmacotherapie, 2018, 107:139-145.

