1例肝癌合并上消化道出血及营养代谢异常患者的营养支持及药学监护
梁海,程刚,张华鹏,陈方,冯翠影,杨淼,吴炜*(.亳州市人民医院药学部,安徽 亳州 36800;.亳州市人民医院肿瘤内科,安徽 亳州 36800)
终末期肝病患者普遍存在营养风险和营养不良,肝癌患者的营养不良发生率高达50%~90%[1]。肝脏损伤及功能下降导致碳水化合物、脂肪、蛋白质三大营养物质以及维生素和微量元素等代谢异常。长期营养代谢异常进一步加重肝脏损伤,增加并发症的发生率。营养不良是终末期肝病的独立预测因子[2],与感染、腹水、肝性脑病等并发症均密切相关。上消化道出血是肝癌最严重且危急的并发症,禁食禁水是必要的治疗措施之一[3]。除了根据病因进行肿瘤规范化治疗,营养支持也至关重要。营养药物的选择、用法用量、输液的速度以及实验室监测等会影响患者的营养支持及预后。本文通过临床药师参与对1例肝癌合并上消化道出血及营养代谢异常患者的营养支持治疗,探讨此类疾病营养支持治疗方案的制订与药学监护要点,以期为临床合理用药提供参考。
1 病史资料
患者,男,66 岁,身高167 cm,体质量59 kg,因“呕血、黑便”4 h 入院。入院2 d 前进食坚硬食物后出现上腹部不适,伴反酸、嗳气,自觉有血腥味,同时头晕、乏力明显,无晕厥,约入院前4 h 解黑色成形大便一次,量约100 g,伴呕吐咖啡样液体一次,约200 mL。于2020年3月8日于本院门诊就诊,上腹部CT 提示肝内占位性病变,肝癌可能。为求进一步诊治,收治入院。既往史:酒精性肝硬化23年,本次发病以来,食欲下降,近期体质量下降约3 kg。体格检查:体温36.3℃,脉搏78 次·min-1,呼吸18 次·min-1,血压120/70 mmHg(1 mmHg =133.3 Pa)。神志清醒,呼吸平稳,皮肤黏膜无黄染,有贫血貌,有肝掌、蜘蛛痣;全身浅表淋巴结无肿大;双肺呼吸音清,无干湿啰音;心律齐;腹部膨隆,肝脏未触及,无腹部包块,移动性浊音阴性,无肾区叩击痛,肠鸣音正常。双下肢轻度水肿。辅助检查示,血常规:白细胞计数5.18×109·L-1、红细胞计数2.52×1012·L-1↓、血红蛋白67 g·L-1↓;血生化:白蛋白30.2 g·L-1↓,总胆红素17.9 μmol·L-1,谷丙转氨酶46 U·L-1↑,谷草转氨酶118 U·L-1↑,尿素氮14.2 mmol·L-1↑,葡萄糖5.44 mmol·L-1,钾4.04 mmol·L-1, 钠137.91 mmol·L-1, 氯102.14 mmol·L-1,余均正常。凝血:PT 15.3 s ↑,D-二聚体3.24 μg·mL-1↑。肝脏穿刺活检病理提示:肝细胞性肝癌。入院诊断:肝恶性肿瘤;酒精性肝硬化失代偿期、食管胃底静脉曲张破裂出血、腹水、贫血。
2 主要治疗经过与药学监护
患者入院后禁食禁水,给予奥美拉唑抑酸护胃,矛头蛇毒血凝酶止血、醋酸奥曲肽降低门脉压、还原谷胱甘肽保肝等对症治疗。3月9日,复查血红蛋白较前下降,血红蛋白50 g·L-1↓,输注“O 型 RhD 阳性”悬浮红细胞1 U。3月10日,给予脂肪乳氨基酸(17)葡萄糖(11%)1440 mL。3月15日,复查胆红素出现升高,总胆红素54.9 μmol·L-1↑,直接胆红素30.5 μmol·L-1↑。临床药师会诊并调整营养支持方案(见表1),给予个体化全肠外营养(TPN)支持,并实施药学监护,患者生化指标未见异常,血糖未见明显波动(7.8 ~10 mmol·L-1)。TPN 支持3 d(3月16日~3月18日)后,患者消化道出血症状得到控制,饮食逐渐恢复,继续补充性肠外营养(SPN)支持。3月20日,患者出现嗜睡,神情淡漠症状,次日加重,双眼同向凝视麻痹,意识模糊,定向力障碍,小便失禁。头颅MR +DWI 提示:丘脑两侧和中脑导水管周围异常信号,呈DWI 对称性高信号。结合患者病史及临床症状,确诊韦尼克脑病(WE)。临床药师建议停肠外营养,增加经口营养补充,同时给予200 mg 维生素B1肌内注射tid。医师采纳建议,24 h 后患者精神状况明显改善,意识转清,3 d 后神清,精神可。3月25日,患者半流质饮食增加至1000 mL,未出现腹胀等营养不耐受情况,复查白蛋白、血糖、电解质等水平正常,予以停药出院(见表2)。
3 分析和讨论
3.1 营养筛查与评定
鉴于营养不良对临床结局的影响,所有终末期肝病患者,特别是肝硬化失代偿期患者均应进行营养筛查与评定[4]。营养风险筛查2002(Nutritional Risk Screening 2002,NRS 2002)包含其他营养筛查工具的营养指标部分,同时对疾病的严重程度进行评分,能够反映因疾病增加的营养需求,发现营养状态与临床结局的相关性,是住院患者营养风险筛查的有效工具[5]。该患者入院诊断为肝恶性肿瘤合并多种并发症,Child-Pugh C级,若以实际体质量计算,体质指数(BMI)为21.15 kg·m-2,入院时体质量下降约3 kg,近一周饮食明显减少,营养状况受损评2 分;疾病严重程度评1 分;年龄66 岁,NRS 2002 总评分3 分,该患者存在营养不良风险。
Child-Pugh C 级营养不良的发生率在70%~90%[6],由于机体蛋白合成障碍以及外源性氨基酸输注影响,实验室检验指标不能准确评定营养状态。加之,受到外周水肿、腹水等因素的影响,目前国内外尚无一种评定工具适合所有患者[7]。主观整体评价(SGA)具有良好的重复性,但主观性强,与其他客观营养指标相比,低估了肝病患者肌肉减少的发生率[8]。国外学者提出在SGA 基础上增加 BMI、上臂肌围(AMC),计算膳食摄入,评价结果较为客观,但费时且不便操作[9]。我国学者提出的肝病营养评价(NALD)指标,尚需循证及大范围临床实践验证其临床有效性[10]。综上,该患者选择SGA 评价营养状况(包括体质量减轻、饮食摄入变化、胃肠道症状、疾病是否会影响营养摄入以及营养相关身体检查),并计算AMC 作为定量判断标准[11]。患者入院营养状况评价:上臂围(AC)27 cm,三头肌皮褶厚度(TSF)14 mm,AMC 22.6 cm(AMC=AC-3.14×TSF)(我国成人TSF 参考值为:男8.3 mm,女15.3 mm;AMC 参考值为:男24.8 cm,女21.0 cm,大于参考值的90%为正常[11])。TSF和AMC 能够较好地反映体内皮下脂肪和蛋白质储存及消耗程度,此外,AMC 在预测肌肉减少症上表现出很好的预测价值。该患者SGA 评定为轻中度营养不良。
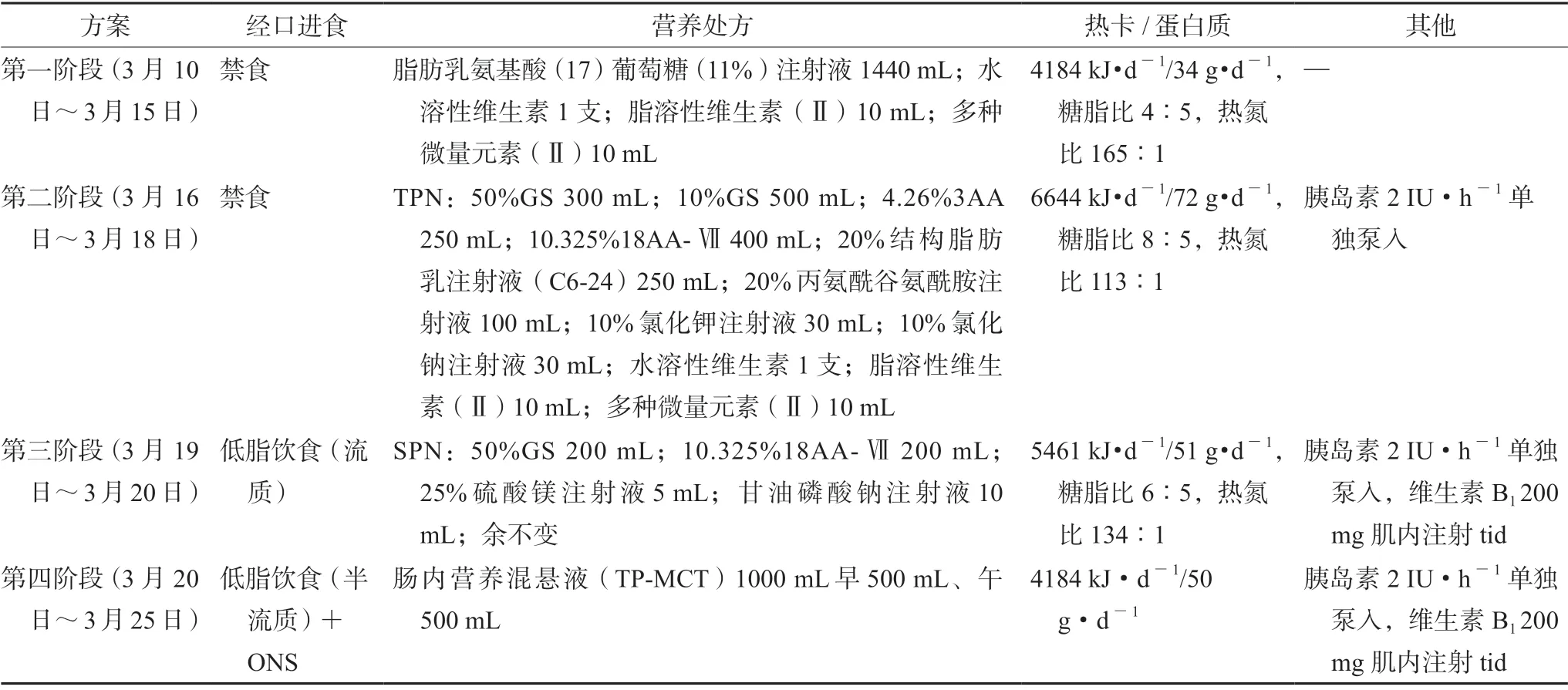
表1 营养支持方案的干预情况Tab 1 Interventions in nutritional support program
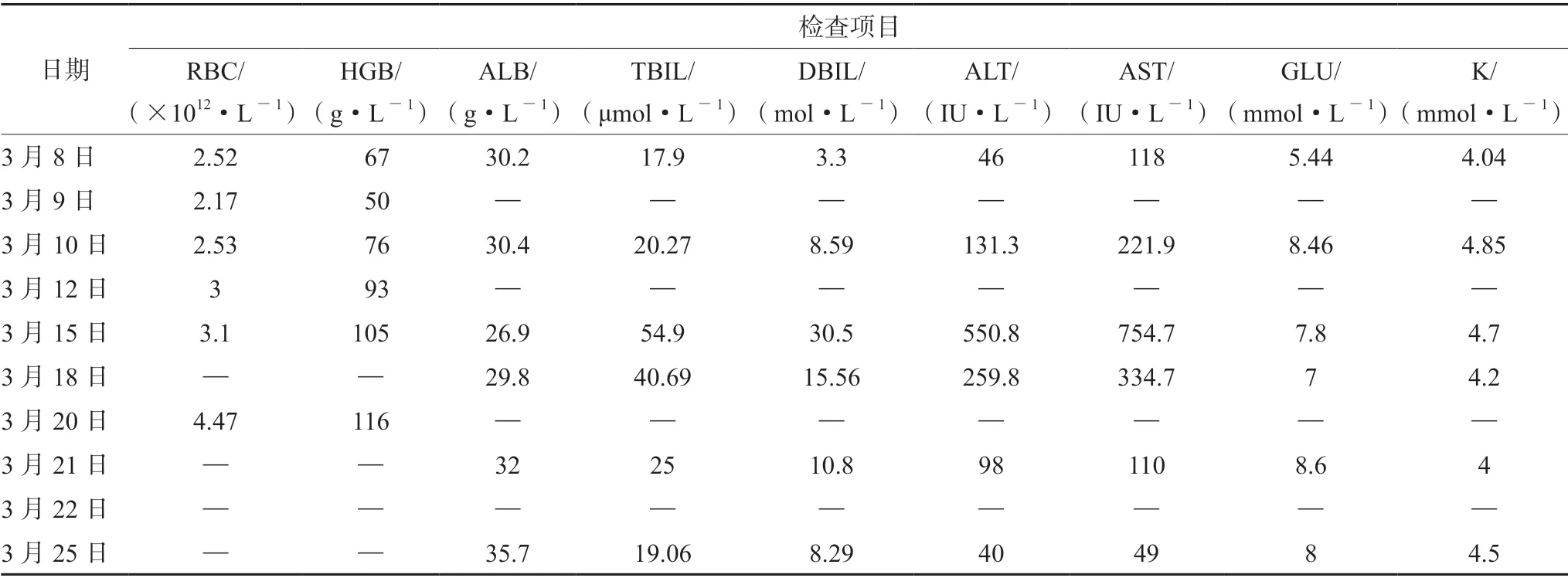
表2 主要实验室检查数据Tab 2 Main laboratory inspection data
3.2 个体化营养支持方案分析
3.2.1 总能量和蛋白质需求 正常人摄入的营养物质从肠道吸收后经门静脉进入肝脏代谢、利用,而肝癌合并肝硬化患者可因门脉高压、上消化道出血、肝功能减退等导致体质量下降。由于患者处于高代谢状态,整体能量消耗测量值约为基础代谢率的130%[3]。根据水肿情况选择实际体质量或理想体质量进行能耗计算,亦有研究报道在液体滞留的情况下,根据患者的干重(穿刺后体质量或液体滞留前的体质量)或腹水的严重程度校正后的体质量进行计算(轻度腹水扣除体质量5%,中度腹水扣除体质量10%)[12]。该患者采用校正体质量56 kg,通过估算患者总热卡约7029 kJ·d-1[126 kJ/(kg·d)],蛋白质1.2 ~1.5 g/(kg·d)。低于目标能量70%即为低热卡或喂养不足。该患者初始营养支持使用脂肪乳氨基酸(17)葡萄糖(11%)1440 mL,该制剂可提供热卡4184 kJ·d-1,蛋白质34 g·d-1[0.6 g/(kg·d)],仅提供患者目标能量的60%,不能满足患者能量和蛋白质的需求。调整为个体化TPN 处方后,可提供能量6644 kJ·d-1,为患者目标能量的95%,蛋白质72 g·d-1[1.2 g/(kg·d)],其中支链氨基酸(BCAA)为17.85 g·d-1[0.3 g/(kg·d)],BCAA 分解代谢主要在骨骼肌,更符合患者的代谢需求。适量增加BCAA 是有益的,但目前最佳剂量并未明确,且富含BCAA 和增强免疫的营养支持方案在发病率或病死率方面没有优势,只有伴肝性脑病患者才需要含高浓度BCAA 的氨基酸溶液,因此暂不推荐肝病专用型氨基酸[13]。
3.2.2 糖脂双能源系统的选择 肝癌合并肝硬化患者对碳水化合物的利用能力有限,脂肪的氧化率增加。对于禁食超过12 h,静脉滴注葡萄糖2 ~3 g/(kg·d),超过72 h 则需要给予TPN 支持[13]。葡萄糖作为重要的碳水化合物,满足人体所有细胞的代谢。该患者葡萄糖给予量应覆盖50%~60%非蛋白热卡[13],维持大脑、肾髓质以及红细胞等的能量消耗。脂肪乳氨基酸(17)葡萄糖(11%)1440 mL 中含有葡萄糖97 g [1.6 g/(kg·d)],提供1623 kJ·d-1热卡(占非蛋白热43%),碳水化合物的供给不足。个体化TPN 处方中含碳水化合物200 g [3.3 g/(kg·d)],占非蛋白热61%,葡萄糖略高于指南推荐剂量。肝硬化合并高血糖的患者中,高血糖水平与肝硬化进展相关,合并低血糖生存时间明显低于高血糖或血糖正常患者生存时间。因此,密切监护血糖,并控制血糖在合理的范围,避免低血糖,对患者的临床结局有重要影响。住院患者的血糖管理需结合患者的疾病状况,对患者进行分层管理,设定不同的血糖控制目标。肝功能不全患者为低血糖高危人群,应宽松控制血糖(空腹血糖7.8 ~10 mmol·L-1,随机血糖或2 h 餐后血糖7.8 ~13.9 mmol·L-1)[14]。ASPEN建议TPN期间血糖控制目标为7.8 ~10 mmol·L-1[15]。但考虑该患者糖耐量异常,亦有可能出现高血糖,为避免高血糖的发生,同时给予胰岛素2 IU·h-1单独泵入控制血糖。
不同原因(酒精性和非酒精性)诱发的肝硬化肝癌物质代谢具有显著差异。对于酒精性肝硬化患者而言,营养物质氧化供能比例倒置,脂肪为主要的供能物质,同时伴随糖利用障碍,可能与该类患者脂肪廓清能力增强,乙醇影响了还原型辅酶Ⅰ与辅酶Ⅰ比值而抑制糖异生和糖酵解等因素有关[16]。但若脂肪摄入过多超过肝脏的代谢能力,则会沉积于肝内,影响糖原的合成,导致肝脏进一步损伤。ESPEN 建议肝硬化肝癌患者脂肪提供40%~50%非蛋白热卡,脂肪乳供给在1.0 g/(kg·d),失代偿期患者不宜超过1.0 g/(kg·d),输注速度0.1 g/(kg·h)。此外与传统的大豆油脂肪乳相比(n-6∶n-3 =8∶1),肝硬化肝癌患者应选择n-6 脂肪酸含量较低的脂肪乳剂[13]。研究显示,结构脂肪乳被认为是肝功能不全患者比较理想的能源物质,在改善总胆红素和直接胆红素等肝功能方面优于长链脂肪乳(LCT),在血浆的清除和氧化速率均优于物理混合的中长链脂肪乳(MCT/LCT)[17]。同时,配合使用一定的免疫营养素丙氨酰谷氨酰胺有利于改善患者的免疫功能。该患者使用的脂肪乳氨基酸(17)葡萄糖(11%)中的脂肪乳剂全部来源于以大豆油为基础的LCT,含有大量的n-6 多不饱和脂肪酸和植物甾醇,促进肝脏炎症反应[18]。该制剂中含脂肪51 g,提供热量约1920 kJ(占非蛋白热卡51%)。个体化TPN处方中含50 g 化学合成的MCT/LCT(占非蛋白热40%),在脂肪乳的选择上更适合该患者。
3.3 营养支持并发症的关联性分析及药学监护
患者TPN 期间出现神情淡漠、意识障碍等临床症状,经头颅MR +DWI 确诊为WE。WE 是维生素B1缺乏所导致的中枢神经系统并发症。该患者酒精性肝硬化23年,入院后禁食18 d,胃肠道无法获取维生素B1,且自身无法合成维生素B1。TPN 期间1 支水溶性维生素仅含有3.1 mg 维生素B1,而成人维生素B1的日需要量推荐6 mg[19],未及时补充足量维生素B1。另外,200 g 过量葡萄糖使丙酮酸脱氢酶反应减慢,维生素B1作为α-酮酸氧化脱羧酶系的辅酶被大量消耗。因此,维生素B1长期消耗以及摄入不足是引起WE 的主要原因。
针对以上原因分析后,医师采纳临床药师建议,停肠外营养,增加经口营养补充,在低脂流质的基础上给予肠内营养混悬液(TP-MCT)1000 mL(早500 mL、午500 mL)降低肝脏及胃肠道负担[20]。同时,给予200 mg 维生素B1肌内注射tid(避免含糖输液对维生素B1的影响,在使用含糖输液前给予)。3 d 后患者神清,精神可,对答切题,提示治疗有效。
4 总结
终末期肝病的主要并发症包括营养不良、腹水、葡萄糖耐量改变、脂肪吸收不良、肝肾综合征等,都与营养密切相关。为肝病患者提供合理的营养治疗,可以改善患者的营养状况并减少一系列并发症发生,缩短住院时间,减少病死率。本文临床药师对1例肝癌合并上消化道出血及营养代谢异常患者进行营养筛查与评定,及时给予患者营养支持,并结合患者的病情特点及临床表现,为医师和患者推荐合适的药物,协助医师制订个体化营养支持方案,并在营养支持期间对并发的WE 进行关联性分析,及时调整营养方案并加强治疗过程中的药学监护,保证临床营养支持的安全、有效。

