慢性阻塞性肺病药物治疗靶点及其药物研发进展
颜 佩,叶连宝,陈伟强
(1广东药科大学药学院,广州510006;2广东药科大学护理学院,广州510006)
慢性阻塞性肺病(chronic obstructive pulmo⁃nary disease,COPD)是全球高发病率和高病死率的疾病之一,与呼吸道的慢性炎症增强有关[1]。COPD患者因肺部病变或肺内气道狭窄导致呼气和吸气时气流受限,易出现呼吸困难的症状,一般用气流受限(airflow limitation,AL)即伴有小气道阻塞和用力呼气容积(forced expiratory volume,FEV)较低来定义,1 s用力呼气容积占用力肺活量百分比(FEV1/FVC)是评价AL的一项敏感指标,当FEV1/FVC<0.7时被定义为AL。慢性支气管炎和肺气肿患者出现气流受限且不能完全可逆时即可诊断为COPD[2]。此外,COPD通常伴随肺功能的异常下降,由此而导致的慢性呼吸衰竭是该病的主要死亡原因。本文重点综述了COPD的发病机制、治疗靶点以及相关药物的最新临床研究进展,以期为COPD靶向药物的开发提供参考。
1 COPD的致病因素
吸烟通常被认为是COPD最主要的致病因素[3],然而多项研究表明部分患者没有吸烟史[4]。此外环境诱因如烟草烟雾、空气污染、汽车尾气以及有毒气体等在COPD的发展中也发挥着十分重要的作用[5]。其他因素还包括性别和年龄:一般来说,由于男性吸烟人数多于女性,男性COPD的患病率通常高于女性,但实际上女性患COPD的风险更高[6]。COPD的病死率与年龄呈正相关,老年患者更容易并发呼吸衰竭等而导致死亡[7]。此外,支气管高反应性和哮喘导致的肺功能下降,遗传、社会经济地位、贫困、体重指数和呼吸系统感染等多种因素都与COPD密切相关[8]。弄清楚COPD患病的危险因素有助于COPD的预防、筛查和治疗,同时也为靶向COPD治疗药物的发现奠定基础。
2 COPD的发病机制
2.1 氧化应激
氧化物和抗氧化物失衡会促进炎症基因的表达、气道黏液分泌以及抗蛋白酶失活[9]。核因子E2相 关 因 子2(nuclear factor E2-related factor,Nrf2)通过介导Keap1-Nrf2-ARE等信号通路能调节抗氧化基因的表达,通常情况下处于未激活状态的Nrf2与Keap1在细胞质中结合,长时间未激活的Nrf2会被泛素化,进而被降解,阻止其在细胞质中累积。当被活性氧(reactive oxygen species,ROS)刺激时,Nrf2从Keap1-Nrf2的结合态中游离而被释放出来,进而转移到细胞核中与ARE结合,继而激活下游目标基因促使其转录。因此,靶向该信号通路的作用环节可能成为治疗COPD的潜在靶点。
2.2 蛋白酶/抗蛋白酶失衡
肺中性粒细胞浸润通过释放蛋白酶如中性粒细胞弹性蛋白酶(neutrophil elastase,NE),组织蛋白酶G(cathepsin-G,CG),蛋白酶3(proteinase 3,PR3)而导致蛋白酶和抗蛋白酶失衡[10],这一过程在COPD的发生中发挥着关键作用。抗蛋白酶在细菌包裹、病原菌吞噬、黏液素分泌亢进和黏液纤毛清除中起重要作用。同时NE通过降解肺实质结缔组织的主要成分弹性蛋白而加剧COPD。若弹性蛋白酶活性增加或抗蛋白酶活性降低和功能缺乏时会导致肺气肿和中性粒细胞炎症及黏液分泌增多,进而可能发展成不可逆的COPD。
2.3 免疫机制
与COPD相关的免疫机制主要包括先天免疫激活、适应性免疫的转变和气道上皮的形态学改变。先天免疫激活是指吸入的颗粒和病原体被肺泡上皮细胞和巨噬细胞质膜上的受体(pattern recognition receptors,PRRs)识别,通过caspase-1依赖机制产生炎性细胞因子,形成与核苷酸结合的寡聚结构域样(NLR)P3炎性小体。Pauwels等[11]研究发现,吸烟诱导的肺部炎症与NLRP3炎症小体或caspase-1的缺陷无关,但目前多项研究支持NLRP3炎性小体参与COPD的发病机制,这一领域仍存在争议,需要进一步研究。适应性免疫的转变是细胞和组织损伤释放的抗原被树突状细胞识别,并呈递给T淋巴细胞,从而激活适应性免疫。烟雾颗粒诱导的NETs可增强浆细胞样树突状细胞,产生CD4阳性T细胞Th1和Th17[12],进而激发适应性免疫的转变。气道上皮的形态学改变是指当慢性接触烟雾颗粒时会直接影响气道上皮的形态和功能。有害颗粒介导的ROS通过表皮生长因子受体依赖机制破坏上皮屏障,同时也激活RHO1相关的蛋白激酶,最终导致E-cadherin基因表达的减少、黏附连接的破坏、上皮屏障的破坏和E-cad⁃herin表达的减少进而诱导上皮-间质转化,导致MMPs和生长因子的产生异常、气道破坏和重塑[13-14]。COPD的免疫机制十分复杂,很多研究处于初步阶段,还需继续深入探究。
2.4 细胞衰老和细胞修复机制
COPD的发病率与年龄增长呈正相关主要有以下几个原因,如端粒缩短、细胞衰老、激活磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapa⁃mycin,MTOR)信号通路、DNA修复缺陷、microRNA模式异常和表观遗传改变等[15]。其潜在的作用机制可能是细胞内外ROS的产生,ROS水平过高时,p53肿瘤抑制蛋白被激活导致细胞周期阻滞和衰老[16]。PI3K/AKT/mTOR信号通路是加速细胞衰老导致COPD的主要原因。正常情况下肺具有再生能力,由气道基底祖细胞分化而来的新上皮细胞替代损伤的气道上皮细胞,当肺基底祖细胞数量减少,丧失了自噬能力和多潜能,影响了细胞自我修复能力,从而可能引发COPD,基底祖细胞的功能障碍与COPD严重程度相关[17]。
2.5 细胞坏死和细胞自噬
细胞坏死是一种精心设计的细胞死亡形式,受体相互作用于依赖性蛋白激酶(RIPK)3和非依赖性caspase的程序性坏死被定义为坏死性凋亡[18]。Pouwels等[19]研究发现烟雾诱导的坏死性凋亡和DAMPs的释放在模型小鼠中引发嗜中性粒细胞炎症,细胞坏死抑制剂necrostatin-1可以使炎症减轻。Wang等[20]研究报道内质网伴侣蛋白GRP78能促进烟雾诱导的炎症反应和气道上皮细胞黏液增生,其作用机制可能是上调坏死性凋亡以及激活NF-κB和激活蛋白1(AP-1)。自噬被认为是一种非选择性的自我降解系统,且具有选择性,包括对特定细胞器和病原体的选择性降解。有报道称,自噬可选择性地靶向线粒体(线粒体吞噬),与正常人相比COPD患者肺中线粒体自噬标志物蛋白水平降低,即通过抑制线粒体吞噬作用,增强气道上皮细胞线粒体ROS的产生并促进细胞衰老[21]。这些研究表明细胞坏死和细胞自噬在COPD的发生发展中起着至关重要的作用。
3 COPD治疗药物的临床研究进展
3.1 支气管扩张药物
3.1.1 β2受体激动剂 经吸入给药的支气管扩张剂是治疗COPD的一线药物,直接作用于气道以减少全身副作用。β2受体激动剂通过激活气道平滑肌细胞上的β2-受体进而松弛气道平滑肌、扩张支气管[22]。部分药物已经批准用于COPD的临床治疗或正进行临床试验,包括短效β2受体激动剂(shortactingβ2-adrenoreceptor agonists,SABAs),长效β2受体激动剂(long-actingβ2-adrenoreceptor agonists,LABAs)。目前FDA批准用于治疗COPD的SABA及LABA药物具体情况如表1所示。这里主要讨论β2受体激动剂的最新研究进展,及部分代表药物的临床研究情况。其中沙美特罗(salme⁃terol)、维兰特罗(vilanterol)、阿贝替罗(abediterol)属于水杨醇类LABA药物,是目前被研究的最为深入的一类β2受体激动剂。川丁特罗(trantinterol)是一种新型的LABA药物,其特有的亲脂性结构使其作用时间长于其他药物,目前该药正在进行哮喘治疗的Ⅳ期临床实验[23]。
3.1.2 毒蕈碱拮抗剂 毒蕈碱拮抗剂作用于迷走神经胆碱能分支,通过降低胆碱能张力放松气道平滑肌,减少空气滞留和劳力性呼吸困难,改善气道狭窄,胆碱能M3受体在介导平滑肌收缩方面具有重要的临床意义[24]。部分作用于该受体药物已批准用于临床治疗或正进行临床试验,包括短效毒蕈碱拮抗剂(short-acting muscarinic antago⁃nists,SAMAs)以及长效毒蕈碱拮抗剂(long-acting muscarinic antagonists,LAMAs)。目前FDA批准用于治疗COPD的SAMA,LAMA类药物具体情况如表1所示。这里主要讨论毒蕈碱拮抗剂的最新研究进展,及部分代表药物的临床研究情况。由Theravance Biopharma公司研发的一种新型LAMA药物瑞维那新(revefenacin)对M3受体具有较高亲和力(Ki=0.18 nmol/L),其平行组高中低3个剂量(88,175,350µg)进行为期28 d的Ⅱ期临床研究,结果显示超过80%的患者FEV1较基线升高至少100 mL,支气管持续扩张24 h,这一结果得到了为期12个月的Ⅲ期临床安全性研究的支持[25],于2018年11月被FDA批准用于COPD的治疗。BCQB是一种新型的SAMA,其化学结构与LAMA药物相似,BCQB对M3受体有高亲和力(p Ki=8.21)且对M2受体有选择性,有望成为一种新型毒蕈碱拮抗剂治疗COPD。

表1 FDA批准用于治疗慢性阻塞性肺病(COPD)的支气管扩张药
3.1.3 作用于β2受体和毒蕈碱受体的双靶点药物 MABA是一类新型具有毒蕈碱拮抗剂和β2激动剂双重作用的双靶点药物。由GlaxoSmithKline公司研发的巴芬特罗(batefenterol)是最新的MABA类药物,Ⅱ期临床研究结果显示该药的所有测试剂量的耐受性优于比安慰剂和阳性对照沙美特罗(50µg,每天2次),最佳剂量是400µg每天1次或200µg每天2次,能显著改善中度至重度COPD患者的FEV1。AstraZeneca公司研发的AZD8871在Ⅱ期临床研究结果显示,当给予剂量为400或1 800µg时,可以使COPD患者支气管持续扩张36 h,给药两周后FEV1显著增加,且在100/600µg剂量下无严重不良事件发生。LAS190792是一种新型长效MABA,吸入该药可以诱导犬支气管持续扩张13.3 h,且心脏效应较小,在Ⅰ期临床研究阶段中几乎没有副作用。目前处于临床研究阶段的MABAs药物见表2。
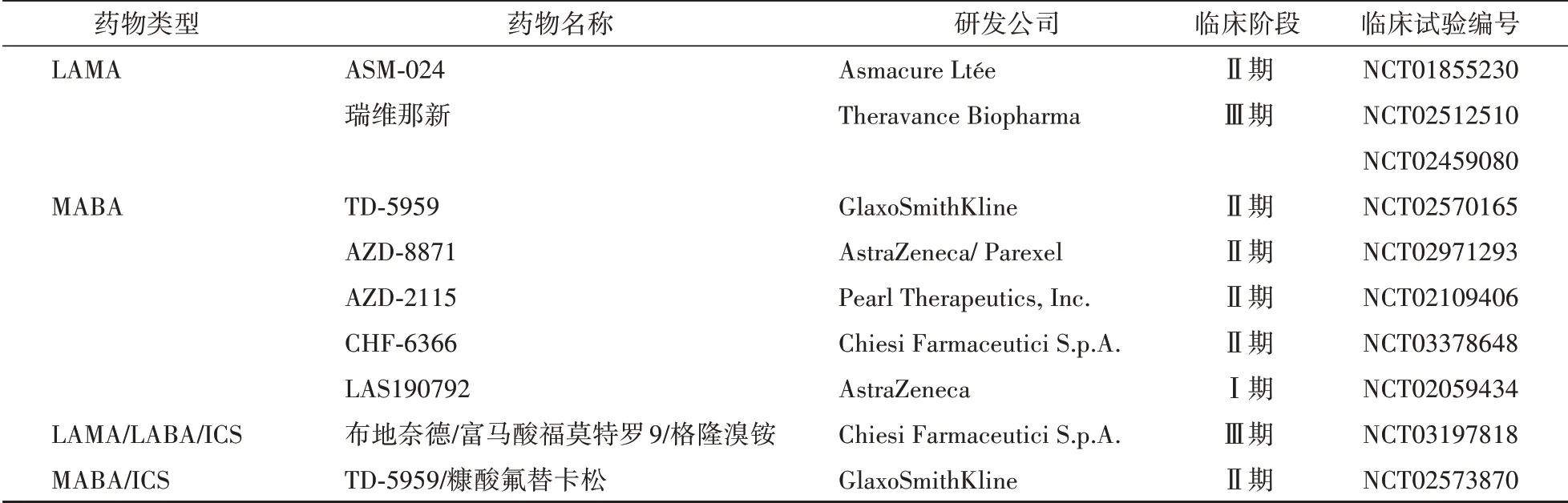
表2 用于COPD的支气管扩张药和支气管扩张药/ICSFDCs的临床研究
3.1.4 LAMAs和LABAs药物的联合应用 LAMA/LABA复方制剂(fixed-dose combinations,FDCs)具有扩张支气管和抗炎的双重作用,药物的联合使用有助于减少副作用并增加疗效。近年来,新型支气管扩张剂的发现主要集中在LAMA/LABA FDCs或支气管扩张剂与吸入皮质类固醇(inhaled cortico⁃steroid,ICS)的联合使用。联合用药的Ⅲ期临床实验结果显示QVA149(茚达特罗(indacaterol)/格隆溴铵(glycopyrroniumbromide),LABA/LAMA FDCs)比LABA/ICSFDCs(沙美特罗(salmeterol)/氟替卡松(fluticasone))对患者FEV1改善更明显。因此,LABA/LAMA/ICS三联吸入治疗可能更利于改善肺功能,防止病情加重。新近联合使用药物临床研究情况如表2,上市批准情况如表3。

表3 最新批准用于COPD的LAMA/LABA FDCs和支气管扩张剂/ICSFDCs
3.1.5 茶碱及其衍生物 茶碱具有支气管扩张的作用,因此被广泛用于治疗各种呼吸道疾病。低剂量茶碱可增加COPD患者肺泡巨噬细胞HDAC2的表达和活性,从而逆转皮质类固醇的抵抗作用[26]。多索茶碱的抗炎、扩张支气管作用与茶碱相当,但与茶碱相比对COPD患者肺功能的改善更有效,副作用更少。除了茶碱和多索茶碱外,还有300多种茶碱衍生物(例如氨茶碱和叶黄素),其中许多药物对ARs和PDEs没有选择性,可能会引起副作用。因此,设计和合成无PDE抑制作用的新型茶碱衍生物可能为COPD治疗提供新的机会。

3.2 具有抗炎作用的靶点药物
3.2.1 靶向炎症介质的药物 靶向炎症介质的药物主要有以下几类:细胞因子抑制剂和趋化因子受体拮抗剂,含有NOD-、LRR-和pyrin结构域蛋白3(NOD-,LRR-and pyrin domain-containing 3,NLRP3)炎性体抑制剂,白三烯B4(leukotriene B4,LTB4)受体拮抗剂和LTB4合成调节剂。细胞因子和趋化因子是治疗炎性气道疾病的重要靶标,目前研究较多的是CXCR2拮抗剂,根据结构特点可以分为甲酰胺类(SCH527123)、嘧啶类(AZD-5122,AZD-5069)、二芳基脲类(GSK1325756)、噻唑嘧啶类(AZD-8309),由默沙东研发的那伐立辛(navarixin)是一种强效的CXCR2拮抗剂,在为期12周口服治疗的临床Ⅱ期研究中发现,该药对COPD患者FEV1有改善作用,但该药于2018年12月终止了临床研究。一种二芳基脲类CXCR2拮抗剂SB-656933可影响臭氧诱导的气道炎症[27],目前正处于Ⅰ期临床研究。另一种二芳基脲类CXCR2拮抗剂GSK1325756在Ⅱ期临床研究也有一定进展。阿斯利康研发的一种嘧啶类CXCR2拮抗剂AZD-5122正处于Ⅰ期临床研究,另一种嘧啶类CXCR2拮抗剂AZD-5069针对COPD患者开展的Ⅱ期临床研究已于2011年完成,可后未见更多进展。CCR1拮抗剂AZD-4818Ⅱ期临床研究发现其对中度至重度COPD患者无效。NLRP3炎性体抑制剂通过间接阻断细胞因子IL-1β和IL-18而起作用,目前这一靶点药物对COPD开展的临床研究非常有限,仅几个报道与COPD相关,如MCC950、SKF-39162、TAK-242、Bromoxone。这些抑制剂在COPD的治疗中要么缺乏临床研究,要么临床研究结果不容乐观,目前大都处于终止状态。值得庆幸的是还有5-LO抑制剂PEP03正处于Ⅱ期临床研究中,但具体研究情况并不明确。靶向炎症介质药物的临床研究情况见表4。

表4 用于COPD的趋化因子受体拮抗剂临床研究

3.2.2 蛋白酶抑制剂 靶向蛋白酶药物有以下几类:中性粒细胞弹性蛋白酶抑制剂(neutrophil elastase inhibitors,NEI)、基质金属蛋白酶(matrix metalloproteinase,MMP)抑制剂、蛋白酶3(protein⁃ase 3,PR3)抑制剂。人中性粒细胞弹性蛋白酶(human neutrophil elastase,HNE)在炎症疾病的治疗领域是一个十分有希望的靶点,近几年HNEI在COPD的治疗研究较多。西维来司他(sivelestat)是唯一批准上市的HNEI,用于治疗急性肺损伤和急性呼吸道疾病。其他HNE抑制剂如AZD9668,Ⅱ期临床试验结果显示其pIC50为7.9 nmol/L,Ki为9.4 nmol/L,Kd为9.5 nmol/L,由于脂肪分布异常等严重不良反应,现研究已经终止。值得庆幸的是由Bayer公司研发的一种新型具有高选择性的HNE抑制剂BAY-85-8501具有良好的药代动力学特性,例如半衰期为8.5 h,口服生物利用度为63%,其Ⅱ期临床试验对非囊性纤维化支气管扩张患者的安全性和有效性进行了评估。另一种口服具有高选择性的HNE抑制剂MPH996在临床实验未达到主要治疗终点,目前正在募集受试人群进行Ⅱ期临床实验。MMP是一类结构相关的锌依赖性金属酶,也是抗炎治疗的重要靶点之一。其中,MMP-12对COPD的发生发展起关键作用,马立马司他(marimastat)是一种非选择性MMP抑制剂,可显著抑制MMP-12诱导的早期炎症,研究者对其进行了肿瘤治疗的临床试验,但由于关节痛和肌肉骨骼疼痛的副作用限制了其发展。AZ11557272是MMP-9/MMP-12双靶点抑制剂,豚鼠模型的研究中发现其能减少70%由烟雾引起的总肺活量、剩余容积和肺活量的增加,并防止小气道重塑[28],有望作为候选药物进行临床研究。另一个由AstraZeneca公司研发的MMP-9/MMP-12双靶点抑制剂AZD1236,已进行了COPD治疗的Ⅱ期临床研究,但目前并没有报道临床疗效。PR3和HNE是同源蛋白酶,具有调节炎症反应的特殊功能,但PR3抑制剂的研究正处于起步阶段。靶向蛋白酶的药物临床研究见表5。

表5 用于COPD的靶向蛋白酶药物临床研究

3.2.3 激酶抑制剂 靶向激酶药物有以下几类:IKKβ抑制剂、p38 MAPK抑制剂、PI3K抑制剂、JAK抑制剂、EGFR抑制剂。NF-κB通路能诱导多种炎症基因表达并参与炎性小体的激活和氧化应激过程,IKKβ是NF-κB通路重要的一部分,IMD-3054是一种选择性IKKβ抑制剂,在气道炎症的小鼠模型研究其对NF-κB转录活性抑制作用的IC50为1.2µmol/L,前期对该药前体药物IMD-1041进行了抗炎测试的Ⅱ期临床实验,由于其前药易产生耐受性的原因导致研究终止。此外,在COPD相关模型中研究了其他IKKβ抑制剂包括BAY65-1942、TPCA-1、PS-1145和ainsliadimer-A的体内外抗炎作用,这些研究为它们作为抗炎药进行COPD的临床治疗提供了有力的依据[29]。p38 MAPK可以调节多种炎症基因的表达,口服型p38 MAPK抑制剂是目前研究最为广泛的一种激酶抑制剂,其中BCT-197、PH-797804、洛吡莫德(losmapimod)和地尔莫德(dilmapimod)等这些药物已经完成了治疗COPD的Ⅱ期临床试验。虽然口服型p38 MAPK抑制剂是有效的,但口服大剂量药物可能会产生全身副作用,因此吸入型p38 MAPK抑制剂的发现是改善治疗窗口的另一种策略,目前有部分吸入型药物正进行治疗COPD的临床评估,其中PF-03715455、AZD-7624、CHF-6297和RV-568已经完成了Ⅱ期临床试验,GSK610677进行了Ⅰ期临床试验,这些药物最终能否有效治疗COPD还有待进一步研究。PI3Ks能产生脂质第二信使,在免疫系统中起着不可或缺的作用,PI3Kδ和PI3Kγ是PI3Ks的亚型,由GlaxoSmithKline公司研发的GSK2269557是一个吸入型具有选择性的PI3Kδ抑制剂,在对120名受试者进行为期12周的Ⅱ期临床试验的评估中发现其痰中IL-8、IL-6水平降低。TG100-115是一种吸入型具有选择性的PI3Kδ/γ抑制剂,在哮喘小鼠模型研究中发现TG100-115剂量在1~100µg/kg范围内可以减少约50%(P<0.05)的气道高反应[30],并且有良好生物活性、药代动力学和安全性,可作为候选药物进行治疗COPD的临床研究。另一种PI3Kδ抑制剂LAS191954在大鼠和犬模型研究中发现其具有良好的PK值,半衰期分别为3.1和10.2 h,具有口服生物利用度高(101%,98%)且清除率低[9.6,1.4 mL/(min·kg)]等特点[31],这些结果显示,LAS191954有望成为一个口服长效候选药物。JAK通过磷酸化信号转导子和转录激活子蛋白来调控多种炎症基因的表达,研究发现吸入型pan-JAK抑制剂PF1367550能减少BEAS-2B细胞和气道上皮细胞CXCL9,CXCL10,CXCL11的释放[32],有益于COPD的治疗。EGFR可以介导气道上皮细胞黏液分泌过度和IL-8在气道上皮细胞中的表达,并且有研究发现EGFR抑制剂AG-1478可以抑制香烟烟雾诱导的体内外黏液素合成[33],由Boehringer Ingelheim公司研发的EGFR抑制剂BIBW 2948为期4周的Ⅱ期临床试验结果表明该药耐受性较差,且有肝功能异常以及FEV1降低等副作用,导致该药临床研究被迫终止。靶向激酶的药物临床研究进展见表6。

表6 用于COPD的靶向激酶药物临床研究
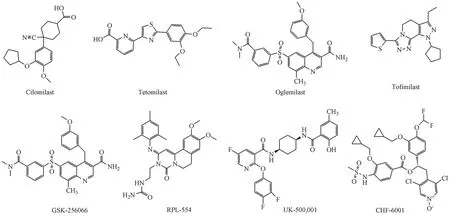
3.2.4 PED4抑制剂 磷酸二酯酶4(phosphodies⁃terase-4,PDE4)抑制剂具有广谱抗炎作用,在COPD的治疗中有重要意义[34],包括口服型PDE4抑制剂、吸入型PDE4抑制剂、新一代PDE4抑制剂、双靶点PDE3/4抑制剂。罗氟司特(roflumilast)是唯一批准用于治疗COPD的口服型PDE4抑制剂,临床研究表明,每日剂量500µg可降低COPD的发作频率并改善肺功能。第二代口服型PDE4抑制剂西洛司特(cilomilast)是治疗COPD的首选药物,Ⅰ期和Ⅱ期临床研究结果显示其可显著改善患者肺功能,但Ⅲ期临床研究显示该药治愈率低,另一个PDE4抑制剂替托司特(tetomilast)具有半衰期长(24 h)、生物利用度高(100%)等特征,目前正进行治疗COPD的Ⅱ期临床试验。吸入型PDE4抑制剂通过减少全身暴露使副作用最小化和治疗窗口最大化,目前许多吸入型PDE4抑制剂正在进行临床实验研究,但还没有药物被批准使用,其中吸入型PDE4抑制剂UK-500,001由于临床研究的结果为阴性而被停用,奥米司特(oglemi⁃last)和妥非司特(tofimilast)正进行研究,其临床Ⅱ期研究结果尚未更新。由GlaxoSmithKline公司研发的GSK-256066是最有效的PDE4抑制剂(IC50=0.015 nmol/L),对中度COPD患者的Ⅱ期临床试验耐受性良好,但其安全性和临床疗效有待进一步验证[35],另一个吸入型PDE4抑制剂CHF6001(IC50=0.04 nmol/L)的Ⅱ期临床研究发现其副作用小和治疗窗口大,有望进行进一步研究。新一代PDE4抑制剂通过PDE4酶的结构域设计而成的,目前正处于初步研究阶段。联合抑制PDE3和PDE4可能具有附加的抗炎和支气管扩张作用,近几年研究发现双靶点PDE3/4抑制剂对气道炎性疾病有益,RPL554是一种吸入型双靶点PDE3/4抑制剂,正在进行临床Ⅱ期试验,还有其他4种双重PDE3/4抑制剂,包括扎达维林(zardaverine),苯扎芬林(benzafentrine),普马芬群(pumafentrine),托拉芬群(tolafentrine)由于选择性较差,在临床实验出现各种副作用,比如DOA(dead on arrival),指到医院已死亡,停止对其进行一切医疗行为的病例,而终止临床研究。PED4抑制剂临床研究情况如表7。

3.2.5 腺苷受体调节剂 与正常人相比,COPD患者支气管肺泡细胞外腺苷水平升高,因此腺苷信号成为研究气道炎性疾病的一个重要靶点。腺苷受体(adenosine receptors,ARs)参与COPD的生理过程且在炎症细胞和基质细胞广泛表达。由Pfizer公司研发的A2AAR激动剂UK-432,097在Ⅱ期临床试验中评估了对COPD患者的安全性和有效性,现在其研究已终止,另一种A2AAR激动剂GW-328267X在Ⅰ期临床研究中评估了其安全性、耐受性、药代动力学和药效学,其疗效还有待进一步研究。目前,这类药物正处于研究的初步阶段,进入临床研究的药物还比较少。靶向ARs药物临床研究见表8。

表7 用于COPD的PDE4抑制剂临床研究

3.3 抗氧剂
ROS会破坏内源性蛋白酶/抗蛋白酶的平衡,加速肺损伤,针对抗氧化作用治疗COPD的药物有以下几类:黏痰溶解药、Nrf2激活剂、NOX抑制剂、MPO抑制剂、超氧化物歧化酶。N-乙酰半胱氨酸(N-acetylcysteine)、厄多司坦(erdosteine)和羧甲司坦(carbocisteine)等黏液溶解剂具有抗氧化和抗炎特性,在临床上用于减少COPD患者黏液,有利于气道引流通畅,改善通气。转录因子Nrf2可以调节多种抗氧化蛋白基因的表达,Nrf2激活剂Sulforaphane在临床治疗中被发掘,但Ⅱ期临床研究结果显示其既不影响Nrf2通路,也不影响抗氧化剂或炎症水平。NOXS是ROS的主要来源[36],目前研究发现的选择性NOX4抑制剂不多,已知的NOX2和NOX4双靶点抑制剂有VAS2870,具有抑制超氧阴离子产生(IC50=10.6µmol/L)和抑制氧化低密度脂蛋白诱导的人内皮细胞ROS形成的作用[37],另一种NOX4抑制剂GKT136901具有良好的体外药代动力学特性,有潜力成为新型抗氧化剂的先导化合物[38]。中性粒细胞和巨噬细胞通过释放MOP并催化其形成强氧化剂,从而放大氧化损伤和肺部组织炎症。有研究报道,2-硫黄嘌呤MPO抑制剂AZD5904可以减轻体内由MPO促进的氧化应激,由Pfizer公司研发的MPO抑制剂PF-06282999在Ⅰ期临床实验中评估了其在受试者的安全性、耐受性和药代动力学性质,这些药物目前还有待进一步的研究。超氧化物歧化酶(superoxide dismutase,SOD)是一种抗氧化剂,通过清除肺部和血液中的ROS来发挥治疗作用。抗氧剂临床研究情况见表9。

表8 用于COPD的靶向ARs的药物临床研究


表9 用于治疗COPD的抗氧化药物临床研究
4 总结与展望
目前用于COPD临床治疗的药物主要是支气管扩张剂和抗炎药物,尽管各大公司已经找到了许多性质优良的候选化合物,有些药代动力学性质良好、安全性高的药物已经进行了临床研究,但是真正批准上市的药物甚少,有的药物批准上市后由于其不良反应停止使用。COPD药物的研究更多地集中于开发新型吸入型药物,采用软性给药策略合理设计适合于吸入给药的小分子药物可以减少长期给药的不良反应,迄今为止,最有效的COPD药物是通过吸入进行治疗,发现优良的口服型药物治疗慢性阻塞性肺病仍然是一个挑战。总的来说,研发靶向COPD药物是一个非常具有挑战性和吸引力的研究领域。

