青稞多糖对糖尿病模型小鼠的降血糖作用及机制研究
王生亚 薛洁 徐乃玉 张真庆 吕栋

摘 要 目的:研究青稞多糖(HVP)對糖尿病模型小鼠的降血糖作用及机制。方法:对小鼠腹腔注射链脲佐菌素(120 mg/kg)以复制糖尿病模型。将造模成功的小鼠随机分为模型组、二甲双胍组(阳性对照,200 mg/kg)和HVP高、中、低剂量组(300、150、75 mg/kg),另设空白对照组,每组10只。各给药组灌胃相应药物,空白对照组和模型组小鼠灌胃等量水,每天1次,连续30 天。给药10、20、30 天时测定小鼠的空腹血糖(FBG);末次FBG测定后,小鼠腹腔注射10%葡萄糖溶液(2 g/kg),于注射后30、120 min时测定糖耐受量(GTT)曲线下面积;测定小鼠血清中胰岛素水平和肝组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)的含量;采用苏木精-伊红染色法观察小鼠胰腺组织病理学变化。结果:与空白对照组比较,模型组小鼠FBG、GTT曲线下面积和肝组织中MDA含量均显著升高或增加(P<0.01);血清中胰岛素水平和肝组织中SOD、GSH-Px含量均显著降低 (P<0.01);胰腺组织损伤严重,形态不完整,有明显的空泡。与模型组比较,HVP高剂量组小鼠FBG、GTT曲线下面积和肝组织中MDA含量均显著降低或减少(P<0.05或P<0.01),血清中胰岛素含量和肝组织中SOD、GSH-Px含量均显著升高 (P<0.05或P<0.01),HVP低、中剂量组上述指标部分改善,差异具有统计学意义(P<0.05或P<0.01);胰腺组织损伤有所减轻,形态较为完整,胰岛细胞排列紧密,空泡减少。结论:HVP可降低糖尿病模型小鼠的血糖水平,升高胰岛素水平并减轻胰腺组织损伤;该作用机制可能与其抗氧化作用有关。
关键词 青稞多糖;糖尿病;抗氧化;小鼠
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)07-0807-05
ABSTRACT OBJECTIVE: To study the hypoglycemic effect of Hordeum vulgare polysaccharide (HVP) on diabetes mellitus model mice and its mechanism. METHODS: The mice were given intraperitoneal injection of streptozotocin (120 mg/kg) to induce diabetes mellitus model. After modeling, the mice were randomly divided into model group, metformin group (positive control, 200 mg/kg), HVP high-dose, medium-dose and low-dose groups (300, 150 and 75 mg/kg), with 10 mice in each group. Blank control group was established additionally. Administration groups were given relevant medicine intragastrically; blank control group and model group were given constant volume of water intragastrically, once a day, for consecutive 30 days. The levels of fasting blood glucose (FBG) were determined after 10, 20, 30 days of administration. After last FBG test, mice were intraperitoneally injected with 10% glucose solution (2 g/kg), then the area under the glucose tolerance (GTT) curve was measured at 30 and 120 min after injection. The serum levels of insulin, the content of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), malondialdehyde (MDA) in liver tissue were detected. Pancreatic morphology of mice were detected by HE staining. RESULTS: Compared with blank control group, the FBG, area under GTT curve and MDA contnet in liver tissue were increased significantly in model group (P<0.01), while serum levels of insulin, SOD and GSH-Px contents in liver tissue were decreased significantly (P<0.01); the pancreatic tissue was seriously damaged with incomplete morphology and obvious vacuoles. Compared with model group, FBG, area under GTT curve, MDA content in liver tissue were decreased significantly in HVP high-dose group (P<0.05 or P<0.01), serum content of insulin, the content of SOD and GSH-Px in liver tissue were increased significantly (P<0.05 or P<0.01); above indexes of HVP low-dose and medium-dose groups were improved partially, with statistical significance (P<0.05 or P<0.01); the pancreatic tissue damage was alleviated, the morphology was relatively complete, the islet cells were closely arranged, and the vacuoles were reduced. CONLUSIONS: HVP can reduce the level of blood glucose in diabetic model mice, increase insulin level and relieve pancreatic injury. The mechanism may be related to its antioxidation.
KEYWORDS Hordeum vulgare polysaccharide; Diabetes mellitus; Antioixidation; Mice
糖尿病是由于体内胰岛素绝对缺乏或相对不足引起的慢性疾病,以血糖持续升高为特征,从而诱发各种器官、组织损害与功能障碍,严重威胁着人类健康[1-3]。2000年,全球成人糖尿病患者约1.51亿,到2019年已达4.63亿,预计2045年糖尿病患者总人数将超过6.29亿[4]。糖尿病正在逐渐成为全球健康的经济负担,同时糖尿病患者也逐渐呈现出一种年轻化的趋势[5]。
目前治疗糖尿病的药物多具有一些副作用,如体质量增加、低血糖、过敏反应、乳酸酸中毒、水肿等[6]。因此,开发天然的、副作用小的药物成为目前研究糖尿病治疗药物的重点。相关研究发现,植物多糖的降糖作用具有作用温和、毒副作用小、来源广泛等优点,极具开发潜质,如灵芝、紫苏叶、红豆杉、三七等多糖的降血糖作用均有报道[7-10]。
青稞是禾本科大麦属作物,主要分布于海拔4 200~ 4 500米的高寒地区,具有高蛋白、高纤维、高维生素、低脂肪、低糖等特点,并富含微量元素、β-葡聚糖等营养成分,研究表明青稞具有调节血糖、降低胆固醇、提高免疫力等功能[11-13]。体外研究显示,青稞多糖(HVP)具有抑制α-淀粉酶活性、降低淀粉消化率的作用[14];體内研究表明,HVP能降低由链脲佐菌素(STZ)诱导的糖尿病模型小鼠的空腹血糖(FBG)和糖耐受量(GTT)[15],但其体内降血糖的作用机制尚不明确。有研究指出,机体在持续高血糖状态下,活性氧簇(ROS)生成加速,可出现氧化应激和炎症反应[16]。基于此,本研究采用腹腔注射STZ复制小鼠糖尿病模型,并考察灌胃给予HVP后其降血糖的作用及机制,为其进一步研究和开发提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:5810型台式高速冷冻离心机(德国Eppendorf公司)、EL-204型万分之一电子分析天平(瑞士Mettler Toledo公司)、ELx-800型多功能酶标仪(美国BioTek公司)、HH型数显恒温水浴锅(江苏科析仪器有限公司)、CX21型生物显微镜(日本Olympus公司)、MR22i型低温高速离心机(法国Jouan公司)、S7/15型超纯水机(英国ELGA LabWater公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:STZ(美国Sigma公司,批号S0130),二甲双胍片(浙江亚太药业股份有限公司,批号1602086,规格250 mg/片),葡萄糖测定试剂盒(上海荣盛生物技术有限公司,批号20171027),小鼠胰岛素酶联免疫吸附法(ELISA)试剂盒(上海西唐生物科技有限公司,批号EL-M1382),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所,批号分别为20171019、20171020、20171129、20171020),耐高温淀粉酶(上海阿拉丁生化科技股份有限公司,批号a109182);其余试剂为实验室常用试剂或规格,水为超纯水。
1.3 动物
本研究所用动物为清洁级雄性昆明种小鼠,体质量(20±2) g,购自上海斯莱克实验动物有限公司,动物生产许可证为SCXK(沪)2017-0005。小鼠饲养于每日光照12 h、温度(21.5±1.5) ℃、相对湿度(47±5)%的动物房中。
2 方法
2.1 HVP制备
参考文献[17]方法制备HVP。称取青稞60 g,以80%乙醇溶液为提取剂,于75 ℃回流2 h,以4 500 r/min离心15 min,收集沉淀并将其置于50 ℃干燥箱中烘干。将烘干后的沉淀加入15倍量水(按mL/mg计),搅拌均匀后,以20%Na2CO3溶液调pH至10,并加入9.0 mL(约270 U)耐高温淀粉酶,于95 ℃回流2 h后,再以1 mol/L HCl 溶液调pH至3.0~4.5以沉淀蛋白;以4 500 r/min离心15 min分离蛋白,取上清液以20% Na2CO3溶液调pH至7.0,然后浓缩至60 mL;加入35%硫酸铵溶液,析出HVP粗品,再加水复溶,以去除小分子杂质;经透析、浓缩、冷冻干燥后即得精制的HVP干燥样品(得率为3.2%,纯度≥99.6%)。
2.2 分组、造模与给药
小鼠禁食12 h后,随机取10只作为空白对照,其余80只小鼠每天腹腔注射STZ(120 mg/kg)1次,连续注射3 天后,根据其血清中FBG测定结果,剔除不符合模型要求(FBG值小于11.1 mmol/L或大于25 mmol/L)的小鼠[18]。将符合模型要求的小鼠随机分为模型组、二甲双胍组(阳性对照,200 mg/kg,给药剂量参考文献[8])和HVP低、中、高剂量组(75、150、300 mg/kg,根据预实验结果设置),每组10只。模型组和空白对照组小鼠每天灌胃给予等量水,各给药组小鼠每天灌胃相应药物,每天1次,连续30 天。
2.3 小鼠FBG的测定
各组小鼠在给药前(0 天)和给药后10、20、30天时,于早上8点开始禁食4 h,然后分别从眼眶静脉丛取血。血样于 4 ℃条件下静置1 h后,以3 000 r/min离心10 min,分离血清。按照试剂盒说明书方法操作,检测小鼠血清中FBG水平。
2.4 小鼠GTT曲线下面积的测定
各组小鼠末次测定FBG后,腹腔注射10%葡萄糖溶液(2 g/kg),然后分别在腹腔注射后30 、120 min时按相应试剂盒说明书方法测定小鼠的血糖,然后参考文献[19]方法计算GTT曲线下面积。
2.5 小鼠血清中胰岛素水平测定
小鼠GTT曲线下面积测定结束后,禁食不禁水8 h,然后于其眼眶取血。血样在4 ℃条件下静置1 h后,以 3 000 r/min离心10 min,取上清液,按照相应试剂盒说明书相关方法操作,检测小鼠血清中胰岛素水平。
2.6 小鼠肝组织中GSH-Px、SOD、MDA含量测定
采血结束后,处死小鼠,分离肝脏,并用预冷的生理盐水反复冲洗肝表面残留血迹,滤纸吸干。称取适量肝组织,加入预冷的生理盐水,制备10%肝组织匀浆液,然后在4 ℃条件下以3 000 r/min离心10 min,取上清液,按照相应试剂盒说明书方法操作,检测小鼠肝组织中GSH-Px、SOD、MDA的含量。
2.7 小鼠胰腺组织病理形态学观察
取处死后各组小鼠的胰腺组织,以10%甲醛固定24 h后,以乙醇进行脱水,经常规石蜡包埋后制作切片(4 μm);切片经脱蜡水洗后,进行苏木精-伊红染色,于光学显微镜下观察胰腺组织的病理学变化。
2.8 统计学方法
采用SPSS 20.0软件进行统计分析,数据以x±s表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 HVP对糖尿病模型小鼠FBG的影响
与空白对照组比较,模型组小鼠给药0、10、20、30 天时,FBG均显著升高(P<0.01);与模型组比较,二甲双胍组和HVP高剂量组小鼠给药10、20、30 天后,FBG均显著降低(P<0.05或P<0.01),HVP低剂量组给药10天以及高剂量组给药10、30天后,FBG均显著降低(P<0.01),详见表1。
3.2 HVP对糖尿病模型小鼠GTT曲线下面积的影响
与空白对照组比较,模型组小鼠在腹腔注射葡萄糖后30、120 min时的血糖水平均显著升高(P<0.01),GTT曲线下面积均显著增加(P<0.01);与模型组比较,二甲双胍组和HVP中、高剂量组小鼠腹腔注射葡萄糖后30、120 min时的血糖水平均显著降低(P<0.01),GTT曲线下面积均显著减少(P<0.01),详见表2。
3.3 HVP对糖尿病模型小鼠血清中胰岛素水平的影响
与空白对照组比较,模型组小鼠血清中胰岛素水平显著降低(P<0.01);与模型组比较,HVP各剂量组小鼠血清中胰岛素水平均显著升高(P<0.05或P<0.01),详见表3。
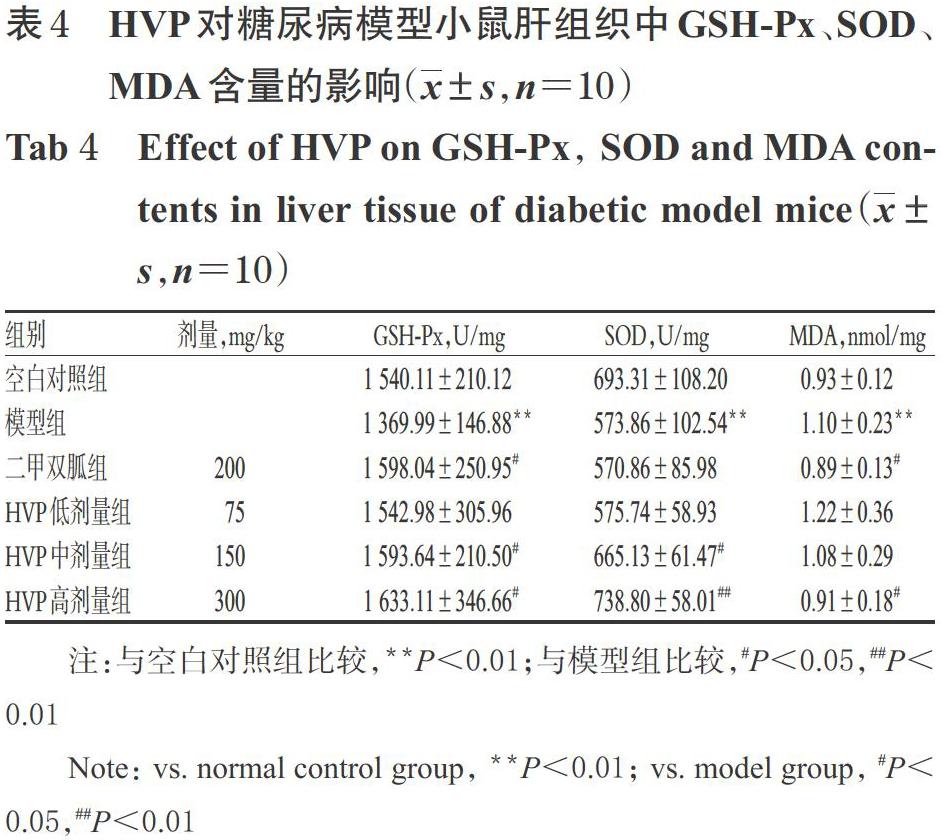
3.4 HVP对糖尿病模型小鼠肝组织中GSH-Px、SOD、MDA含量的影響
与空白对照组比较,模型组小鼠肝组织中GSH-Px、SOD含量显著降低(P<0.05),MDA含量显著升高(P<0.05);与模型组比较,二甲双胍组和HVP中、高剂量组小鼠肝组织中GSH-Px、SOD(二甲双胍组除外)含量均显著升高(P<0.05或P<0.01),HVP低剂量组MDA含量显著降低(P<0.05),详见表4。
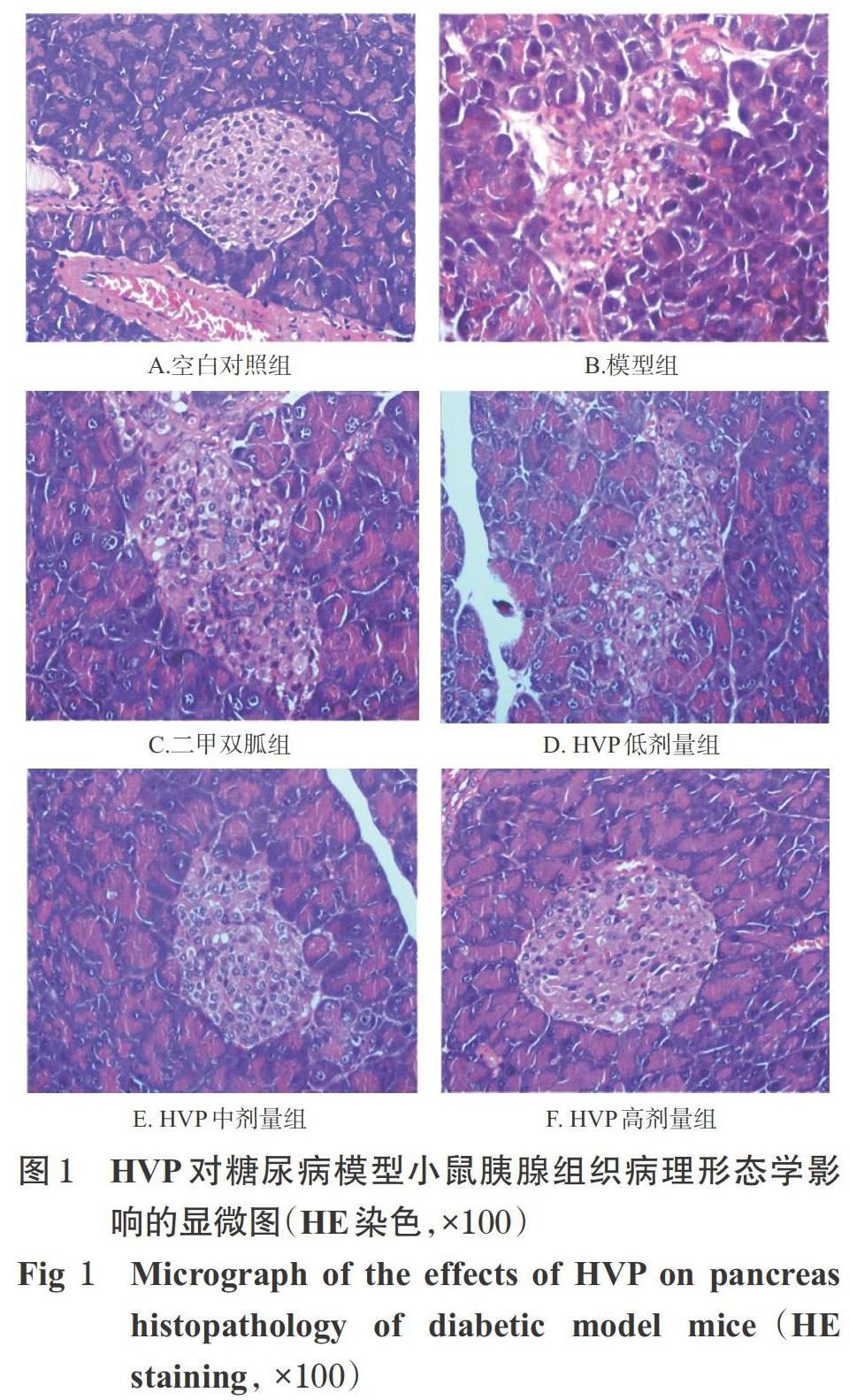
3.5 HVP对糖尿病模型小鼠胰腺组织形态学的影响
空白对照组小鼠胰腺组织结构完整且形态规则,胰岛细胞排列紧密且大小均匀,细胞质丰富无空泡化;模型组小鼠胰腺组织损伤严重、形态不完整,有明显空泡;二甲双胍组和HVP各剂量组小鼠胰腺组织形态较为完整,胰岛细胞排列紧密、损伤有所减轻,空泡减少,详见图1。
4 讨论
本研究采用腹腔注射STZ以复制小鼠糖尿病模型,用于考察HVP的降血糖作用,结果显示,糖尿病模型小鼠FBG和GTT曲线下面积显著升高或增加、血清胰岛素水平显著降低,且胰腺组织损伤严重、形态不完整、有明显空泡,说明本研究糖尿病模型复制成功。对糖尿病模型小鼠连续灌胃HVP 30 天后发现,小鼠FBG和GTT曲线下面积均不同程度地降低或减少,血清中胰岛素水平均显著升高,且胰腺组织损伤有所减轻、空泡减少、形态较为完整,表明HVP可降低糖尿病模型小鼠的血糖水平,并减轻胰腺组织损伤。
氧化应激是一种氧化与抗氧化平衡的紊乱所引起的活细胞功能失调状态[20]。SOD、GSH-Px、MDA是反映机体氧化应激水平的主要指标,其中SOD、GSH-Px为体内抗氧化防御系统的重要组成部分,MDA含量的高低可直接反映机体氧化应激水平的严重程度[21]。氧化应激在糖尿病早期和并发症进展中具有重要作用,与糖尿病的发生、发展密切相关[22]。在降低糖脂水平的前提下进行抗氧化治疗,能够更加有效地提高胰岛素的敏感性,改善葡萄糖耐受水平[23]。植物多糖通过降低氧化应激水平发挥降血糖作用已有研究证实,如铁皮石斛多糖能显著提高2型糖尿病小鼠的总抗氧化能力,修复其肝和胰腺组织的氧化损伤,从而提高胰岛素水平和缓解胰岛素抵抗,具有良好的降血糖作用[24];红豆杉多糖可升高糖尿病模型大鼠脾、胸腺组织中SOD、GSH-Px含量,降低MDA含量,从而发挥降血糖作用[9];鸡腿菇多糖对STZ诱导的糖尿病模型大鼠也具有较好的抗氧化活性,可升高大鼠体内的SOD含量、降低MDA含量,从而起到降血糖的作用[25]。本研究结果也发现,HVP可降低肝组织中MDA含量和升高SOD、GSH-Px含量,提示HVP可能通过抗氧化作用,改善糖尿病模型小鼠的氧化应激水平,进而发挥其抗糖尿病作用。
综上所述,HVP可降低STZ诱导的糖尿病模型小鼠的血糖水平,提高其胰岛素水平并改善胰腺组织损伤;该作用机制可能其抗氧化作用有关。
参考文献
[ 1 ] JIA G,AROOR A R,MARTINEZ-LEMUS L A. Invited review:over-nutrition,mTOR signaling and cardiovascular diseases[J]. Am J Physiol Regul Integr Comp Physiol,2014,307(11):F1198-F1206.
[ 2 ] XU Y J,TAPPI P S,NEKI N S,et al. Prevention of diabetes-induced cardiovascular complications upon treatment with antioxidants[J]. Heart Fail Rev,2014,19(1):113-121.
[ 3 ] 诸夔妞,肖洪贺,寿旗,等.绞股蓝及其活性成分改善糖尿病并发症作用机制的研究进展[J].中国药房,2020,31(8):1015-1020.
[ 4 ] SAEEDI P,PETERSOHN I,SALPEA P,et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the international diabetes federation diabetes atlas,9th edition[J]. Diabetes Res Clin Pract,2019,157:107843.
[ 5 ] Centers for Disease Control and Prevention. National diabetes statistics report:estimates of diabetes and its burden in the United States[EB/OL].[2020-11-11].http://www.cdc.gov/diabetes/pubs/statsreport14/national-diabetes-report-web.
[ 6 ] CHAO E C,HENRY R R. SGLT2 inhibition:a novel stra- tegy for diabetes treatment[J]. Nat Rev Drug Discov,2010,9(7):551-559.
[ 7 ] XIAO C,WU Q P,XIE Y Z,et al. Hypoglycemic mechanisms of Ganoderma lucidum polysaccharides F31 in db/db mice via RNA-seq and iTRAQ[J]. Food Funct,2018,9(12):6495-6507.
[ 8 ] 孙广平,袁丽,方晓琳,等.杨海波紫苏叶多糖对糖尿病模型小鼠胰腺组织氧化应激及PI3K/AKT/GLUT4信号通路的影响[J].中国药房,2020,31(15):1874-1879.
[ 9 ] 史岩,王宇峰,郭丽娇,等.红豆杉多糖对糖尿病大鼠的降血糖作用及机制研究[J].黑龙江医药科学,2020,43(1):184-187.
[10] 杨洁,马英慧,崔秀成,等.三七多糖对糖尿病模型大鼠的降血糖作用和眼视网膜病变的治疗作用及其机制[J].吉林大学学报(医学版),2017,43(4):734-738.
[11] 汪海波,刘大川,汪海婴,等.燕麦β-葡聚糖对糖尿病大鼠的血糖及糖代谢功能的影响研究[J].食品科学,2005,26(8):387-391.
[12] KUSMIATI,DHEWANTARA F X R. Cholesterol-lowering effect of beta glucan extracted from Saccharomyces cerevisiae in rats[J]. Sci Pharm,2016,84(1):153-165.
[13] 王波,张文会,李梁,等.超声波辅助青稞麦芽多糖提取工艺优化及抗氧化性研究[J].应用化工,2018,47(6):1137- 1139.
[14] 邓婧,马小涵,赵天天,等.青稞β-葡聚糖对淀粉体外消化性的影响[J].食品科学,2019,39(10):106-110.
[15] 胡辉,刘鹏,程佩佩,等.小分子青稞β-葡聚糖辅助降血糖功能研究[J].食品研究与开发,2018,39(21):33-37.
[16] GHOSH S,CHOWDHURY S,SARKAR P,et al. Ameliorative role of ferulic acid against diabetes associated oxidative stress induced spleen damage[J]. Food Chem Toxicol,2018,118:272-286.
[17] RONG Y X,XU N Y,XIE B Y,at el. Sequencing analysis of β-glucan from highland barley with high performance anion exchange chromatography coupled to quadrupole time-of-flight mass spectrometry[J]. Food Hydrocoll,2017,73:235-242.
[18] EBRAHIMIAN T G,TAMARAT R,CLERGUE M,et al. Dual effect of angiotensin-converting enzyme inhibition on angiogenesis in type 1 diabetic mice[J]. Arterioscler Thromb Vasc Biol,2005,25(1):65-70.
[19] 许光远,张晓明.降糖增效方对糖尿病大鼠肝脏胰岛素信号通路IRS1位点磷酸化的影响[J].湖南中医药大学学报,2020,40(2):139-143.
[20] 赵国莉,吕国锋,程千鹏.氧化应激与2型糖尿病相关性的观察[J].中国糖尿病杂志,2013,21(6):514-517.
[21] MONICZEWSKI A,GAWLIK M,SMAGA I,et al. Oxidative stress as an etiological factor and a potential treatment target of psychiatric disorders:part 1:chemical aspects and biological sources of oxidative stress in the brain[J]. Pharmacol Rep,2015,67(3):560-568.
[22] EDRIS A,OZAR T,MOHSENI S,et al. Effect of probio- tics supplementation on glucose and oxidative stress in type 2 diabetes mellitus:a meta-analysis of randomized trials[J]. DARU J Pharm Sci,2019,27(2):827-837.
[23] OGUNTIBEJU O O. Type 2 diabetes mellitus,oxidative stress and inflammation:examining the links[J]. Int J Physiol Pathophysiol Pharmacol,2019,11(3):45-63.
[24] 王云威,王景雪.铁皮石斛多糖对2型糖尿病小鼠降糖降脂的作用[J].食品科学,2020,41(21):127-132.
[25] 段懿涵,徐健,卢学春,等.鸡腿菇多糖对链脲佐菌素诱导糖尿病大鼠的降血糖作用[J].中国比较医学杂志,2019,29(12):76-81.
(收稿日期:2020-12-11 修回日期:2021-01-26)
(編辑:唐晓莲)

