禽白血病病毒抗原高敏荧光微球快速定量检测方法的建立
孙 雨,刘亚涛,王睿男,蒋 菲,马 英,李秀梅,王 文,原小燕,顾小雪,王传彬
(1.中国动物疫病预防控制中心,北京 102600;2.新疆维吾尔自治区动物疾病预防控制中心,新疆乌鲁木齐 830000;3.洛阳现代生物技术研究院有限公司,河南洛阳 471000)
禽白血病病毒又称禽C 型肿瘤病毒,属于反转录病毒科禽C 型反转录病毒属。禽白血病病毒和肉瘤病毒紧密相关,因此又称禽白血病/肉瘤病毒。自然情况下,该病毒可感染家养鸡、野鸡(珍珠鸡)、鹌鹑、鹧鸪等禽类。4~10 月龄母禽发病较多,性成熟或即将性成熟的禽群容易发病。该病呈世界性分布,在我国福建、广东、广西以及山东等地方品系鸡群中均有不同程度的发生[1]。不同品种的鸡对该病毒易感性差异较大,AA 鸡与艾维茵鸡的易感性明显高于新布罗鸡、罗斯鸡、京白鸡[2]。该病感染率高,容易引起病禽发育迟缓、免疫抑制、生产性能下降,引发多组织肿瘤甚至死亡,严重影响禽群生产能力,是危害养禽业的重要传染病[3]。禽白血病还可间接导致其他疫苗免疫失败,对肉鸡、蛋鸡和种鸡生产影响较大[4]。目前,对于禽白血病尚无有效的疫苗和防治药物。世界上一些养禽大国控制该病的主要策略是,对禽群实施禽白血病病原监测,净化种禽,通过逐步净化达到纯化种禽群目的[5]。
禽白血病病毒蛋白组分主要由gag基因编码的核心蛋白、pol基因编码的各种酶以及env基因编码的糖蛋白组成。其中gag基因主要编码非糖基化结构蛋白。这些非糖基化结构蛋白由基质蛋白、蛋白酶、衣壳和核衣壳4 种成分组成,分别称作p19、p15、p27 和p12 蛋白。p27 是病毒的衣壳蛋白,在蛋白总含量中占比高达30%,具有很多适合检测的抗原表位,因此很多方法都以检测p27 抗原来判定是否有禽白血病病毒感染[6]。目前国外用于检测禽白血病病毒p27 抗原的试剂盒,主要为美国IDEXX 公司生产的p27 抗原ELISA 检测试剂盒。国内应用较多的主要是扬州大学、中国动物疫病预防控制中心、北京世纪元亨公司联合研发的禽白血病双抗体夹心法p27 抗原ELISA 检测试剂盒、禽白血病双抗体夹心法p27 抗原胶体金检测试纸条。此外,中国农业科学院研制的禽白血病病毒p27 抗原检测试剂盒正在推广应用中[6-7]。
本研究利用已制备的2 株p27 蛋白单克隆抗体,建立双抗体夹心检测抗原的方法,以检测样品中禽白血病病毒。将p27 蛋白单克隆抗体包被于荧光层析试纸条,与样品中的待检抗原和另外一种经镧系元素荧光微球标记的p27 蛋白单克隆抗体,形成“固相单克隆抗体-抗原-荧光微球标记的单克隆抗体”免疫复合物。通过洗涤,除去未结合微球标记的单克隆抗体,然后读取荧光微球发光值,计算p27 抗原的计量值,从而定量检测家禽样本中禽白血病抗原含量,以此判定阴阳性结果。本试验由检测结果定量读取被检动物体内禽白血病病毒抗原含量,具有较高的实用和基层推广价值。
1 材料与方法
1.1 主要材料与仪器
BSA 与脱脂奶粉,购自美国Oxoid 公司;比对用禽白血病病毒抗原ELISA 检测试剂盒,购自美国IDEXX 公司(货号HR786,批号99-09254);禽白血病病毒p27 融合蛋白,由中国动物疫病预防控制中心(农业农村部兽医诊断中心)制备保存;镧系荧光微球、高敏荧光定量检测系统,均由洛阳现代生物技术研究院有限公司研发制备;禽白血病阴阳性临床样本、禽白血病病毒相关单克隆抗体、大肠杆菌菌体裂解液、H7N9 亚型流感病毒、H5 亚型禽流感病毒、新城疫CS2 病毒等交叉试验样品及禽白血病病毒p27、p12、p15、gp85重组表达蛋白,均由中国动物疫病预防控制中心(农业农村部兽医诊断中心)保存[8];胎牛血清、细胞培养基以及其他相关细胞培养试剂,购自美国Gibco 公司;健康BALB/c 小鼠,购自北京维通利华实验动物技术有限公司;高效连续点膜机,购自杭州峰航科技有限公司;便携式荧光免疫分析仪,购自洛阳现代生物技术有限公司。
1.2 p27 蛋白单克隆抗体细胞株的复苏与鉴定
1.2.1 杂交瘤细胞扩繁 参照本课题组已经发表的文献[9],从液氮中取出杂交瘤细胞株2E5 和3D5,置于37 ℃水浴锅中迅速解冻;用含有20%胎牛血清的RPMI-1640 培养液制成细胞悬液平铺于细胞培养瓶内,置于37 ℃、含5% CO2培养箱中培养36~72 h,进行分裂繁殖;稳定后待其长成细胞单层,取生长良好的单层细胞,胰酶消化后用适量含20%胎牛血清的RPMI-1640 培养液吹悬细胞,按照体积比1:3 接种到新细胞培养瓶中,补充细胞培养液至20 mL/瓶,置于培养箱中继续培养36~72 h。
1.2.2 腹水制备 将扩大培养的杂交瘤细胞以1 000 r/min 离心5 min,弃掉细胞培养上清;用RPMI-1640 培养基重悬,进行细胞计数,随后将细胞浓度稀释至15×106个/mL;取健康BALB/c 小鼠,将培养好的杂交瘤细胞注射至小鼠腹腔内,注射量为100 μL/只;观察10~15 d,待小鼠腹部明显肿大后,采集腹水。
1.2.3 腹水纯化 采用饱和硫酸铵沉淀方法对腹水进行纯化,将纯化后的p27 单克隆抗体无菌定量分装,-80 ℃保存备用。
1.2.4 Western Blot 检测纯化后单克隆抗体与p27蛋白反应特异性 对禽白血病病毒p27、p12、p15、gp85 融合蛋白进行SDS-PAGE 电泳,检测蛋白纯度,通过BCA 蛋白浓度测定法定量浓度;将蛋白转印至PVDF 膜,然后经5%脱脂牛奶封闭2 h,PBST 洗涤3 次,每次5 min;采用纯化后的2 株p27 单克隆抗体(稀释比例1:3 000)作为一抗孵育过夜,PBST 洗涤3 次,每次5 min;以HRP 标记的兔抗小鼠抗体作为二抗(稀释比例1:4 000)孵育1 h,PBST 洗涤3 次,每次5 min;利用HRPDAB 底物显色试剂盒显色,室温(15~25 ℃)作用5 min,以清水终止。
1.3 样本采集及处理
1.3.1 蛋清样品 取禽蛋破碎后的蛋清,于 -20 ℃与室温之间反复冻融,吸取蛋清进行检测。
1.3.2 泄殖腔拭子样品 用棉签取待检鸡只泄殖腔样本,置于1~2 mL 样品稀释液中。反复冻融后,恢复室温振荡混匀,12 000 r/min 离心,取上清液以待检测。
1.3.3 胎粪样品 用棉签取待测胎粪样本,置于1~2 mL 样品稀释液中,反复冻融后,恢复至室温振荡混匀,12 000 r/min 离心,取上清液以待检测。
1.4 荧光微球试纸条制备
1.4.1 荧光微球标记禽白血病病毒p27 蛋白单克隆抗体(1)洗涤:按需量取固体含量为1%的荧光微球分散液,加入5 倍体积的硼酸盐缓冲液(BBS,0.05 moL/L,pH8.0),以12 000 r/min 离心15 min,弃上清,重复清洗2 次;将洗涤后的荧光微球重悬于5 倍体积的BBS。(2)荧光微球活化:取50 μL 荧光微球加至1 mL 2-(N-吗啡啉)乙磺酸缓冲液(MES)中,混匀,12 000 r/min 离心15 min;弃上清,加入1 mL MES 缓冲液,混匀离心;重复上述步骤3 次,并用1 mL MES 缓冲液复溶;向上述溶液中加入250 μL 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺缓冲液(EDC),混匀,室温反应30 min;弃上清,加入4 mL 标记缓冲液,混匀。(3)荧光微球标记:将p27 蛋白单克隆抗体2E5 加至已活化的荧光微球中,使其终质量浓度为0.5 μg/mL,混匀;将混匀后含单克隆抗体2E5 的荧光微球溶液,置于室温条件下避光反应1.5 h;按溶液总体积3%加入封闭液(9%酪蛋白),置于室温条件下避光反应30 min;离心弃上清,用BBS 清洗2 次,并重悬已标记的荧光微球;以1%的体积量加入胭脂红色素,混匀,置于2~8 ℃保存备用。
1.4.2 荧光微球垫制备 从冰箱中取出荧光微球标记p27 蛋白单克隆抗体2E5 恢复至室温;取出玻璃纤维素膜并用辅料切条机裁切成10 cm×30 cm规格;设置喷涂量为3 μL/cm,每张玻璃纤维素膜(10 cm×30 cm)以1.0 cm 间隔喷涂8 条;将完成喷涂的玻璃纤维素膜放置于干净纱窗网,(37±2)℃干燥2~3 h,逐一垂直放入辅料斩切机中切成0.7 cm×30 cm 的荧光微球垫,置于装有干燥剂的密封袋中室温保存备用。
1.4.3 印膜制备(1)质控线(C 线)印膜溶液:用磷酸盐缓冲液(PB,0.05 mmoL/L,pH8.0)将禽白血病病毒p27 蛋白抗原稀释至0.40 mg/mL,即为C 线印膜溶液;将其置于棕色玻璃瓶中,2~8 ℃保存备用。(2)检测线(T 线)印膜溶液:用PB(0.05 mmoL/L,pH8.0)将p27 蛋白单克隆抗体3D5 稀释至0.45 mg/mL,即为T 线印膜溶液;置于棕色玻璃瓶中,2~8℃保存备用。(3)印膜:将印膜溶液分别吸至高效连续点膜机的C 线管线和T线管线中;按0.8 μL/cm 在硝酸纤维素膜(NC 膜)上均匀划出C 线和T 线,其中C 线距NC 膜顶端(0.8±0.1)cm 处,T 线距膜顶端(1.3±0.1)cm 处,C 线与T 线相距(0.5±0.1)cm;在膜的开始端、末端及不均匀处作标记。(4)印膜干燥:将划线的NC 膜逐一放置在干净纱窗网上,忌重叠,置于干燥间干燥,(37±2)℃干燥2 h;放入装有干燥剂的铝箔袋内,封口、贴上标签,室温保存备用。
1.4.4 样品垫制备 将玻璃纤维素膜用辅料斩切机裁切成2.0 cm×30 cm 规格,室温密封保存备用。
1.4.5 检测卡制备 在室温及湿度≤30%RH 的洁净环境下,按照以下步骤组装半成品试纸。(1)贴条:依次按印膜、吸水垫、荧光微球垫、样品垫的顺序,将各中间制品粘贴于PVC 底板上,保证各中间品在相邻处均有1 nm~2 mm 层叠,并使印膜上的T 线靠近样品垫一侧、C 线靠近吸水垫一侧。(2)切条:将已组装好的荧光微球大板修剪整齐后,用切条机裁切为(4.0±0.1)mm 的试纸。(3)装卡:挑取印膜无划痕、无污染、边缘整齐的试纸,将试纸放入底卡中,盖上卡盖。
1.4.6 操作步骤(1)仪器准备:打开便携式荧光免疫分析仪,选择待检项目,结果如需打印,同时打开蓝牙打印机,并与便携式荧光免疫分析仪连接。(2)样品稀释:用微量毛细采样管取10 μL样本加至已备好的样本稀释液管中混匀,稀释后的样品需在1 h 内完成检测。(3)取检测卡:将恢复至室温的试纸卡从铝箔包装中取出,放于平整、洁净的台面上。(4)加样及孵育:用配套吸管吸取已稀释好的样本,垂直而缓慢地滴加2~3 滴(约80 μL)至加样孔,室温放置10~15 min。(5)仪器检测读数:读数前先将产品配套ID 卡插入便携式荧光免疫分析仪,再将检测卡加样口朝里放入便携式荧光免疫分析仪检测,5 min 内完成读值。
1.4.7 试验成立标准 阴性:用标准阴性样本检测,T/C<0.1 时,试验成立。阳性:用禽白血病病毒p27 蛋白抗原检测,T/C≥0.1 时,试验成立。
1.4.8 结果判定标准 当T/C<0.1 时,判为禽白血病病毒抗原阴性;当T/C≥0.1 时,判为禽白血病病毒抗原阳性。
1.5 质控样品检验
采用高敏荧光微球快速检测方法以及IDEXX试剂盒,分别对30 份质控样品(10 份禽白血病病毒强阳性样品、10 份弱阳性样品、10 份阴性样品)开展3 次重复检测,比较2 种检测方法对阴性样品的检出率。
1.6 交叉试验
对于经鉴定均为禽白血病病毒阴性的大肠杆菌菌体裂解液、H7N9 亚型流感病毒、H5 亚型禽流感病毒、新城疫CS2 病毒等4 份样品,采用建立的高敏荧光微球快速检测方法重复检测3 次,同时用IDEXX 试剂盒开展平行检测。
1.7 最低检出量试验
将禽白血病病毒在DF-1 细胞传代扩繁,收获细胞上清培养液作为阳性标准品。采用Reed-Muench 方法测算毒株在DF-1 细胞的TCID50并进行定量。将阳性标准品用稀释液分别按1.000×103、2.000×103、4.000×103、8.000×103、1.600×104、3.200×104、6.400×104、1.280×105、2.560×105、5.120×105、1.024×106、2.048×106、4.096×106和8.192×106作梯度稀释,制备敏感性检验样品,采用建立的高敏荧光微球快速检测方法和IDEXX 试剂盒开展检测,测定最低检出量。
1.8 重复性试验
采用建立的高敏荧光微球快速检测方法,对12 份经鉴定的阳性样品在同批次板和不同批次板上分别进行检测,平行测定5 次,计算批内、批间变异系数(CV)。
1.9 符合性试验
采用建立的高敏荧光微球快速检测方法与IDEXX 禽白血病抗原ELISA 检测试剂盒,检测送检的240 份样品(其中阳性样本120 份、阴性样本120 份),计算符合率。
2 结果
2.1 p27 蛋白单克隆抗体复苏鉴定及特异性反应检测
p27 蛋 白 单 克 隆 抗 体2E5 和3D5 的SDSPAGE 电泳结果(图1)显示,成功复苏禽白血病病毒p27 蛋白单克隆抗体,抗体重链与轻链大小分别为55、27 ku。经蛋白灰度分析软件分析,纯化后的单克隆抗体纯度在90%以上,满足后续试验需求。使用Western Blot 检测单克隆抗体与p27、p12、p15、gp85 等蛋白的反应特异性,结果发现纯化后的单克隆抗体只与p27 蛋白发生特异性反应,与其他蛋白无交叉反应(图2)。
2.2 高敏荧光快速定量检测方法建立与优化
高敏荧光快速定量检测方法建立后,对反应条件进行优化。结果显示,当3D5 单抗包被质量浓度为0.45 mg/mL,镧系荧光微球标记2E5 单抗质量浓度为0.5 μg/mL,样本稀释比例为1:80 时,禽白血病病毒阳性与阴性样本的P/N值最大。同时,取稀释后的样本80 μL 加入试剂卡加样孔内,避免强光照射层析15 min,然后将检测卡放入荧光仪检测,读取试剂盒效价值为最佳。
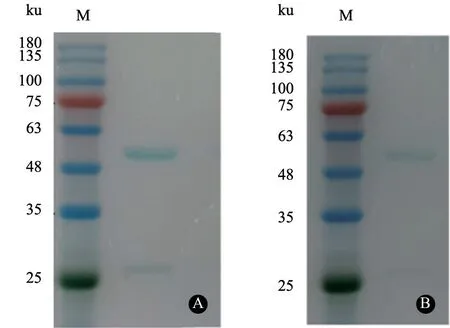
图1 禽白血病病毒p27 蛋白单克隆抗体复苏与鉴定结果
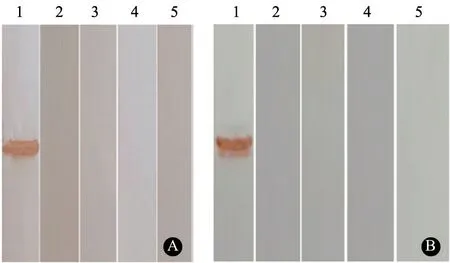
图2 p27 蛋白单克隆抗体反应特异性验证结果
2.3 阴阳性临界值确定
采用建立的高敏荧光快速定量检测方法对120份阴性样本进行检测,测定T/C值。120 份阴性样本T/C值X为0.095,3SD 为0.05,因此阴阳性临界T/C值X+3SD 为0.1。将此临界T/C值(0.1)对应为检测临界值,即当试剂盒检测值≥0.1 时,判定样品为阳性;检测值<0.1 时,判定样品为阴性。
2.4 质控样品检测试验
采用建立的高敏荧光微球快速检测方法和IDEXX 试剂盒,分别对30 份质控样品开展3 次重复检测,比较2 种检测方法对阴性样品的检出率。结果显示,高敏荧光微球快速检测方法以及IDEXX 试剂盒对质控阴性样品的检出率均为100%。
2.5 交叉试验
对鉴定为禽白血病病毒p27 蛋白阴性的大肠杆菌菌体裂解液等4 份样品,采用高敏荧光微球快速检测方法开展3 次重复检测,同时以IDEXX 试剂盒进行平行实验,比较2 种检测方法的交叉反应。结果(表1)显示,检测结果全部为阴性,无交叉反应。
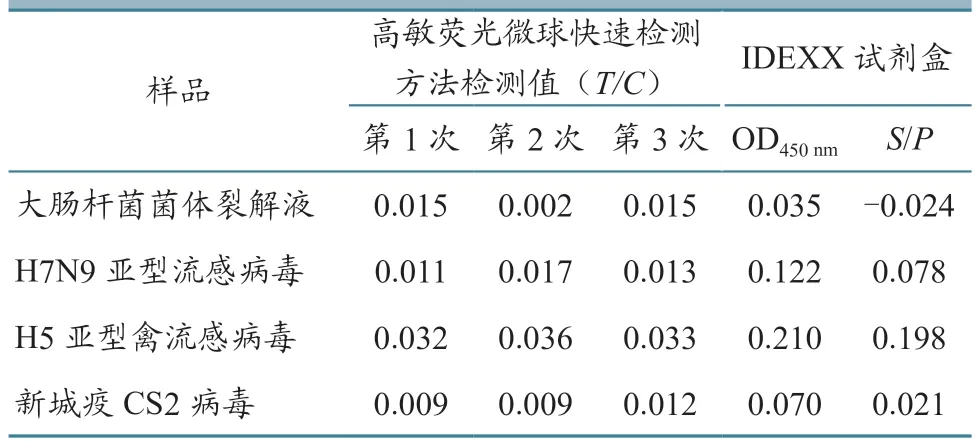
表1 高敏荧光微球快速检测方法交叉试验结果
2.6 最低检出量
将阳性标准品用稀释液分别按照1.000×103、2.000×103等14 个梯度稀释倍数进行稀释,制备敏感性检验样品,然后采用高敏荧光微球快速检测方法和IDEXX 试剂盒进行检测。结果(表2)显示,高敏荧光微球快速检测方法最低检出量为1:(5.120×105),且T/C值在批间、批内变化相对稳定,较IDEXX 试剂盒最低检出量[1:(2.560×105)]高,说明该检测方法的敏感度高。
2.7 重复性试验
采用建立的高敏荧光微球快速检测方法,对10 份样品在同批次板和不同批次板上分别进行检测,平行测定5 次,计算批内、批间发光值的变异系数(CV)。结果(表3)显示,本试验建立的高敏荧光微球快速检测方法批内发光值重复系数均小于10%,批间发光值重复系数均小于15%,说明该方法具有良好的重复性。

表2 高敏荧光微球快速检测方法最低检出量试验结果
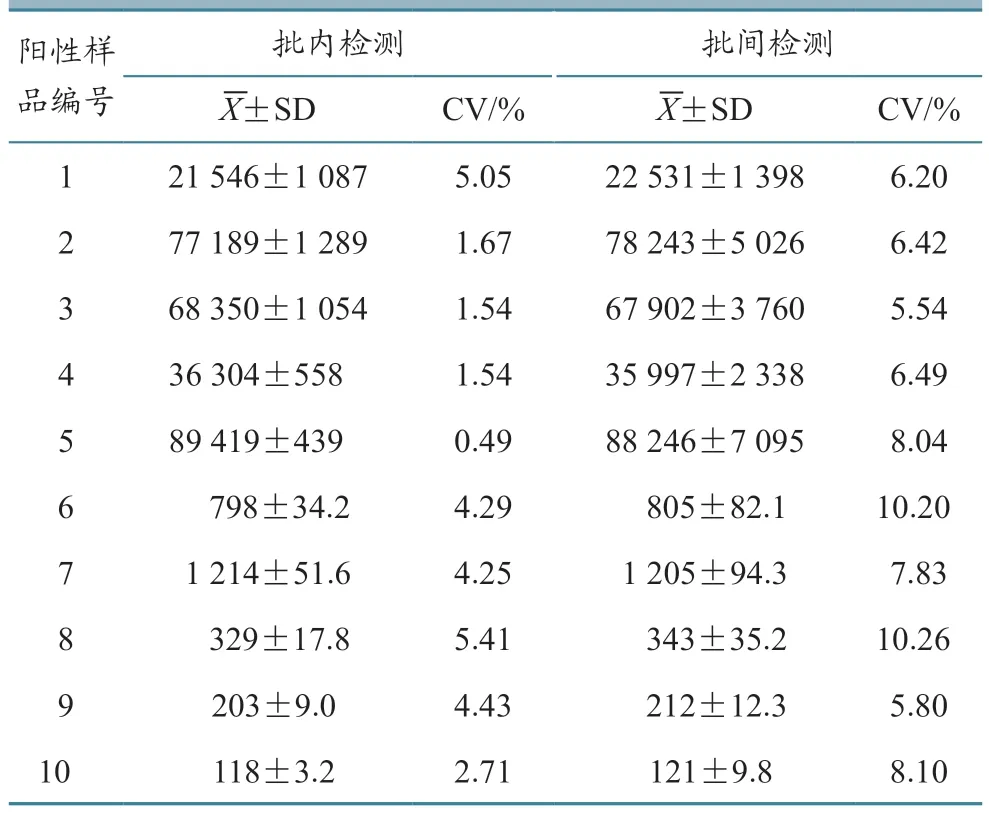
表3 高敏荧光微球快速检测方法的发光值重复性试验结果
2.8 符合性试验
使用建立的禽白血病抗体高敏荧光微球快速检测方法与IDEXX 检测试剂盒,对抽取的240 份样品(阴、阳性样品各120 份)进行检测比对。结果(表4)显示,两种方法的总符合率为93.98%,阳性符合率为90.83%,阴性符合率为95.83%。
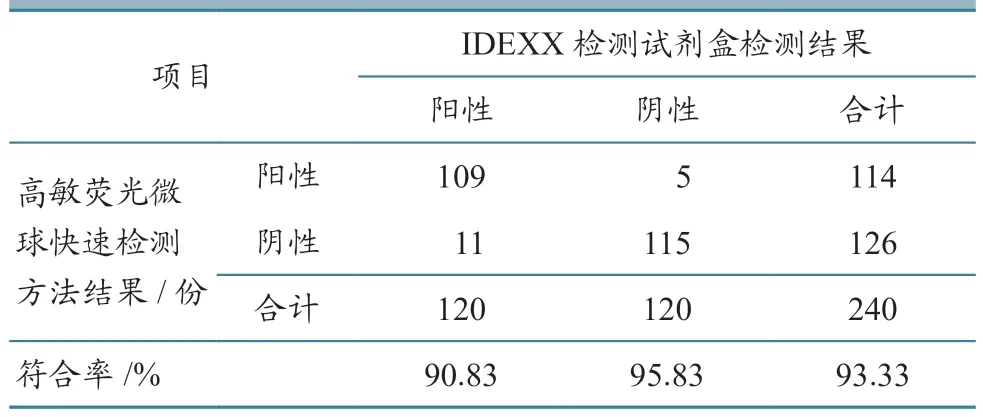
表4 符合率统计结果
3 讨论
自20 世纪70 年代以来,欧洲国家相继报道使用ELISA 方法检测禽白血病[10-11]。1985 年,美国报道禽白血病病毒ELISA 抗原检测试剂盒研发成功,并得到推广应用[12]。与此同时,我国也开始对禽白血病病原诊断技术进行研究。目前,国内外对禽白血病病毒检测技术研发主要集中于ELISA抗原检测。我国现有禽白血病抗原检测标准为国标《禽白血病诊断技术》(GB/T 26436—2010),主要涉及病原的分离鉴定、病毒核酸的分子生物学检测以及病毒抗原ELISA 检测方法等[7,12]。基层实际临床诊断中,常根据血液学检查和病理学特征以及结合病原和抗体检查来确诊该病。成红细胞性白血病在外周血液、肝及骨髓涂片,可见大量的成红细胞,肝和骨髓呈樱桃红色。成髓细胞性白血病在血管内外均有成髓细胞积聚,肝呈淡红色,骨髓呈白色。ELISA 检测方法的稳定性与特异性具有一定局限性。病原分离和抗体检测是目前建立无白血病鸡群的重要手段。近年来,开发灵敏度更高、检测操作更简单的新型禽白血病抗原诊断技术成为研究热点。高敏快速荧光定量检测方法是近几年发展成熟的一种高敏感性和特异性的新检测方法。该方法利用镧系荧光微球作为包被介质,充分利用镧系元素激发光谱宽、发射光谱窄、Stokes 位移大等特点,实现快速、敏感检测。1979 年,芬兰Wallac公司研发部的Soini 和 Hemmila 首次提出建立稀土离子标记物的“时间分辨荧光免疫分析”理论,为高敏快速荧光定量检测方法奠定了理论基础[13-14]。1984 年,Hemmila 确 定 了DELFIA(dissociation enhanced lanthanide fluoroimmunoassay)时 间 分辨免疫分析技术方案,从而使DELFIA 成为芬兰Wallac 公司的专利技术[15-16]。2003 年,时间分辨荧光分析技术获我国国家科技进步二等奖。2014年万孚生物研制心肌肌钙蛋白I(cTnI)荧光微球试剂,在人医领域获得注册证书[粤食药监械(准)字2014 第2400511 号][16]。
高敏快速荧光定量检测方法相比较于ELISA检测方法更敏感、特异,检测本底值更低、信噪比更高、操作更简便,适用于大量样品快速检测,更适合基层应用。与胶体金试纸条检测方法相比,同样作为适用于基层使用的快速诊断检测技术,2 种方法具有相似之处,都需要层析试纸作为检测媒介,但是高敏快速荧光定量检测方法具有检测灵敏度更高、仪器判读结果更准确等优势。具体来说,在标记物方面,胶体金试纸条检测方法的标记物为胶体金,高敏快速荧光定量检测方法的标记物为荧光微球;在检测方法方面,胶体金试纸条使用目测方法判读结果,高敏快速荧光定量检测方法使用便携式荧光检测仪判读检测结果;在结果的准确性方面,高敏快速荧光定量检测方法使用仪器判读降低肉眼判读误差,且操作无需专业人员,结果相对准确,检测时间短。因此,高敏快速荧光定量检测方法相比较于胶体金试纸条检测方法具有很多明显的实验室与基层使用优势。利用镧系荧光微球开发准确、敏感、简易、快速的禽白血病新型诊断技术,可更好地满足禽白血病防控需求[9-11]。本试验建立的检测方法可使禽白血病病毒抗原检测更快速,结果更量化、准确,从而提高该病检验检疫水平,加大防疫力度,具有重要的经济与政治意义。
本检测试纸采用时间分辨荧光免疫层析试验原理制成,样本加入到加样孔后与荧光微球标记物一起沿层析膜移动,若样本中存在禽白血病病毒抗原,则与荧光微球标记物及检测线上的抗体结合而产生荧光信号;若样本中不存在抗原,则不产生荧光信号。本研究使用禽白血病病毒p27 蛋白单克隆抗体,建立了双抗体夹心检测抗原的高敏荧光微球快速检测方法。本方法敏感性高、特异性强,操作简单、快速,适用于基层各级兽医部门和出入境检验检疫局对禽白血病病毒抗原的快速定量检测,为禽白血病防控和净化提供了重要技术手段。

