南果梨果胶酶活力的研究
黄 浩,翁 霞
(1.北京联创种业有限公司 北方事业部,北京 100020;2.鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007)
南果梨是秋子梨(PyrusussrieysissaXIX)系统中的优良品种之一,为辽宁鞍山特产.该品种果实色泽鲜艳,以果肉细腻、爽口多汁、风味香浓而驰名于国内外[1].南果梨随衰老的加剧开始褐变,最后腐烂,且腐烂主要由多酚氧化酶和果胶酶的共同作用引起.果胶酶的生理生化作用是研究植物生理机制的重要线索之一,果胶质降解将导致细胞分离.目前,国内外对果胶酶的研究,主要集中在食品加工业中提高果蔬出汁率和果汁澄清方面,对果胶酶酶学性质研究较少,对南果梨果胶酶的相关研究还未见报道.因此,对南果梨果胶酶活力测定的研究,不仅为南果梨的深加工及贮藏提供理论依据,也为南果梨果胶酶的分离纯化奠定基础.
1 材料与方法
1.1 材料与设备
南果梨:市售,购于鞍山四方台南果梨批发市场.
3,5-二硝基水杨酸、酒石酸钾钠、考马斯亮蓝G-250,国药集团化学试剂有限公司;氢氧化钠、无水亚硫酸钠、葡萄糖,天津光复科技发展有限公司;柠檬酸、95%乙醇,天津市瑞金特化学品有限公司;牛血清蛋白,北京奥博星生物技术有限公司;苯酚,天津化学试剂有限公司;磷酸氢二钠,天津市科密欧化学试剂有限公司;85%磷酸,天津市红岩化学试剂厂;盐酸,沈阳化学试剂厂.除牛血清蛋白为生物纯外,其他试剂均为分析纯.
PB-10 Sartorius(赛多利斯) pH计,桂宁(上海)实验器材有限公司;FA1104电子天平,上海良平仪器仪表有限公司;80-2B离心机,上海安亭科学仪器厂;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;SYZ-550型石英亚沸高纯水蒸馏器,江苏金坛市恒丰仪器厂;DK-98-Ⅱ电热恒温水浴锅,天津市泰斯特仪器有限公司.
1.2 实验方法
1.2.1 果胶酶的提取 称取4 ℃下贮藏的南果梨10 g,放入已预冷的研钵中,按1∶3质量体积比加入预冷(4 ℃)的pH值5.0的磷酸氢二钠-柠檬酸缓冲液[2],4 ℃下浸提2 h,滤液于4 000 r/min下离心15 min,上清液即为果胶酶粗酶液[3].
1.2.2 酶活力的测定
(1)测定原理:基于3,5-二硝基水杨酸(DNS)与醛糖共热能产生棕红色的氨基化合物,在一定范围内还原糖的量与含有呈色氨酸化合物的反应液颜色深浅成正比[4],在520 nm下测其吸光度,从而可计算出果胶酶活力.
(2)主要试剂的配制:
①DNS-试剂:用400 mL蒸馏水溶解3.15 g DNS,再加入200 mL 0.5 mol/L NaOH,再依次加入91 g 酒石酸钾钠·4H2O、2.5 g 苯酚、2.5 g无水亚硫酸钠,微加热(不超过20 ℃),不断搅拌,直至溶液清澈透明.用蒸馏水定容至1 000 mL,保存在棕色瓶中,与二氧化碳隔绝,贮存期为6 个月.
②pH值5.0磷酸-柠檬酸缓冲溶液:精确称取71.64 g磷酸氢二钠、21.011 g柠檬酸,分别定容到1 000 mL,按10.3∶9.7混合,即可.
③糖标准液:精确称取0.1 g葡萄糖,用蒸馏水定容至100 mL,获得1 mg/mL的葡萄糖溶液.
④蛋白质标准溶液的配制:精确称取牛血清蛋白25 mg,加水溶解并定容至100 mL,吸取上述溶液40 mL,用蒸馏水稀释至100 mL,即为100 μg/mL 的标准蛋白质溶液.
⑤考马斯亮蓝G-250蛋白试剂的配制:精确称取100 mg考马斯亮蓝G-250,溶于50 mL 95%的乙醇中,加入100 mL 85%的磷酸,最后用蒸馏水定容到1 000 mL,即为0.01%(W/V)考马斯亮蓝G-250溶液.
(3)果胶酶最大吸收波长的确定:取一支试管依次加入0.5 mL葡萄糖标准液、2.0 mL蒸馏水、0.5 mL果胶酶样液,放入50 ℃恒温水浴中反应50 min后,再加入2.5 mL DNS,沸水浴5 min后定容至10 mL,以标准空白调零,在400~600 nm的波长范围内扫描得最大吸收波长为520 nm,见图1.
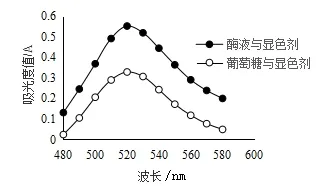
图1 果胶酶最大吸收波长
(4)标准曲线制作:取6支具塞刻度试管,分别向试管中加入1 mg/mL葡萄糖标准液0,0.2,0.4,0.6,0.8,1.0 mL,蒸馏水3.0,2.8,2.6,2.4,2.2,2.0 mL,再在每支试管中分别加入2.5 mL DNS[5],将各管摇匀,在沸水浴中加热5 min,取出后立即用流水冷却,以蒸馏水定容至10 mL,混匀,以蒸馏水为空白对照,在520 nm波长测吸光度,以葡萄糖的量为横坐标、吸光度值为纵坐标绘制标准曲线.葡萄糖的标准曲线线性回归方程是y=0.577 3x+0.000 9,相关系数r=0.998 7,葡萄糖线性范围是0~1.0 mg/mL.
(5)酶活力测定步骤:
酶活单位:1 mL酶液在50 ℃、pH值5.0的条件下,1 h分解葡萄糖产生1 mg半乳糖醛酸为一个酶活单位(U)[6].
取两只10 mL具塞刻度试管甲、乙,分别加入2 mL蒸馏水和0.5 mL的1 mg/mL葡萄糖;甲试管中加入0.5 mL酶提取液,乙试管加入0.5 mL蒸馏水,水浴加热50 min后,再在甲、乙两试管中分别加入2.5 mL的3,5-二硝基水杨酸试剂,沸水浴5 min后冷却定容至10 mL.在520 nm处按照与标准曲线相同的方法比色,得到相应的吸光度值.则果胶酶酶活力计算公式为:
式中:U为酶活性,U/mg;m′为从标准曲线中查得的葡萄糖质量,mg;v′为样品提取液的总体积,mL;m为样品质量,g;v为测定时所取样品提取液体积,mL;t为酶促反应时间,h;1.08是葡萄糖换算成半乳糖醛酸的系数(194/180).
(6)酶比活力的测定:比活力为酶活性与标准曲线中查得的果胶酶蛋白质量的比值,单位为U/mg.
(7)蛋白质最大吸收波长的确定:取1 mL果胶酶提取液,在其中加入5 mL考马斯亮蓝溶液,以蒸馏水做空白对照,在400~800 nm的波长范围内扫描得最大吸收波长为600 nm.
(8)蛋白质标准曲线的制作:取6支10 mL的具塞试管,分别向各试管中加入1 mg/mL牛血清蛋白溶液0,0.2,0.4,0.6,0.8,1.0 mL,蒸馏水1.0,0.8,0.6,0.4,0.2,0 mL,再在每支试管中加入5 mL考马斯亮蓝G-250反应液,将试管中溶液振荡摇匀,放置2 min后,用TU-1810型紫外可见分光光度计、1 cm内径的玻璃比色皿在600 nm处测吸光度值,以蒸馏水为空白对照,吸光度为横坐标,蛋白质含量为纵坐标,绘制标准曲线.牛血清蛋白的标准曲线线性回归方程是y=0.002 1x+0.000 1,相关系数r=0.997 0,蛋白质的线性范围是0~1.0 mg/mL.
1.3 影响果胶酶活力的单因素实验
1.3.1 底物用量对果胶酶活力的影响 向试管中分别加入0.3,0.5,0.7,0.9,1.1 mg的1 mg/mL葡萄糖标准液、2 mL蒸馏水和0.5 mL果胶酶提取液,以蒸馏水做空白对照,在520 nm测定吸光度值,确定最适的底物用量.
1.3.2 酶浓度对酶活力的影响 向试管中分别加入0.5 mL的葡萄糖标准液和2 mL蒸馏水后,再分别加入10%,30%,50%,70%,90%的果胶酶提取液,以蒸馏水做空白对照,在520 nm测定吸光度值,确定最适的果胶酶浓度.
1.3.3 pH值对果胶酶活力的影响 向试管中分别加入0.5 mL的葡萄糖标准液、2 mL蒸馏水和0.5 mL30%果胶酶提取液后,用缓冲液调反应液的pH值为4,5,6,7,8,以蒸馏水做空白对照,在520 nm测定吸光度值,确定最适的pH值.
1.3.4 温度对果胶酶活力的影响 向试管中分别加入0.5 mL的葡萄糖标准液、2 mL蒸馏水和0.5 mL30%果胶酶提取液后,以蒸馏水做空白对照,分别在30,40,50,60,70,80 ℃反应后,在520 nm测定吸光度值,确定最适的反应温度.
1.3.5 反应时间对果胶酶活力的影响 向试管中分别加入0.5 mL的葡萄糖标准液、2 mL蒸馏水和0.5 mL30%果胶酶提取液,以蒸馏水做空白对照,分别反应30,40,50,60,70 min,在520 nm测定吸光度值,确定最适的反应时间.
1.4 影响果胶酶活力的正交实验
为了优化南果梨中果胶酶性质的最佳条件,根据单因素实验进行五因素二水平的正交试验,以确定最佳条件.
2 结果与分析
2.1 南果梨果胶酶活力的单因素实验
由图2(A)可知,随着底物的量的增大,果胶酶的比活力先增大后减小,在底物的量为0.5 mg时,果胶酶比活力最大,所以,确定最佳底物的量为0.5 mg.
由图2(B)可知,随着果胶酶浓度的增大,果胶酶的比活力先增大后减小,在果胶酶浓度为40%时,果胶酶比活力最大,但是30%和40%酶浓度时,果胶酶的比活力相差不到1%,考虑到经济成本的问题,确定最佳酶浓度为30%.
由图2(C)可知,随着pH值的增大,果胶酶的比活力先增大后减小,在pH值为6时,果胶酶比活力最大,确定最佳pH值为6.
由图2(D)可知,随着反应温度的增加,果胶酶的比活力先增大后减小,在反应温度为60 ℃时,果胶酶比活力最大,确定最佳反应温度为60 ℃.
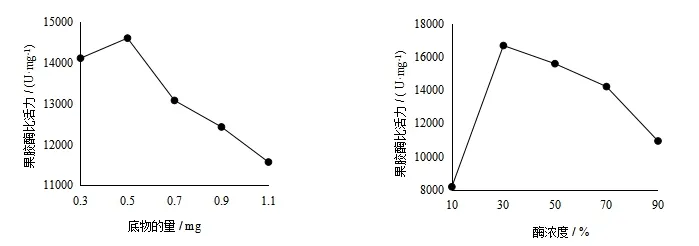
图2 (A) 底物的量对果胶酶活力的影响 图2 (B) 酶浓度对果胶酶活力的影响
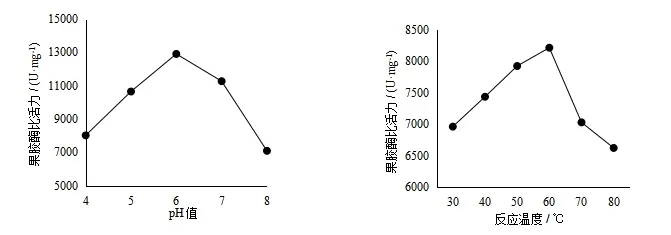
图2 (C) pH值对果胶酶活力的影响 图2 (D) 反应温度对果胶酶活力的影响
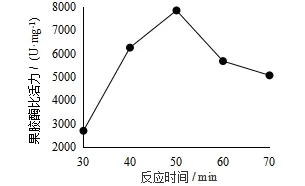
图2 (E) 反应时间对果胶酶活力的影响
由图2(E)可知,随着反应时间的增长,果胶酶的比活力先增大后减小,在反应时间为50 min时,酶比活力最大,确定最佳反应时间为50 min.
2.2 南果梨果胶酶活力的正交试验
以南果梨果胶酶比活力为测定指标,在上述单因素试验范围内设计正交试验,试验因素水平设计、试验结果见表1、表2.

表1 因素水平表
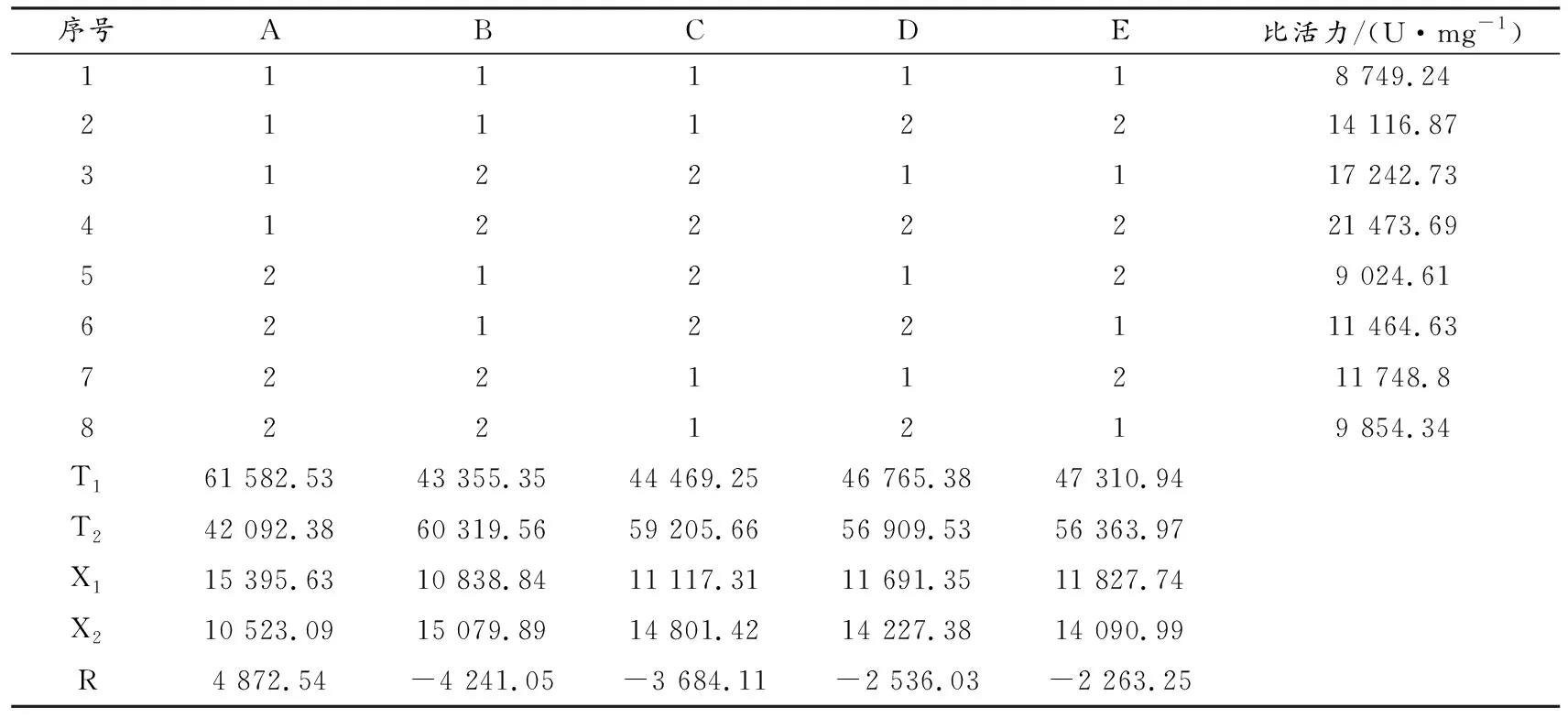
表2 正交试验结果表
由表2可以看出,酶浓度极差最大,其次分别为pH值、反应时间、底物的量、反应温度.各因素影响果胶酶活力的主次顺序为A>B>C>D>E,因此果胶酶活力最佳测定组合为A1B2C2D2E2,即在选定酶浓度为30%、pH值为6、反应时间为50 min、底物的量为0.5 mg、反应温度为60 ℃的条件下,果胶酶活力能达到最大值.
由表3可看出,A、B因素影响极显著,C因素影响显著,D、E因素无显著性差异.所以酶的浓度和pH值是影响南果梨中果胶酶活力的主要因素,反应时间次之,底物的量和反应温度影响不大.
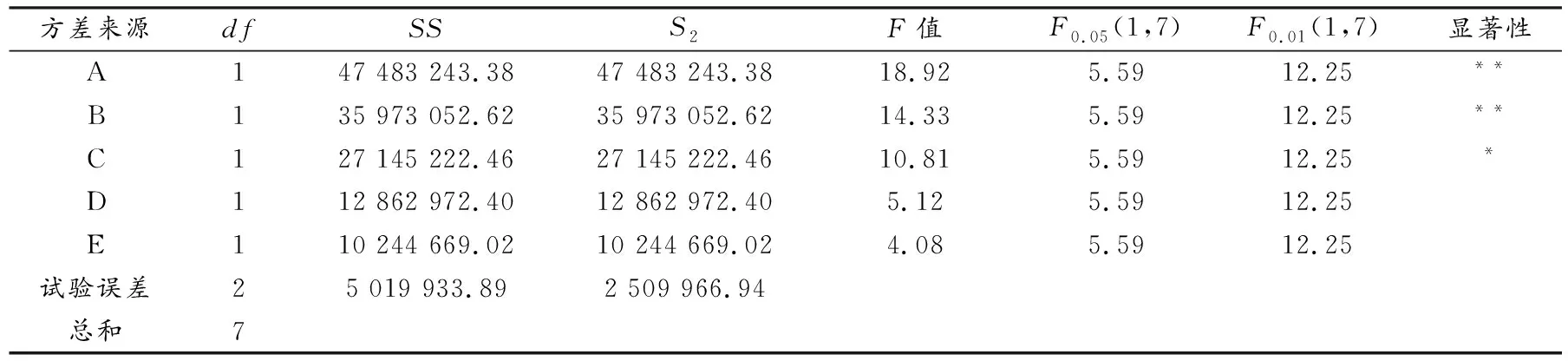
表3 方差分析表
3 结论
南果梨果胶酶酶学性质研究表明:酶浓度为30%、pH值为6、反应时间为50 min、底物的量为0.5 mg、反应温度为60 ℃的条件下,果胶酶比活力高达21 473.69 U/mg,且酶浓度、pH值影响极显著,反应时间影响显著,底物的量与反应温度影响不显著.

