2种进口糖化清蛋白试剂的检测性能评价*
董 磊,马红雨,全首祯,梁 佩,巩 蓓,张 谨,马越云,李偌铱
空军特色医学中心临床检验科,北京 100142
糖化清蛋白是血液中清蛋白与葡萄糖通过非酶促糖基化反应形成的产物,可反映患者检测前2~3周的平均血糖水平,我国实验室通常采用的正常参考值范围为11%~17%[1-2]。
最早的糖化清蛋白测定为日本学者研发的高压液相离子交换法(HPLC法),但该方法处理样本量小,费用高昂,不适宜临床常规开展。2002年美国研制出固体酶法,特异度较高,但对于输注高能量氨基酸的患者,测定结果会异常升高。近年来日本开发研制的应用液态酶法检测糖化清蛋白(糖化清蛋白-L)具有良好的稀释直线性、日内重复性和日间稳定性,并与HPLC法具有良好的一致性,因此,临床上应用最多[3]。2003年起,国内陆续开展液态酶法测定糖化清蛋白并应用于临床,但在结果的一致性上仍面临较大挑战。日本旭化成制药株式会社(以下简称A)糖化清蛋白试剂出现最早,在国际市场占有率也最高[4],并从2011年开始参加上海市临床检验中心开展的糖化清蛋白项目室间质评工作,通过2019年国家卫生健康委员会临床检验中心和北京市临床检验中心的项目调查。日本积水医疗株式会社(以下简称B)生产的糖化清蛋白试剂于2018年取得我国国家药品监督管理局许可,上市时间较短,该试剂的临床应用缺少数据和文献报道。本研究选取A试剂作为对照系统,评价B试剂的主要分析性能,并对2种进口糖化清蛋白试剂进行方法学比对。
1 材料与方法
1.1材料
1.1.1仪器与试剂 试剂为A厂家和B厂家糖化清蛋白试剂盒及各自配套校准品和质控品。仪器为日立7600全自动生化分析仪。
1.1.2精密度实验样本制备 选取糖尿病患者剩余血清,制备成高值混合血清H,选取体检健康人群剩余血清制备成低值混合血清L,用于精密度实验。
1.1.3正确度验证样本制备 选取北京市临床检验中心2020年第1次糖化清蛋白室间质评样本(转换值202011:13.6%;202012:36.7%;202013:23.2%),用于正确度验证。
1.1.4干扰实验样本制备 选取实验室自配20倍干扰物(胆红素F 300 mg/dL;血红蛋白4 000 mg/dL;乳糜浊度200 mg/dL),预混氨基酸葡萄糖注射液,以及体检健康者剩余血清制备成血清S用于干扰实验。
1.1.5线性验证样本制备 A试剂使用A厂家提供的接近线性水平上限的高值混合血清HH(糖化清蛋白水平为3.00 g/L,清蛋白水平为8.40 g/L)和接近线性水平下限的低值混合血清LL(糖化清蛋白水平为0.05 g/L,清蛋白水平为0.49 g/L),按一定体积比配制成不同水平梯度的样品,用于评价A试剂的线性范围。B试剂按照厂家建议,使用去离子水W及B厂家提供的高值样本HHH(糖化清蛋白水平为395.71 μmol/L,清蛋白水平为666.62 μmol/L)按一定体积比配制成不同水平梯度的样本,用于评价B试剂的线性范围。
1.2方法
1.2.1精密度 参考美国临床和实验室标准协会(NCCLS) EP15-A文件[5],使用2种试剂分别测定高低值混合血清H和L,连续测定5 d,每天测定3次,计算批内变异系数(CV)及总CV,以<1/4北京市临床检验中心允许偏差(<3.75%)为基本要求。
1.2.2正确度 使用2种试剂分别测定北京市临床检验中心2020年第1次糖化清蛋白室间质评样本,计算测定值与认证值的平均百分偏倚,以<1/2允许总误差(±7.50%)为判断标准。
1.2.3干扰实验 参考NCCLS EP07-P文件[6]进行部分调整后配制干扰物,将干扰物加入到体检健康混合血清S中,制成含特定水平干扰物的干扰血清,干扰血清的胆红素F终水平为15 mg/dL;血红蛋白终水平为200 mg/dL;乳糜浊度终水平为10 mg/dL。采用2种试剂分别测定干扰血清各3次,求均值,计算添加干扰物后与干扰物为0时的百分偏差(Bias%)。向体检健康者混合血清S(糖化清蛋白13%~15%)中加入预混氨基酸葡萄糖注射液,模拟氨基酸葡萄糖输液患者体内糖化氨基酸的情况,比较2种试剂去除内源性氨基酸干扰的能力,以相对偏差±10.00%为判断标准。
1.2.4线性试验 因糖化清蛋白为计算项目,但实验室内进行质量管理和排查疑问时需要分开考虑来自糖化清蛋白水平检测和清蛋白水平检测两方面的因素,故将糖化清蛋白水平和清蛋白水平分别进行线性验证。将高值混合血清HH和低值混合血清LL按1LL、1HH∶4LL、2HH∶3LL、3HH∶2LL、4HH∶1LL、1HH配制成6个水平梯度的样本,以进行A试剂的线性实验。将高值样本HHH和去离子水W按1W、1HHH∶4W、2HHH∶3W、3HHH∶2W、4HHH∶1W、1HHH配制成6个水平梯度的样本,以进行B试剂的线性实验。2种试剂分别对各自水平梯度样本按低水平到高水平的顺序各测定2次,记录测定结果。按照NCCLS EP06-A文件[7]提供的方案检查数据,检查离群值,判断重复性,之后进行多元线性回归,将结果分别拟合方程,并绘制散点图进行评价。若所有实验点呈明显直线趋势,用直线回归对数据进行统计,得直线回归方程Y=aX+b,若决定系数(R2)>0.996 0,斜率(a)为0.97~1.03,则判定为线性。
1.2.5特殊样本实验 随机选取实验室当日血清清蛋白水平低于3.50 g/L的剩余血清10份,用于评价2种试剂对于低清蛋白样本的检测能力。
1.2.6比对实验 用覆盖检测范围的20份不同水平人血清样本,进行2种试剂的比对试验。2种试剂分别对20份样本进行检测,每份样本检测1遍,用线性回归方法对两组结果分别进行线性拟合,得到线性回归方程相关系数(r)和a。
2 结 果
2.1精密度结果 2种试剂的精密度均满足临床应用要求。见表1。

表1 2种试剂的精密度结果
2.2正确度结果 2种试剂在检测北京市临床检验中心2020年第1次糖化清蛋白室间质评样本时均符合要求。见表2。

表2 2种试剂的正确度结果
2.3干扰试验结果 15 mg/dL胆红素F、10 mg/dL乳糜对A、B试剂的影响均在可接受范围内。200 mg/dL血红蛋白对A试剂有略微负影响,对B试剂有明显正影响(20.50%),超过可接受范围。糖化氨基酸对A试剂有略微正影响,对B试剂的影响超过可接受范围。见表3。
2.4线性验证 A试剂的预期值与实测值散点图如图1所示,在试验水平范围内,A试剂糖化清蛋白和清蛋白组分的R2分别为0.999 0、0.999 2,均在0.998 0~1.000 0范围内,a分别为0.994 0、1.020 5,均在0.970 0~1.030 0。B试剂糖化清蛋白和清蛋白组分的预期值与实测值散点图如图2所示,在试验水平范围内,B试剂糖化清蛋白组分的R2为0.991 8,a为0.950 7,且有3个水平值超过允许偏倚,不符合a在0.970 0~1.030 0的技术要求范围; B试剂清蛋白组分的R2为0.998 7,a为0.986 5,在可接受范围内。

表3 各干扰物对2种试剂检测结果的相对偏差(%)
2.5特殊样本试验 用2种试剂检测低蛋白血症患者样本结果见表4。2种试剂检测结果r为0.805 2,但检测结果间存在显著差异(t=-3.12,P<0.05),除2个样本外,B试剂检测结果均高于A试剂。

注:A表示糖化清蛋白,B表示清蛋白。

注:A表示糖化清蛋白,B表示清蛋白。
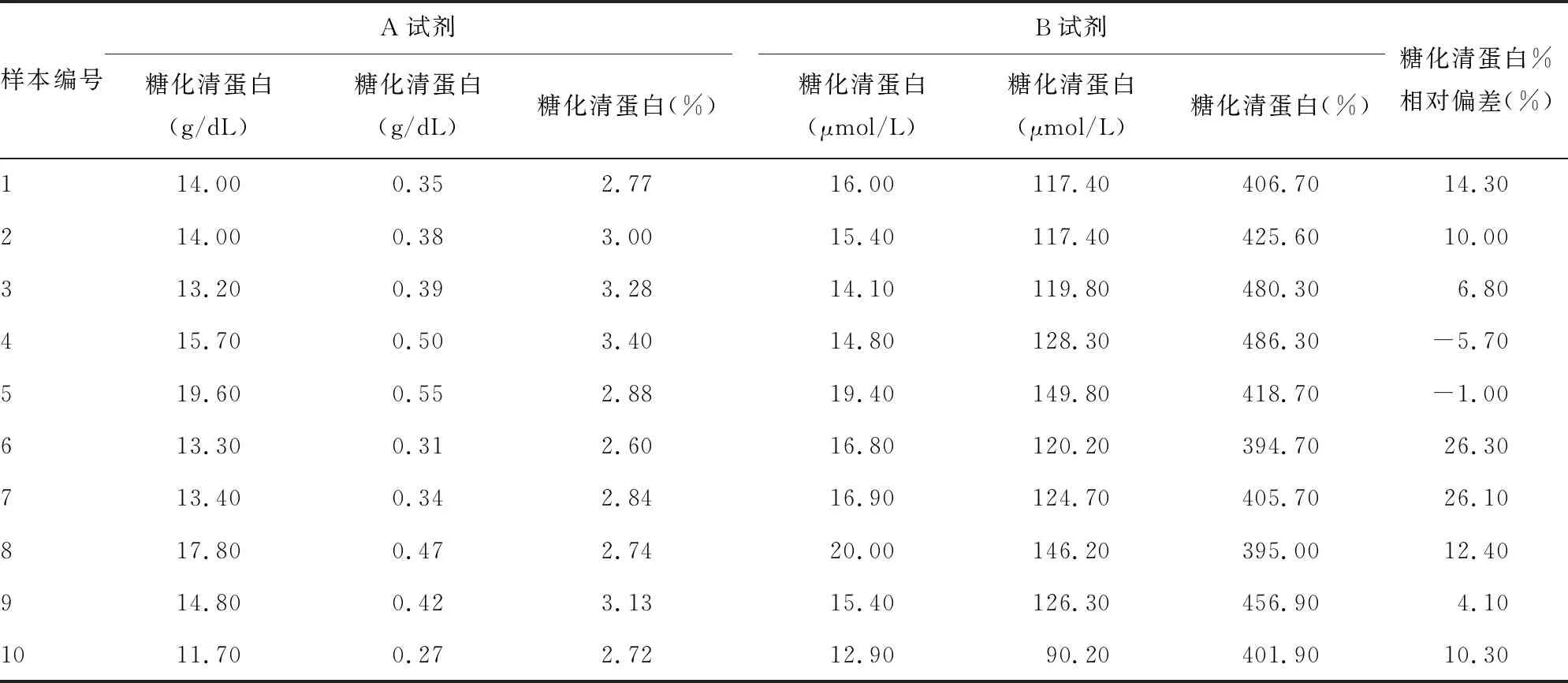
表4 2种试剂对低蛋白血症患者样本的检测结果
2.6比对试验 以A试剂作为对照系统,比对结果见表5。结果显示2种试剂间检测结果相关性较高(r=0.987 6),但检测结果间存在显著性差异(t=-5.67,P<0.01);除3个样本外,B试剂检测结果均高于A试剂,占总检测量20例的85%,其中结果相对偏差超过7.50%的有6例,占30%,相对偏差超过10.00%的有1例,占5%。

表5 2种试剂比对实验结果

续表5 2种试剂比对实验结果
3 讨 论
2020年我国最新糖尿病流行病学调查研究显示,我国成人糖尿病患病率为12.8%,估计糖尿病患者总数为1.298亿,糖尿病前期患病率为35.2%,糖尿病患者的知情率仅为43.3%[8]。而2008年流行病学调查报告显示,20岁以上人群,年龄标准化的糖尿病患病率为9.7%[9];2010年流行病学调查显示,18岁及以上成人糖尿病患病率为11.6%[10]。糖尿病患者数逐渐增加,这意味着我国糖尿病预防工作不容乐观。我国糖尿病患者以餐后高血糖为主,男性糖尿病前期患者的空腹血糖受损、糖耐量受损、空腹血糖受损合并糖耐量受损分别为19.9%、68.3%、11.8%,女性糖尿病前期患者为14.9%、73.6%、11.5%,仅用空腹血糖筛查可能造成较高的漏诊率[11]。而由于经济差异和操作的可行性,我国目前糖尿病的初筛通常还是以空腹血糖为主,这也可能是造成我国糖尿病患者知情率较低的原因之一。有研究指出,空腹血糖联合糖化清蛋白筛查糖尿病,可将筛查灵敏度和特异度均提高到92%以上,有效提高筛查效率,减少漏诊率[12]。
随机血糖检测易受饮食、药物、情绪等因素影响,无法体现一段时间内的血糖控制情况。糖化血红蛋白通常被认为是临床监测长期血糖控制的“金标准”,它可以反映检测前2~3个月的平均血糖水平,但是很难反映餐后血浆葡萄糖水平或血糖的波动。除此之外,任何改变红细胞寿命的因素都将导致糖化血红蛋白结果不准确,如溶血性贫血等。糖化清蛋白是临床上血糖监测的重要指标之一,能反映近期血糖情况,适用于血糖波动较大的新发糖尿病患者治疗效果评价,且糖化清蛋白与糖尿病血管并发症相关,可预测心血管事件的发生,具有较高的临床价值[13]。随着糖化清蛋白在临床中应用价值逐渐提高,检测结果的准确可比性成为其在临床中应用的关键因素[14]。
已有国内学者对多家国产糖化清蛋白试剂和A试剂做过性能比较[15],本研究则主要针对2种进口试剂进行验证评价。本研究结果显示,2种试剂的精密度和正确度均可满足临床使用要求。A试剂的线性和抗干扰能力更优;血红蛋白和糖化氨基酸对B试剂具有显著影响。2种进口试剂均采用对清蛋白特异度更高的溴甲酚紫方法以提高清蛋白的检测能力,但在B试剂的说明书中仍然提示,测定低清蛋白血症患者,有可能得不到正确的糖化清蛋白(%)。
本研究验证糖化清蛋白试剂对于低蛋白血症患者的检测能力,2种试剂间存在较大差异,为进一步提升临床服务能力,推动临床应用发展,糖化清蛋白检测标准化及各厂家试剂检测结果一致化问题应引起重视。

