睾丸间质细胞睾酮合成机制的研究进展
朱清玉,郭乐薇,刘红羽,赵 静,吕文发*,王 军*
(1.吉林农业大学现代农业技术教育部国际合作联合重点实验室,吉林长春 130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,吉林长春 130118)
睾酮又称睾丸素、睾丸酮或睾甾酮,作为动物体内重要的性腺类固醇激素之一,睾酮不仅可以促进性器官的发育成熟,影响生殖功能,还对肌肉生长、骨骼密度、神经系统和心血管疾病等有重要作用[1-2]。睾酮合成是一个精确调控的过程,其含量不足或过多都会影响机体健康。对睾酮缺乏症患者调查发现,睾酮缺乏不仅会降低性欲引发男性不育,还可能造成患者体力、肌肉质量下降、骨质疏松、肥胖、睡眠障碍和情绪低落等问题[3]。睾酮含量过高可能导致雄性性早熟、肾上腺疾病、睾丸疾病等[4-5]。在雄性动物中,约95%的睾酮由睾丸间质细胞合成[6]。睾酮合成过程复杂,除经典途径环磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP)/ 蛋白激酶A(Protein Kinase A,PKA)通路外,一些信号通路、细胞因子、转录因子和非编码RNA 也可调控睾酮的合成。本文主要总结了睾丸间质细胞睾酮合成过程和合成机制,为睾酮合成的进一步研究提供参考。
1 睾丸间质细胞睾酮合成的过程
睾丸间质细胞睾酮的合成受下丘脑-垂体-睾丸(Hypothalamus-Pituitary-Testis,HPT)轴调控,其作用机制:下丘脑分泌促性腺激素释放激素(Gonadotropin-Releasing Hormone,GnRH)刺激垂体分泌促黄体生成素(Luteinizing hormone,LH),LH 与睾丸间质细胞表面的促黄体生成素受体(Luteinizing Hormone Receptor,LHR)结合[7],之后在G 蛋白(Gprotein,G)的作用下激活腺苷酸环化酶(Adenylate Cyclase,AC),促进细胞内cAMP 产生,进而激活PKA,促进cAMP 反应原件结合蛋白(Cyclic AMP Responsive Element-Binding Protein,CREB)磷酸化,激活类固醇合成急性调节蛋白(Steroidogenic Acute Regulatory Protein,StAR)。被激活的StAR 通过与线粒体外膜上的转运蛋白(Translocator Protein,TSPO)结合,加速胆固醇从线粒体外膜向线粒体内膜的转运[8]。随后胆固醇在线粒体内膜上通过细胞色素P450 胆固醇侧链裂解酶(Cytochrome P450 Cholesterol Side Chain Lyase,P450scc,又称CYP11A1)转化为孕烯醇酮,孕烯醇酮被转运至内质网,在3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)的作用下酶解为孕酮,孕酮被催化为雄烯二酮,最终雄烯二酮在17β-羟基类固醇脱氢酶(17β-Hydroxysteroid Dehydrogenase,17β-HSD)的作用下生成睾酮[9](图1)。
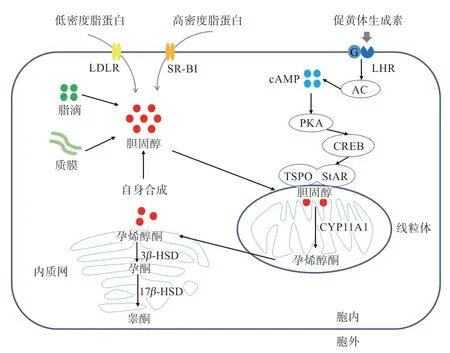
图1 睾丸间质细胞睾酮合成过程和胆固醇来源(自绘)
胆固醇作为睾酮合成的原料,参与睾丸间质细胞睾酮合成过程[10]。在间质细胞内的胆固醇主要由细胞外转运和细胞内脂滴转化而来。其中,胞外的低密度脂蛋白(Low Density Lipoprotein,LDL)通过低密度脂蛋白受体(Low Density Lipoprotein Receptor,LDLR)进入细胞后,在前蛋白转化酶枯草杆菌蛋白酶(Proprotein Convertase Subtilisin Kexin 9,PCSK9)的作用下被溶酶体降解为胆固醇[11]。载脂蛋白A-1(Apolipoprotein A-1,Apo A-1)可利用胞外的高密度脂蛋白(High Density Lipoprotein,HDL)调节睾丸间质细胞睾酮合成[12]。HDL 还可通过清道夫受体BI(Scavenger receptor-BI,SR-BI)转运至胞内,直接为睾酮合成提供原料。当SR-BI 的表达受到抑制时,胞内胆固醇供应不足,睾酮的合成减少[13],表明HDL 可能影响睾酮合成。在间质细胞中,脂滴在脂肪分解相关酶(PLIN1、HSL 和ATGL 等)的作用下分解变小转化为胆固醇,分散在整个细胞质中[14-15]。另外,也有研究发现自噬可调控细胞内脂滴的积累,当自噬被抑制后,大鼠睾丸间质细胞内脂滴积累增加,游离胆固醇含量减少,睾酮合成减少[16],提示胞内脂滴含量影响睾酮的合成。这些发现指出胆固醇的任一来源受到影响均可能影响睾酮的合成。
胆固醇从线粒体外膜向线粒体内膜的转运是睾酮合成的关键步骤[10]。研究发现,线粒体外膜上的1 种膜蛋白TSPO 通过与StAR 结合后相互作用促进胆固醇向线粒体内膜的转运[17]。促进TSPO 表达可提高睾丸间质细胞生成睾酮的能力[18],反之则降低睾丸间质细胞生成睾酮的能力[19]。此外,TSPO 特异性配体也可刺激胆固醇向线粒体内膜的转运,促进睾丸间质细胞生成类固醇,升高睾酮水平[20]。这些研究有力地支持了TSPO促进胆固醇转运在类固醇合成中发挥重要作用的观点。
2 信号通路对睾酮的调控作用
2.1 cAMP/PKA 信号通路 cAMP/PKA 信号通路是调控睾酮合成的经典途径。已有研究报道,激活cAMP/PKA信号通路可促进间质细胞睾酮的合成,而抑制cAMP/PKA 信号通路可抑制睾丸间质细胞睾酮的合成[21]。近年来,研究睾酮合成的机制也多集中于该通路。如外源添加脂联素旁系同源C1q/TNF 相关蛋白3(Adiponectin paralog C1q/TNF-related protein 3,CTRP3)、顺式阿曲库铵(Cisatracurium,CAC)和3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2-pyridinol,TCP)等均可调控睾丸间质细胞中睾酮合成相关蛋白和CREB 磷酸化水平,进而调控睾酮合成过程[22-24]。无论是在动物体内还是体外,cAMP/PKA 信号通路在睾酮合成过程中具有重要的调控作用。
2.2 PI3K/ AKT 信号通路 磷脂酰肌醇-3-激酶(Phosp hatidylinositol 3-kinase,PI3K)/丝苏氨酸激酶(Serine threonine kinase,AKT)信号通路参与细胞周期、细胞生长、细胞代谢等多种生物过程[25]。LH/hCG 依赖于PI3K/AKT通路抑制间质细胞中叉头盒蛋白3(Forheadbox protein 3,FOXO3),促进睾酮分泌[26]。Eid 等[27]研究也证实,PI3K/AKT 通路激活可上调StAR、3β-HSD 和17β-HSD表达,促进睾丸类固醇生成,同时增加血清睾酮水平。与之相似的是,本实验室前期发现,抑制PI3K/AKT信号通路会抑制小鼠睾丸间质细胞StAR、3β-HSD 和CYP11A1 的mRNA 和蛋白表达从而抑制睾酮的合成,甚至还可能会影响睾丸间质细胞的凋亡[28]。这些结果证明了PI3K/AKT 信号通路可参与调控睾酮的合成过程。
2.3 MAPK 信号通路 丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)信号通路由丝氨酸/苏氨酸蛋白激酶构成,其可将细胞外的信号刺激传递至细胞内,进而调节生物过程[29]。研究发现,MAPK通路的主要成员c-Jun N 末端蛋白激酶(c-JUN NH2-Teminal Protein Kinase,JNK)和p38 丝裂原活化蛋白激酶(p38 Mitogen-Activated Protein Kinase,p38 MAPK)均可调控睾酮合成的过程,但它们对睾酮合成的具体作用存在争议[30]。Jing 等[31]指出,小鼠睾丸间质细胞中的p38 MAPK 的磷酸化水平降低,抑制了StAR、CYP11A1 和3β-HSD 表达和睾酮合成;但Adedara 等[32]在大鼠睾丸间质细胞中添加黄曲霉毒素B1发现p38MAPK 磷酸化水平升高,StAR、3β-HSD 和CYP11A1表达降低,睾酮合成受到抑制。Han 等[33]在镍的诱导下大鼠睾丸间质细胞内检测到p38 MAPK 和JNK 的磷酸化水平升高,StAR、CYP11A1、3β-HSD、CYP17A1和17β-HSD 的表达水平降低,睾酮合成受到抑制;而Sokanovic 等[34]研究指出,在大鼠睾丸间质细胞中,JNK 可通过抑制磷酸二酯酶5(PDE5)促进睾酮合成。虽然这些研究没有明确MAPK 信号通路对睾酮合成的具体作用,但可以确定的是MAPK 信号通路对睾酮合成的调控是通过睾酮合成的关键酶StAR、CYP11A1 和3β-HSD 实现的。
3 细胞因子的调控作用
细胞因子由多种组织细胞合成和分泌,主要分为生长因子、白细胞介素和干扰素等。睾酮合成过程中,睾丸间质细胞中的一些生长因子参与其中,如血小板衍生生长因子(Platelet Derived Growth Factor,PDGF)和沙漠刺猬因子(Desert Hedgehog Factor,DHH),在影响睾丸间质细胞增殖、分化的同时还可影响睾酮合成[35-36]。纤维细胞生长因子(Fibroblast Grow Factors,FGF9)和胰岛素生长因子I(Insulin-like Growth Factors,IGF-I)也可通过影响3β-HSD、CYP11A1 和CYP17A1的表达调控睾酮的合成[37-38]。其他的一些细胞因子,如转化生长因子(Cytokine Transforming Growth Factorβ,TGF-β)、肿瘤坏死因子(Tumor Necrosis Factorα,TNFα)、白介素-1(Interleukin 1,IL-1)和白介素-6(Interleukin 6,IL-6)等也参与调控睾酮合成过程,其作用机制可能与睾丸间质细胞的状态有关[39]。
4 转录因子的调控作用
转录因子是一种具有特殊结构、行使调控基因表达功能的蛋白质。研究发现,一些转录因子可调控睾酮的合成过程,如肌细胞增强因子2(Myocyte Enhancer Factor 2,MEF2)、GATA 结合蛋白4(Recombinant GATA Bindingprotein 4,GATA4)、核受体类固醇生成因子-1(Steroidogenic Factor-1,SF-1,NR5A1)和神经生长因子诱导基因B(Nerve Growthfactor-Induced Gene B,NGFI-B,NR4A1,Nur77)等[39-40]。其中MEF2 是最近在睾丸间质细胞中鉴定的转录因子,通过调控StAR表达影响睾丸间质细胞的睾酮合成[41]。GATA4 的磷酸化受到抑制可降低CYP11A1、CYP17A1 和3β-HSD 的表达,降低小鼠血清睾酮水平[42]。SF-1 可调控参与胆固醇运输的蛋白,如StAR、SR-B Ⅰ和SCP2 等[43],促进睾酮合成相关酶StAR、CYP11A1、3β-HSD、CYP17A1 和17β-HSD 的表达,促进睾酮合成[44]。Nur77 调节睾酮合成相关酶表达的机制与SF-1 相同[45],而且其对StAR 表达的促进作用比cAMP 对StAR 的促进作用发生的更快[46]。
5 非编码RNA 的调控作用
非编码RNA 是指不编码蛋白质的RNA,主要包括小非编码RNA(MicroRNA,miRNA)、长链非编码RNA(Long noncoding RNA,lncRNA)和转运RNA(Transfer RNA,tRNA)等。随着大规模基因组技术和生物信息学分析的发展,越来越多的非编码RNA 被鉴定出来。在睾丸间质细胞睾酮合成过程中,miRNA 发挥重要的调控作用。miR-29a、miR-29c、miR-142-3p、miR-451 和miR-335 均 受LH 的调节,并参与调节未成熟睾丸间质细胞睾酮合成的过程[47]。miRNA 也可直接调控cAMP/PKA 信号通路,调节睾酮合成的过程。如miR-142-3p 可通过抑制cAMP 的产生影响cAMP/PKA 信号级联,最终抑制类固醇激素的合成[48]。miRNA 还可通过影响睾丸间质细胞内的胆固醇含量调节睾酮合成。研究发现,miRNA-125a 和miRNA-455 通过抑制睾丸间质细胞中SR-BI 的表达和胆固醇酯(HDL-associated cholesteryl esters,HDLCEs)的选择性摄取,参与睾酮合成过程[49]。lncRNA参与表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动[50]。通过高通量测序发现,镍处理之后大鼠睾丸间质细胞睾酮的合成显著降低,并且伴随着372个发生显著变化的lncRNA[51]。Yang 等[52]研究发现,lncRNATCONS_01981470 可通过靶向调节CYP19A1调节类固醇激素的生物合成以及雄激素的代谢过程。另外,lncRNA LOC105607399 和LOC105610178 在维持睾酮合成中具有重要作用[53]。虽然,睾酮合成调控在非编码RNA 中研究较少,但其调控过程都与cAMP/PKA 信号通路以及睾酮合成相关酶有关,这也为以后的研究提供思路。
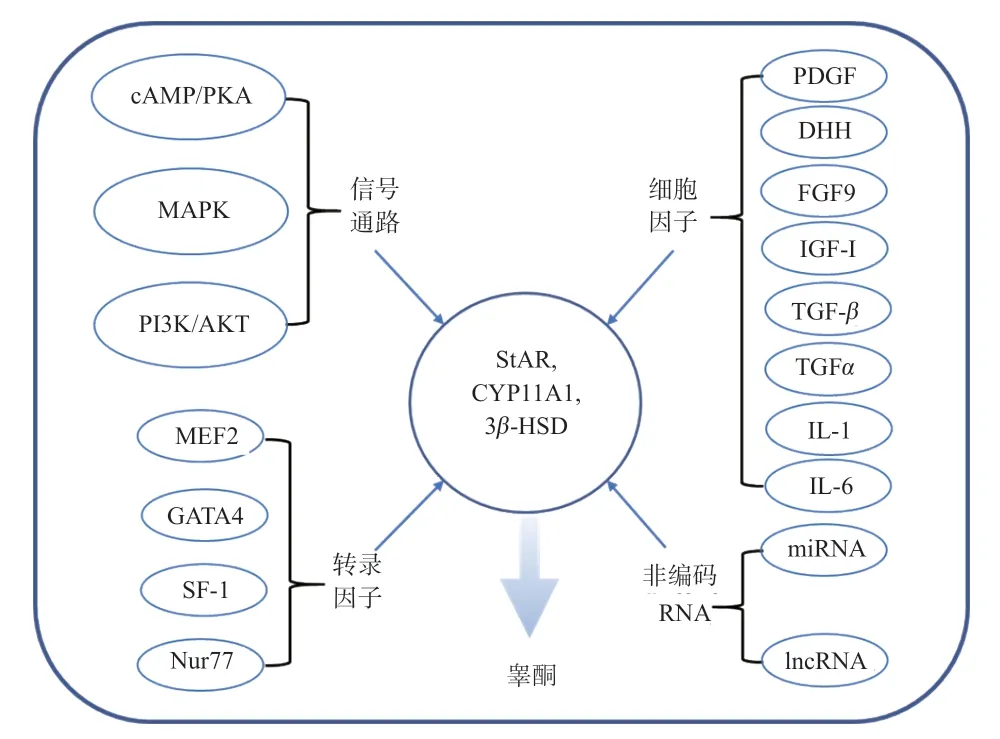
图2 睾酮的合成调控
6 结论与展望
睾酮合成主要受HPT 轴调控,通过分泌LH 促进类固醇激素合成相关酶的表达调控睾酮的合成。cAMP/PKA、MAPK、PI3K/AKT 等多个通路、生长因子、转录因子和非编码RNA 等参与这一过程。但到目前为止,发现的各种信号通路的靶点、转录因子的靶基因、转录因子之间的相互作用以及它们翻译后修饰的作用机制仍然仍不明确,还需要深入研究睾丸间质细胞睾酮合成机制。揭示间质细胞睾酮合成机制,不仅可为丰富动物生殖内分泌调控理论提供参考,也可为开发雄性动物繁殖调控技术奠定基础。

