特地唑胺对耐甲氧西林表皮葡萄球菌植入物相关性骨髓炎的治疗效果研究Δ
娄方练,郑周海,付福建
(重庆市南川区人民医院骨科,重庆 408400)
>50%的慢性和恶性感染由革兰阳性葡萄球菌引起,其中以金黄色葡萄球菌和表皮葡萄球菌最为常见[1]。在美国和欧洲,引起假体关节感染的凝固酶阴性葡萄球菌中,>80%的菌株对甲氧西林耐药;慢性细菌的感染过程中常涉及生物膜的形成[2-3],并且生物膜内微环境的改变会影响药物的抗菌作用,因此,临床上由耐甲氧西林表皮葡萄球菌(methicillin-resistantStaphylococcusepidermidis, MRSE)引起的植入物相关感染治疗困难,抗菌药物疗效局限,通常需要移除所有的假体或充分清创才能得以痊愈[4-5]。针对MRSE相关性植入物导致的骨髓炎需要安全有效的抗菌方案。
目前,万古霉素是MRSE感染的首选治疗药物,但由于针对MRSE的万古霉素最低抑菌浓度(minimum inhibitory concentration,MIC)相对较高,一些研究结果认为对于MRSE,万古霉素具有潜在毒性和有限的杀菌作用[6-7]。利福平在生物膜相关感染中的治疗效果明显,但针对耐药菌的治疗仍具有风险,因此不作为单一药物进行使用。特地唑胺是噁唑烷酮类抗菌药物,经美国食品药品监督管理局批准用于急性细菌性皮肤及皮肤结构感染的治疗,并且其对耐甲氧西林葡萄球菌具有更强的作用[8-9]。但目前尚无针对特地唑胺治疗MRSE植入物相关性骨髓炎的具体研究,因此,本研究利用MRSE菌株建立了骨髓炎大鼠模型,将特地唑胺单药、特地唑胺联合利福平、利福平单药、万古霉素单药以及万古霉素联合利福平的治疗效果进行比较,现报告如下。
1 材料
1.1 仪器
RM2235型手动轮转式切片(Leica公司);BX41型光学显微镜(Olympus公司);DS-Ril型生物数码显微镜(Nikon公司)。
1.2 MRSE菌株及实验动物
MRSE菌株:研究所涉及到的MRSE菌株最初是从恢复期的假体周围感染患者获取。实验动物:雄性大鼠94只,体重250~350 g,购自上海斯莱克实验动物有限责任公司,动物许可证号为SCXK(沪)2012-0002。本研究相关内容获得了医院动物伦理委员会的批准。
1.3 药品与试剂
注射用盐酸万古霉素(批准文号为国药准字H20084268,规格为0.5 g)购自重庆莱美药业股份有限公司;注射用磷酸特地唑胺(CAS号:856867-55-5)购自美国Merck公司;利福平注射液[批准文号为国药准字H20050725,规格为5 ml∶ 0.3 g(以利福平计)]购自沈阳双鼎制药有限公司。0.9%氯化钠溶液购自广州珠江制药厂。
2 方法
2.1 动物模型的建立
采用体重250~350 g的雄性大鼠94只建立实验性植入物相关性骨髓炎模型。首先,腹腔注射氯胺酮(60 mg/kg)和甲苯噻嗪(6 mg/kg)进行全身麻醉之后,剃光大鼠左腿毛发,手术暴露左腿胫骨近端1/3,髓腔内钻取1.5 mm直径孔。在0.9%氯化钠溶液中加入硬化剂、花生四烯酸钠盐并注入髓腔。将108CFU/ml MRSE悬液100 μl注射至骨髓中。预先准备直径5 mm、长度1 mm的不锈钢丝,浸泡于MRSE和色氨酸酶大豆肉汤混合的悬浮液1 ml中,37 ℃环境下孵育2 h,使其形成生物膜,并将带有生物膜的金属丝植入骨髓腔内。以石膏覆盖孔口,用缝合线缝合筋膜和皮肤,并在伤口上喷洒杀菌剂。皮下注射缓释丁丙诺啡(0.05 mg/kg)止痛。为验证模型是否成功,于感染1周后取5只大鼠进行定量骨和钢丝的细菌培养。
2.2 分组
确定感染后,94只动物开始接受不同的药物治疗。动物随机分为6组:对照组(18例)、特地唑胺治疗组(16例)、特地唑胺-利福平联合治疗组(15例)、利福平治疗组(15例)、万古霉素治疗组(15例)以及万古霉素-利福平联合治疗组(15例)。选择合适的剂量模拟上述人体MIC浓度。不同药物的给药剂量和方法如下:特地唑胺30 mg/kg,1日1次;利福平25 mg/kg,1日2次;万古霉素50 mg/kg,1日2次;上述药物均为腹腔注射,连续治疗14 d。
治疗结束后24 h处死大鼠。无菌条件下取出左侧胫骨,如果需要培养,则冷冻于-80 ℃环境中。每组取1只大鼠胫骨进行组织病理学评价。在植入钢丝的5 mm范围内切割和粉碎骨头、称重,并对不锈钢丝进行无菌处理。将粉碎的骨头和钢丝分别悬浮于胰蛋白胨大豆肉汤2 ml中,涡旋30 s,40 kHz下超声5 min。进行定量骨和钢丝细菌培养。如果在定量培养过程中没有细菌生长,则在剩余的2 ml肉汤中加入无菌胰蛋白胨大豆肉汤8 ml,37 ℃下孵育48 h,进行定性培养。对于有生长迹象的肉汤,进行传代,以确定存在MRSE。
2.3 抗菌药物的MIC测定
对于治疗后从骨或钢丝上恢复的MRSE,使用定量培养板上的3个菌落测定特地唑胺、利福平或万古霉素的MIC。采用琼脂稀释法测定生物膜测定最低生物膜抑菌浓度(MBIC)和最低生物膜杀菌浓度(MBBC),具体方法如下:将不同浓度剂量的抗菌药物稀释后加入融化并冷却至约50 ℃的琼脂中,制成不同药物浓度梯度的平板并接种获取的MRSE菌种,孵育后观察细菌生长情况,测定MBIC和MBBC。
2.4 组织病理学检查
每组随机抽取1只大鼠取下的胫骨,在10%甲醛中固定2 d,在5%硝酸溶液中脱钙。胫骨纵切成两半,石蜡包埋,顶部有髓腔表面,纵切,然后进行苏木精-伊红(hematoxylin and eosin,HE)染色。观察成骨细胞数量,骨重建形成和骨破坏情况,以及炎症细胞浸润程度。
2.5 统计学方法
使用SAS 9.4软件进行数据分析,以骨(g)或钢丝(cm2)表面葡萄球菌数目(以lg CFU表示)的中位数和四分位数间距(IQR)进行统计学描述;使用Kruskal-Wallis检验比较各组细菌数量差异,进一步采用威尔科克森秩和检验进行对照组与5个治疗组的组间比较;P<0.05为差异有统计学意义。
3 结果
3.1 各药的MIC、MBIC以及MBBC
各药针对MRSE的MIC:万古霉素为2 μg/ml,利福平≤0.015 μg/ml,特地唑胺为0.5 μg/ml。各药针对MRSE的MBIC:万古霉素为2 μg/ml,利福平为0.001 μg/ml,特地唑胺为2 μg/ml。各药针对MRSE的MBBC:万古霉素为128 μg/ml,利福平为2 μg/ml,特地唑胺为32 μg/ml。
3.2 实验性骨髓炎大鼠模型的构建及药物治疗效果评估
建模1周后检测大鼠骨组织中MRES的细菌数量,中位细菌数量为4.89 lg CFU/g[IQR为(3.83~5.33)lg CFU/g],并且所有钢丝表面均检测到MRSE。经药物治疗后再次对骨组织进行细菌的定量培养,结果见图1(A)。对照组的MRSE细菌数量为3.70 lg CFU/g [IQR为(0.5~4.29)lg CFU/g],特地唑胺组为0.50 lg CFU/g[IQR为(0.1~2.68)lg CFU/g],万古霉素组为2.78 lg CFU/g [IQR为(0.50~3.64)lg CFU/g]。利福平治疗组、特地唑胺-利福平联合治疗组及万古霉素-利福平联合治疗组的骨组织中均未检出MRSE。除万古霉素治疗组外,其他治疗组的菌落计数与对照组比较,差异均有统计学意义(P≤0.005)。特地唑胺治疗组与万古霉素治疗组比较,残留细菌数量的差异无统计学意义(P=0.11)。但特地唑胺治疗组与利福平治疗组(P=0.000 8)、万古霉素治疗组与利福平治疗组(P=0.000 3)的细菌数量比较,差异均有统计学意义。
同时,对钢丝上的MRSE进行定量培养,结果见图1(B)。利福平治疗组(P=0.02)、特地唑胺治疗组(P=0.43)、特地唑胺-利福平联合治疗组(P=0.003)及万古霉素-利福平联合治疗组(P=0.003)的MRSE菌落数与对照组相比,差异均有统计学意义;但万古霉素治疗组MRSE菌落数与对照组相比,差异无统计学意义(P=0.27)。
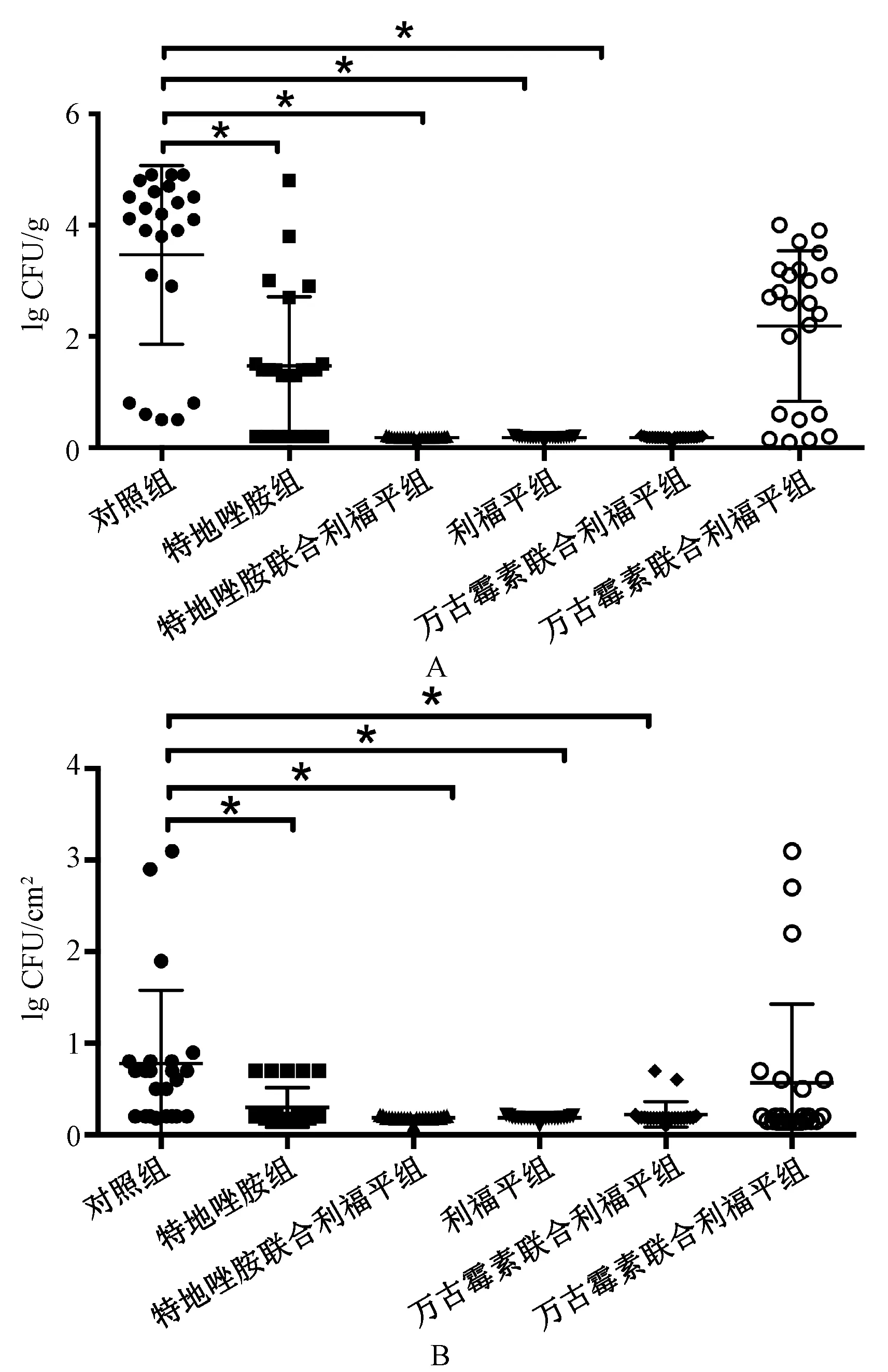
A.MRSE细菌的骨组织定量培养结果(以每克骨组织的细菌菌落数lg CFU表示);B.MRSE细菌的钢丝定量培养结果(以每cm2表面积中的细菌菌落数lg CFU表示);*P<0.005;水平线表示中位数A.quantitative culture results on bone tissue of MRSE bacteria (expressed as lg CFU of bacterial colonies per gram of bone tissue;B.quantitative culture results on steel wire of MRSE bacteria (expressed as lg CFU of bacterial colonies per cm2 of surface area);*P<0.005; the horizontal line indicates the median图1 骨组织及钢丝表面细菌的定量培养结果Fig 1 Quantitative culture results on bone tissue and steel wire surface of bacteria
3.3 骨组织的病理学分析
对骨组织进行HE染色,由图2可知,在MRSE细菌的刺激下,对照组中的成骨细胞活性显著增加,骨重建明显[图2(A)箭头所示],但大鼠的骨组织标本中均无急性炎症细胞浸润的迹象;在万古霉素治疗组大鼠的骨骼横截面上的髓腔内可见一条钢丝穿透切迹[图2(B)箭头所示]。

A.对照组(HE染色,×400倍);B.万古霉素治疗组(×20倍)A.control group(HE staining, ×400 times); B.vancomycin treatment group(×20 times)图2 骨组织病理学图像Fig 2 Histopathological analysis of bone tissue
4 讨论
本研究采用假体周围感染患者来源的MRSE菌株构建骨髓炎大鼠模型,进行特地唑胺、利福平以及万古霉素的药物干预,发现除单用万古霉素效果不佳外,特地唑胺联合利福平、万古霉素联合利福平均对MRSE感染的骨髓炎动物模型具有较好的治疗效果。
虽然在感染性心内膜炎以及小鼠导管相关生物膜感染模型中,特地唑胺对MRSA的治疗作用已经得到了验证[10-11],但特地唑胺针对MRSE在骨髓炎中的作用尚未得到研究结果证明。本研究成功建立了一种实验性植入物相关性骨髓炎大鼠模型,并将其用于评价特地唑胺对MRSE的治疗作用。既往有研究报道认为,可以通过将细菌直接注入髓腔4周后产生骨髓感染,建立骨髓炎模型[12-14]。但是,单纯注射MRSE并不能产生足够的感染力,机体能够通过自身的免疫反应在3周内清除病原,因此,骨髓炎建模的成功率不稳定。本研究对既往MSRA骨髓炎模型进行了改进,包括筛选来自临床患者的常见菌株,借助钢丝形成MRSE的生物膜并转移至骨髓腔内,使模型更符合临床常见的植入物源性骨髓炎的发病机制。同时,将感染时间和治疗间隔分别缩短至1周和2周,避免了因疾病自限性造成的假阳性。此外,本研究观察到MRSE的数量随着时间的推移而减少(1周时为4.89 lg CFU/g,3周时为3.7 lg CFU/g);发现感染3周后骨组织病理切片没有急性炎症的迹象,但会出现骨重塑和成骨活性的增加。这与既往的研究结果一致,金属植入物的大鼠股骨骨折模型的研究结果发现,术中轻度表皮葡萄球菌污染不会出现明显的感染症状,但是会抑制骨愈合[15-16]。
本研究观察到万古霉素单药治疗并不能减少细菌数量,而特地唑胺单药治疗可以明显抑制细菌数量,MRSE在骨内、钢丝上的中位数均低于万古霉素单药治疗组。特地唑胺-利福平联合治疗组的MRSE数量较无治疗组明显减少,且特地唑胺-利福平联合治疗与万古霉素-利福平联合治疗效果相当。虽然临床上针对MRSE的治疗通常会选择万古霉素,但葡萄球菌可能存在一定的耐药性[17],因此一直存在争议。最近,相关研究报道,在小鼠皮下导管相关生物膜感染模型中,特地唑胺降低MRSA密度的效果优于利奈唑胺和万古霉素[18]。特地唑胺对葡萄球菌的体外药效是万古霉素的2~8倍[19],其对葡萄球菌的抑菌作用和抗生素后效应优于利奈唑胺。特地唑胺孵育6~24 h内可明显阻止细菌再生,而根据体内生物荧光成像检测证实特地唑胺与停药后复发无关[20]。目前的研究结果表明,特地唑胺联合利福平治疗可能是MRSE植入物相关性骨髓炎的一种具有临床应用前景的治疗方案。
本研究也具有一定的局限性。首先,使用了单一的菌株。其次,由于感染持续时间短,该模型可能不能反映慢性骨髓炎的治疗效果。综上所述,本研究建立了一种新的大鼠MRSE骨髓炎模型,该模型可用于研究抗菌治疗方案的效果,并且本研究成功证实特地唑胺与利福平联合治疗对MRSE外源性骨髓炎具备较好的治疗效果。

