回用盐对铝粉除钒精制四氯化钛质量的影响研究
陈爱祥,黄志鹏,姜宝伟,朱福兴,李 亮,杜 鑫,漆丽华
(1.攀钢集团攀枝花钛材公司,四川 攀枝花617063;2.攀钢集团研究院有限公司 钒钛资源综合利用国家重点实验室,四川 攀枝花617000)
四氯化钛(TiCl4)是生产海绵钛和氯化法钛白粉所必需的中间原料。近年来,随着钛产业的高速发展,其需求量也在逐年增加[1]。工业上大规模生产TiCl4的方法主要是沸腾氯化法与熔盐氯化法[2],其中与熔盐氯化技术相配套的还有铝粉除钒精制技术。熔盐氯化法由于能较好地适应高钙镁钛渣,可有效降低TiCl4生产成本,比较适合于钙镁杂质含量较高的攀西地区钛资源[3]。熔盐氯化生产过程中须要向氯化炉中加入工业盐(NaCl或KCl),熔融的NaCl或KCl在氯化炉内能将含钛物料和石油焦悬浮其中[4],使固体颗粒物料与氯气充分接触,并发生加碳氯化反应生成粗四氯化钛(以下简称“CTT”)。
熔盐氯化生产TiCl4过程中的工业尾气须要进行水洗和碱洗达标后排放[5],水洗产物是HCl浓度为20%~25%的盐酸;碱洗一般采用NaOH溶液,洗涤后产生含NaCl、NaClO和NaOH等杂质的废盐水。一种低成本环保处理盐酸和废盐水的方式是:先采用H2O2还原NaClO,然后用盐酸中和废盐水,最后采用多效蒸发设备将中和后的废盐水蒸发,得到干燥的NaCl盐(以下简称“回用盐”),回用盐中的NaCl含量可达到90%以上。如果能将回用盐加入熔盐氯化炉中替代部分NaCl使用,将有效降低TiCl4生产的环保成本。回收盐中除了NaCl外,还可能含有其它杂质,其在熔盐氯化过程中是否会进入CTT中或对后续的精四氯化钛(以下简称“PTT”)和海绵钛质量造成影响,相关的分析研究目前尚无文献报道。本文将对回用盐的成分和物相进行检测分析,并在此基础上开展工业生产验证试验,旨在为回用盐在熔盐氯化炉中使用的可行性提供技术和理论支撑。
1 实验原理
熔盐氯化是将富钛料和石油焦悬浮在熔盐(主要由NaCl、MgCl2、CaCl2、FeCl2和MnCl2组成)介质中与氯气反应制取TiCl4的方法[6],其主要反应如式(1)所示。
TiO2(s)+2Cl2(g)+C(s)=TiCl4(g)+CO2(g)
(1)
得到的CTT采用铝粉除钒工艺技术精制提纯。关于CTT的精制除钒原理,Gerhard[7]认为参与除钒反应的主要是络合物3TiCl3·AlCl3中的TiCl3,在有AlCl3作为催化剂存在的条件下,TiCl3与CTT中VOCl3反应生成不溶于TiCl4的VOCl2沉淀,而后采用蒸馏的方法可将其分离去除。实际生产中除钒过程常在蒸馏釜中完成,发生的反应如式(2)所示。
VOCl3(l)+TiCl3(s)=VOCl2(s)+TiCl4(l)
(2)
制备所得的除钒试剂以nTiCl3·AlCl3(n=1~3)络合物形态存在。
2 实验条件
2.1 实验原料
实验过程中采用回用盐为辅助原料制备出CTT,然后采用低价钛矿浆(以下简称“LTC”)对CTT进行除钒提纯,这些原料的质量指标参见表1。

表1 实验原料成分 %
2.2 实验设备
工业实验设备:160 t/d熔盐氯化生产设备,LTC制备设备,以及TiCl4蒸馏除钒设备。
TiCl4和回用盐中杂质元素检测:采用电感耦合等离子体原子发射光谱仪(ICP-AES,NexION 300D型,美国珀金埃尔默股份有限公司)测试其中杂质元素含量,采用傅里叶红外光谱仪(FTIR, Nicolet iS50型,美国赛默飞世尔科技公司)测定TiCl4中有机物。
回用盐中的固相物检测:采用X射线衍射仪(XRD,X’pert PRO型,荷兰帕纳科公司)进行物相表征,采用扫描电镜(SEM, SIGMA 500型,德国卡尔蔡司公司)表征其形貌和成分。
2.3 试验方法及工艺流程
熔盐氯化和铝粉除钒精制的工艺流程示意图参见图1,其中氯化钠与回用盐的配加比例为9∶1。
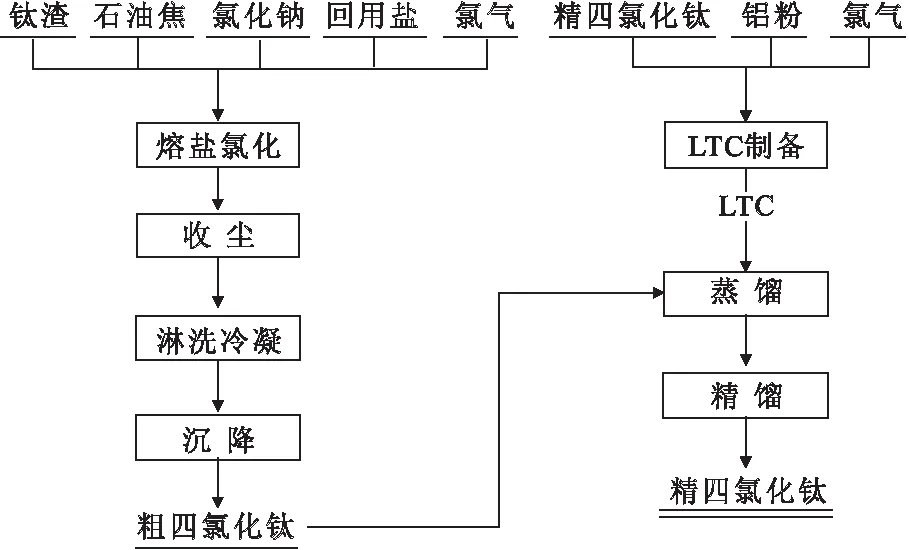
图1 熔盐氯化和铝粉除钒精制的工艺流程示意图
3 实验结果与讨论
3.1 回用盐的检测分析
将回用盐放入水中搅拌溶解,基本无固相沉淀物,说明回用盐中大部分组分为水溶性物质。
为了考察回用盐中成分,采用ICP做全面检测分析,检测数据如表2所示。
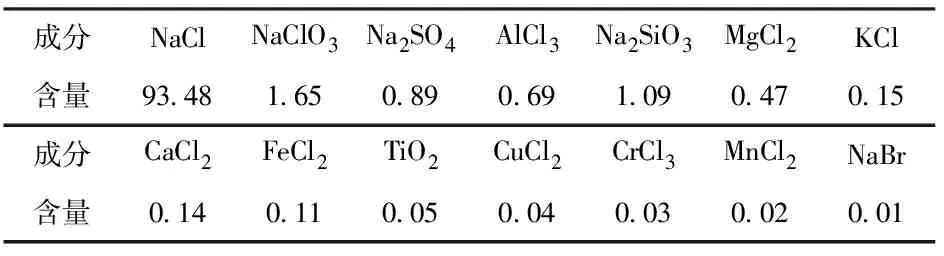
表2 回用盐成分 %
通过对表2数据分析可知,回用盐中的主要杂质为Na2SO4、AlCl3、SiO2、MgCl2、KCl、CaCl2和FeCl2。主要杂质中的Na2SO4可能是石油焦中的S经过氯化生成SO2,随尾气进入尾气处理系统,在碱洗过程中与NaOH反应生成Na2SO3,再被H2O2氧化还原为Na2SO4。其它杂质主要来自于熔盐氯化炉中的升华物,随尾气进入尾气处理系统,被水洗和碱洗液淋洗后进入盐酸和废盐水中。
采用红外光谱对回用盐和纯NaCl对比检测分析,结果见图2。由图2分析可见,相比纯NaCl,回用盐中存在明显的Na2SO4和NaClO3红外特征峰,但在波数1384.01 cm-1位置存在位置峰,表明仍存在其他物质。
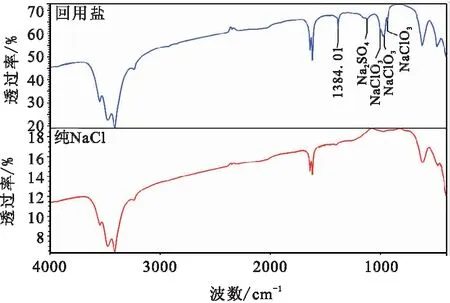
图2 回用盐红外光谱图
为进一步确定回用盐组分,对回用盐进行XRD分析,结果见图3。由图3分析可知,回用盐中除了红外光谱中的NaCl、Na2SO4和NaClO3外,还存在Na2S2O4。
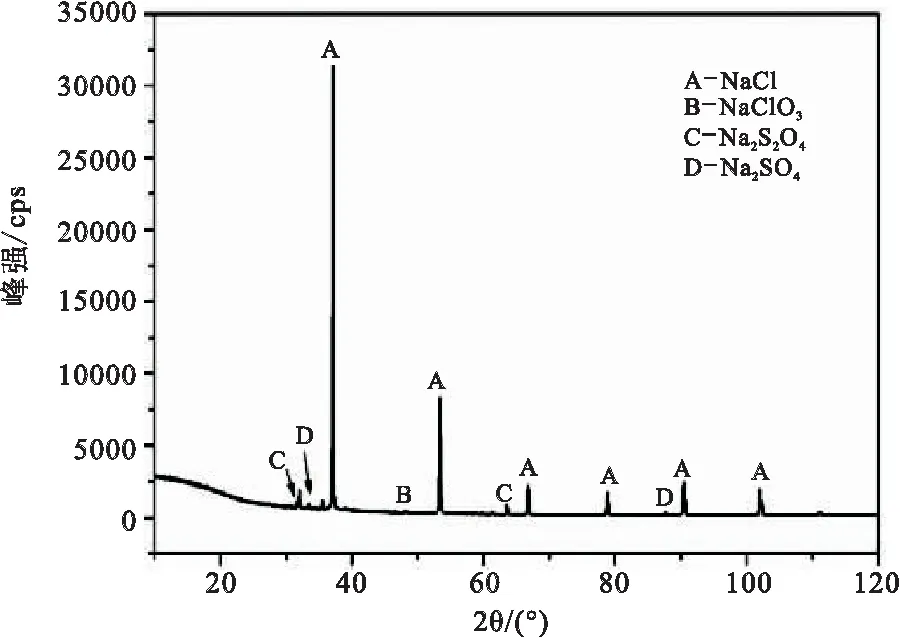
图3 回用盐固相物做XRD物相的检测结果
使用扫描电镜对回用盐形貌和成分进行表征,形貌及EDS结果分别见图4和表3。

图4 回用盐的SEM形貌
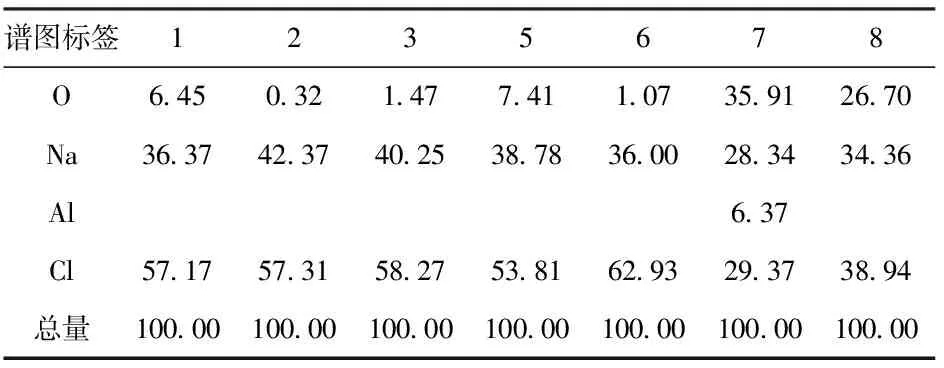
表3 图4中回用盐的EDS结果 %
由图4分析可知,回用盐的晶粒呈立方体形状,但颗粒间粒径大小不一,最大晶粒长度约为0.4 mm,EDS结果显示这些颗粒主要有O、Cl和Na元素组成,结合XRD结果分析其可能为NaCl和NaClO3,未发现Na2SO4和Na2S2O4,说明这两种物质并未富集在NaCl及NaClO3表面,可能以单独的夹杂形式存在。
3.2 回用盐中杂质在熔盐氯化过程的行为研究
结合上述分析结果,回用盐中的主要杂质在熔盐氯化炉内容易参与反应的组分可能包括:Na2SO4、NaClO3和Na2S2O4,由于尚不能准确定量分析,此处不做详细论述。Na2SO4在氯化炉内可能会参与的反应如下。
2Na2SO4(s)+2C(s)+2Cl2(g)=4NaCl(s)+2SO2(g)+2CO2(g)
(3)
Na2SO4(s)+C(s)+2Cl2(g)=2NaCl(s)+SO2Cl2(g)+CO2(g)
(4)
Na2SO4(s)+1.5C(s)+2Cl2(g)=2NaCl(s)+SOCl2(g)+1.5CO2(g)
(5)
Na2SO4(s)+2C(s)+2Cl2(g)=2NaCl(s)+SCl2(g)+2CO2(g)
(6)
4/3Na2SO4(s)+8/3C(s)+2Cl2(g)=8/3NaCl(s)+2/3S2Cl2(g)+8/3CO2(g)
(7)
2Na2SO4(s)+5C(s)+2Cl2(g)=4NaCl(s)+CS2(g)+4CO2(g)
(8)
在700~800 ℃范围内,对上述反应式(3)~(8)中的ΔGθ进行计算,计算结果见图5。
由图5分析可知,在700~800 ℃的氯化温度下,Na2SO4在与氯气加碳氯化条件下可能生成SO2、SO2Cl2、SOCl2、SCl2、S2Cl2和CS2等多种硫化物,其物理性质和在PTT中的颜色如表4所示。
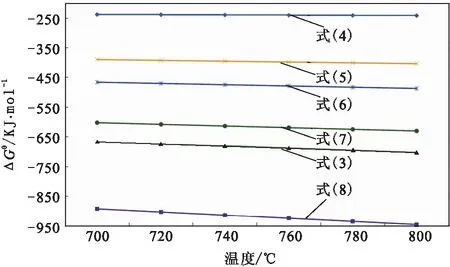
图5 Na2SO4加碳氯化反应的ΔGθ-T关系图
从表4分析可知,上述6种硫化物在常温下均易溶于TiCl4[8],尤其是除SO2以外的其它5种物质均能与TiCl4无限互溶,说明这些生成的硫化物会随CTT进入后续的精制系统。
NaClO3在氯化炉内会被加热分解为NaCl和O2,分解反应见式(9)。
NaClO3(s)=NaCl(s)+1.5O2(g)↑
(9)
分解产生的O2会与熔盐中的石油焦进行燃烧反应,增加石油焦的消耗,同时O2随炉气进入后续收尘室中,在300~400℃温度范围内,会与炉气中夹带的FeCl3反应生成颗粒极细的FeOCl,反应见式(10)。
2FeCl3(s)+O2(g)=2FeOCl(s)+2Cl2(g)
(10)
FeOCl杂质进入沉降系统后在TiCl4中呈现明显的悬浮状态和红棕色,难以通过物理沉降方式从TiCl4中分离去除。
3.3 回用盐氯化杂质对精制除钒和除铝的影响研究
在表4的6种硫化物中,SO2与CS2的沸点和TiCl4的差异较大,分离系数α≫1,容易通过精馏塔分离进入低沸点杂质(简称“LBD”)和尾气中除去。S2Cl2的沸点和TiCl4的基本相同,分离系数α=1.0,无法通过精馏的方式去除,几乎全部会进入到PTT产品中,进而在后续海绵钛生产中进入海绵钛产品中,影响产品质量。
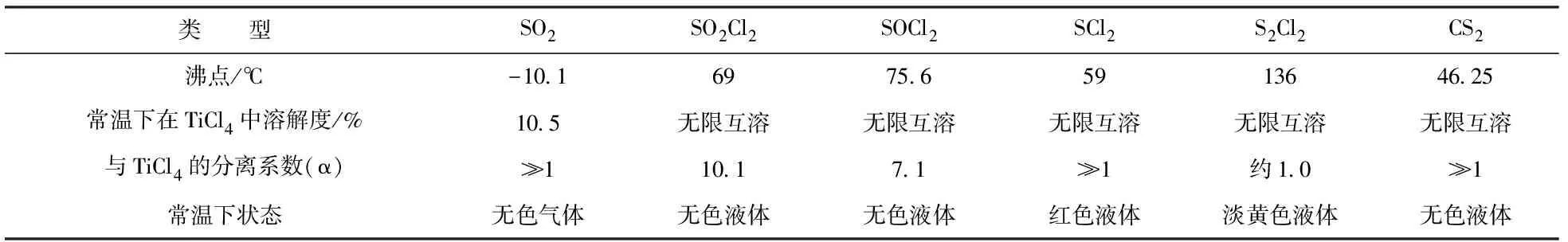
表4 硫化物的性质
SO2Cl2、SOCl2和SCl2会随CTT进入蒸馏除钒过程中,在蒸馏釜内会与LTC中的TiCl3参与反应,容易造成蒸馏液中的VOCl3含量超标,导致精制系统LTC消耗量大幅增加,铝粉单耗增高,排渣量增大,钛收率降低。SO2Cl2、SOCl2、SCl2与TiCl3发生的反应如式(11)~式(14)所示。
1/2SO2Cl2(g)+TiCl3(s)=3/4TiCl4(l)+1/2SOCl2(g)+1/4TiO2(s)
(11)
1/5SO2Cl2(g)+TiCl3(s)=4/5TiCl4(l)+1/10S2Cl2(l)+1/5TiO2(s)
(12)
SCl2(g)+TiCl3(s)=TiCl4(l)+1/2S2Cl2(l)
(13)
1/3SOCl2(g)+TiCl3(s)=5/6TiCl4(l)+1/6S2Cl2(l)+1/6TiO2(s)
(14)
蒸馏釜内的温度为10~150 ℃,在此范围内对上述反应(11)~(14)以及反应(2)中的ΔGθ进行计算,计算结果见图6。

图6 VOCl3、硫化物与TiCl3反应的ΔGθ-T关系图
从图6分析可知,SO2Cl2、SOCl2、SCl2与TiCl3反应的ΔGθ均为负值,且比VOCl3与TiCl3反应的ΔGθ小,说明CTT中的SO2Cl2、SOCl2和SCl2均有可能优先VOCl3与TiCl3发生反应。
在实际试验过程中,对CTT除钒后,蒸馏液颜色呈现黄绿色,蒸馏液中的AlCl3含量出现超标,而降低除钒试剂LTC配加比例后,AlCl3含量下降,但VOCl3含量超标,检测指标如表5所示。
查阅相关文献[9-10]显示:SOCl2在红外光谱的1238 cm-1波数下具有明显的震动响应,而SO2Cl2则在1422 cm-1波数下具有响应。对蒸馏除钒后的TiCl4和精馏除低沸点杂质后的回流液(LBD)进行测定,结果见图7。由图7分析表明:蒸馏除钒初品中具有明显的CS2、SO2Cl2和SOCl2物质,且峰强较高,说明这些物质浓度较大,经过精馏除低沸点杂质后,LBD中含有CS2,但SO2Cl2和SOCl2物质的峰消失,说明通过精馏可有效去除一定量的CS2,SO2Cl2和SOCl2物质未进入LBD中可能是由于其发生歧化反应转化为其它硫化物。
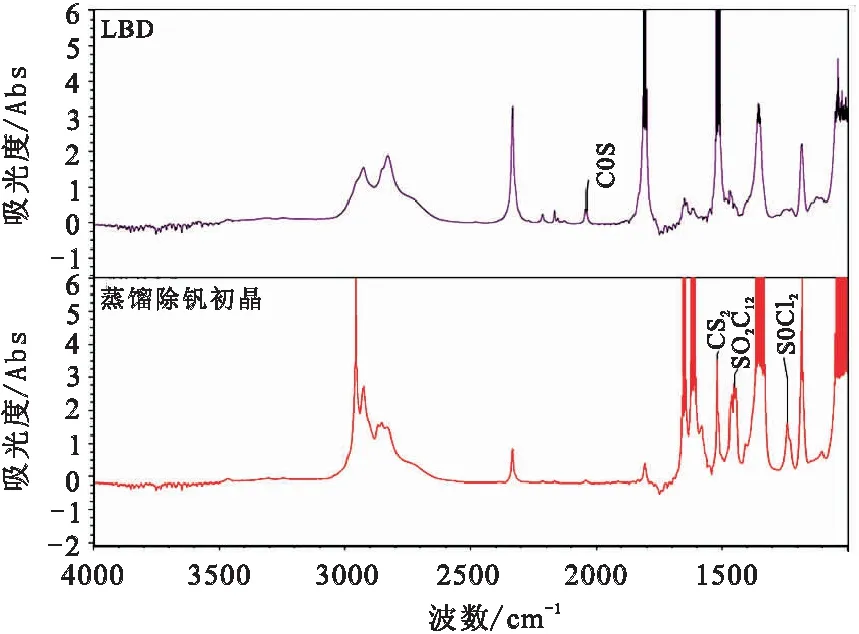
图7 蒸馏除钒和精馏除低沸点回流液红外光谱检测图
结合上述分析推测,造成蒸馏除钒后回流液中AlCl3难以稳定控制的原因可能是:制备LTC时,TiCl3和AlCl3共同晶化,生成无规则组成的化合物(TiCl3的分子数由1至3),当SO2Cl2、SOCl2、SCl2与LTC中的TiCl3反应时,与TiCl3络合的AlCl3分子就容易解离为游离态,会使蒸馏釜液中的AlCl3浓度高达3%以上,在蒸馏釜内136~150 ℃和10~50 kPa的条件下,AlCl3与TiCl4的分离系数并不算很高(约为4),蒸馏釜液中的AlCl3容易随TiCl4蒸汽进入到蒸馏塔内,经过冷凝后进入TiCl4产品中,造成产品中AlCl3含量超标。
此外,袁新华等分析提出[11],Al原子的价电子轨道(2s和2p)数为4,而其价电子仅为3个,其与Cl原子形成的AlCl3为缺电子化合物,成键电子对数少于价电子轨道数。由于有空的价键轨道存在,所以AlCl3有很强的接受电子对的能力,可以与CS2中S原子络合得到碳正离子或氮正离子,从而发生碳正离子亲电取代反应,参见式(15)。
(15)
还有相关文献[12]显示,在含有AlCl3的体系中,SOCl2与AlCl3存在下式的可逆反应。
SOCl2+AlCl3=Cl3Al(←OSCl2)
(16)
由于SOCl2沸点较低,当其与AlCl3络合后,会增大AlCl3与TiCl4分离难度,当SOCl2含量较高时,也会严重影响蒸馏除AlCl3的效果。
4 结 论
(1)回用盐主要成分为NaCl,并含Na2SO4、NaClO3和Na2S2O4等杂质,其中Na2SO4和Na2S2O4可能以单独的夹杂形式存在。
(2)热力学计算表明,以700~800 ℃的熔盐氯化温度下,Na2SO4在与氯气加碳氯化的条件下可能生成SO2、SO2Cl2、SOCl2、SCl2、S2Cl2和CS2等多种硫化物产物,在常温下均容易溶解在TiCl4中。
(3)溶于CTT中的SO2Cl2、SOCl2和SCl2在蒸馏釜内会与LTC中的TiCl3参与反应,容易造成蒸馏液中的VOCl3和AlCl3含量超标,导致铝粉单耗增高,钛收率降低,PTT产品质量下降。因此,回用盐不适合用于熔盐氯化生产TiCl4。

