高通量测序技术研究附子理中丸对脾阳虚IBS-D大鼠肠道菌群的影响
林夏,黄友,杨莎莎,魏馨怡,傅超美,李锐,张臻
(西南特色中药资源国家重点实验室,成都中医药大学药学院,四川 成都 611137)
《灵枢》云:“邪在脾胃,则病肌痛。阳气有余,阴气不足,则热中善饥;阳气不足,阴气有余,则寒中肠鸣腹痛。”[1]《素问》曰:“清气在下,则生飧泄。”[2]故脾胃虚弱,中阳不健,脾运化升清功能失司,水谷糟粕混杂而下,则致泄泻。由于现代环境、生活方式、工作节奏的改变,劳倦过度、饮食失节、过食生冷辛辣等现象常见,致使胃肠道疾病在现代疾病谱中占据极其重要的地位。目前最常见的功能性胃肠病是腹泻型肠易激综合征(Diarrhea-predominant irritable bowel syndrome,IBS-D),其以反复发作的腹痛、腹泻、大便溏薄为临床主要表现,该病属于中医泄泻范畴,主要病机为脾阳虚[3-6]。现代医学对IBS-D的发病机制并未完全明确,但大量研究表明IBS-D与肠道菌群紊乱密切相关[7-10]。
肠道菌群可以通过和宿主进行共代谢参与到机体的各项生理活动中,是机体不可缺少的一个“器官”,被称为“人体第二基因组”[11-12]。在长期进化过程中,肠道菌群与宿主形成了能相互交流物质和信息的肠道微生态,肠道微生态紊乱是各种疾病的诱发因素[13-14]。研究发现,IBS-D机体的肠道菌群密集度、多样性明显降低,具体表现有肠杆菌数量升高,乳杆菌、双歧杆菌、类杆菌数量降低[7]。
附子理中丸出自宋代《太平惠民和剂局方》,温中健脾,温肾助阳,多用于脾胃虚寒所致脘腹冷痛,呕吐泄泻,手足不温等症,是治疗脾阳虚泄泻的经典方剂[15]。近年来,附子理中丸常用于IBS-D的临床治疗,且疗效确切[16-18],然而其作用机制尚未完全明确,其对脾阳虚泄泻疾病肠道菌群的影响也未见报道。因此,本文采用高通量测序技术,研究附子理中丸对复合法诱导的脾阳虚IBS-D模型大鼠肠道菌群的影响。
1 材料
1.1 药材与试剂
附子(批号:1804038)、干姜(批号:1806012)、炒白术(批号:1803009)、甘草(批号:1807031)、党参(批号:1806128)、番泻叶(批号:1711080)均购自四川新荷花中药饮片股份有限公司,以上药材由成都中医药大学陈江副教授分别鉴定为毛茛科植物乌头AconitumcarmichaeliiDebx.的子根炮制加工品,姜科植物姜ZingiberofficinaleRosc.的干燥根茎,菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎的炮制加工品,豆科植物甘草GlycyrrhizauralensisFisch.的干燥根及根茎,桔梗科植物党参Codonopsispilosula(Franch.) Nannf.的干燥根,豆科植物狭叶番泻CassiaangustifoliaVahl的干燥小叶。羧甲基纤维素钠(CMC-Na,批号:2018022601)购自成都市科隆化学品有限公司,HiPure Soil DNA Kit B试剂盒(批号:180920,Axygen Biosciences),SOD生化试剂盒(批号:20181105)和MDA生化试剂盒(批号:20181026)均购自南京建成生物工程研究所。精炼猪油、高脂高糖饲料、普通饲料均由四川达硕生物科技有限公司提供。
1.2 仪器与设备
Agilent 2100生物分析仪(美国Agilent公司);Qubit3.0 Fluorometer(加拿大Invitrogen公司);Illumina miseq测序仪(美国Illumina公司)含MiSeq Control软件;5424R高速台式冷冻离心机(德国Eppendorf公司);QL-866微型漩涡混合仪(美国Thermo公司);HGC-12A氮吹仪(恒奥科技发展有限公司);Nanodrop 2000超微量分光光度计(美国Thermo公司);Qubit3.0 Qubit荧光计(德国Life公司);Tecan酶标仪(瑞士F200公司);Covaris M220超声波破碎仪(美国Covaris公司);7900HT荧光定量PCR测定仪(美国Thermo公司);ARSS4CN十万分之一分析天平(美国Ohaus公司);Arium mini超纯水仪(德国Sartorius公司);DZ-20半自动中药制丸机(青州市精诚医药装备制造有限公司);DL-720D超声机(上海之信仪器有限公司)。
1.3 灌胃液制备
取附子、干姜、甘草、炒白术、党参5种饮片(1∶1∶1∶1.5∶2),按照2015年版《中国药典》一部附子理中丸制法项下规定,粉碎成细粉,过筛,混匀。按比例加炼蜜,趁热混匀制成小蜜丸[19]。取适量附子理中丸置于研钵中,加入适量0.5%CMC-Na溶液,研磨成糊状,转移至100 mL容量瓶中,继续加入0.5%CMC-Na溶液研磨,如此3~4次,待附子理中丸转移完全后,加0.5%CMC-Na稀释至刻度,分别制备成合生药量为0.05、0.15 g/mL的混悬液。
将番泻叶浸渍于纯净水中,每100 mL含生药量100 g,于70 ℃恒温水浴锅浸渍过夜,滤过,滤液置4 ℃冰箱保存备用。
1.4 实验动物及分组
60只SD大鼠(250±20)g,SPF级,雄性,由四川达硕生物科技有限公司提供,实验动物许可证号:SCXK(川)2015-030。将60只大鼠随机分为空白组,模型组,附子理中丸低、高剂量组,每组15只。于室温20~25 ℃,相对湿度65%~69%环境下适应性饲养1周,期间自由进食进水。本文涉及的动物实验研究获得成都中医药大学实验动物伦理委员会批准(批准号:2014DL-024)。
2 方法
2.1 造模与给药
按照复合因素法“饮食失节+劳倦过度+番泻叶灌胃”建立病证结合的大鼠脾阳虚IBS-D模型[20-22]:第一阶段(第1~6天),单日喂饲甘蓝10 g/只,双日喂高脂混合饲料10 g/只;每日下午,38 ℃温水中游泳至疲劳(疲劳的标准为全身下沉至没颈,不能坚持游泳)。第二阶段(第7~21天),在第一阶段施加因素的基础上,每日加灌番泻叶水浸液10 mL/kg。每日称量并记录各组大鼠体质量。在造模第21天,每组随机选择6只大鼠,眼眶取血,进行MDA、SOD指标检测[23-25],同时结合腹泻症状、体征与行为改变情况[26],发现造模大鼠出现大便稀溏,体质量明显下降、喜扎堆、食欲不振、毛稀疏枯槁无光泽、游泳时间明显缩短、肛门周围污浊等现象,则可判定造模已成功。
造模成功后,模型组,附子理中丸低、高剂量组仍按复合因素法继续造模。空白组、模型组每日于造模后5 h灌胃等量生理盐水,附子理中丸低、高剂量组每日分别灌胃0.5、1.5 g/kg附子理中丸混悬液,各组连续灌胃给药3周。
2.2 样品采集与制备
42 d实验结束后,将大鼠处死,迅速取出直肠中内容物至对应编号的无菌冻存管中,置-80 ℃冰箱冻存,待测。
2.3 DNA提取与PCR扩增
根据HiPure Soil DNA Kit B试剂盒说明书进行总DNA提取,PCR扩增细菌16S rRNA基因的V3~V4可变区(扩增条件:94 ℃解链3 min,94 ℃ 5 s,57 ℃ 90 s,72 ℃ 10 s,24个循环,72 ℃终延伸5 min),采用引物5'-CCTACGGRRBGCASCAGKVRGAAT-3'和5'-GGACTACNVGGGTWTCTAATCC-3'。PCR扩增产物用1.5%琼脂糖凝胶电泳检测进行扩增结果鉴定,根据Illumina MiSeq平台标准操作规程构建文库。使用Agilent 2100生物分析仪检测文库质量,Qubit 3.0 Fluorometer检测文库浓度,将文库定量到10 nmol/L,Illumina MiSeq测序仪进行PE250/FE300双端测序,MiSeq Control Software读取序列信息。
2.4 生物信息学分析
质量过滤,去除嵌合体序列的有效序列用Vsearch(1.9.6)软件聚类生成操作分类单元(OTU),相似度为97%。参考数据库Silva 132 16S rRNA database(http://www.arb-silva.de/)比对16S rRNA,用RDP classifier对代表性序列进行物种分类学分析。随机抽样进行α多样性指数分析,作出稀释曲线。用R语言软件进行PCoA分析,基于Brary-Curtis距离矩阵,提取数据中最“主要”的元素和结构,对一系列的特征值和特征向量进行排序,选择排在前几位的特征值,做主坐标图,可视化展示样本β多样性。LEfSe采用LEfSE在线分析工具(http://huttenhower.sph.harvard.edu/galaxy/root?tool_id=lefse_uploa)揭示基因组特征,识别高维生物标识,筛选差异物种(LDA>3)。
2.5 统计学方法

3 结果
3.1 脾阳虚IBS-D模型的建立
造模21 d后,在体征与行为表现方面,所有造模大鼠均存在体质量明显下降,食欲不振,喜扎堆,蜷伏懒动,毛稀疏枯槁无光泽,游泳时间明显缩短,大便稀溏,肛门周围污浊等现象,初步判定造模成功。测定MDA含量和SOD活力,如表1所示,造模大鼠(模型组和附子理中丸给药组)较空白大鼠MDA含量显著升高(P<0.05),SOD活性显著降低(P<0.05),综合判断造模已成功。
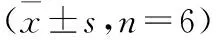
表1 造模后各组大鼠MDA含量和SOD活力比较
3.2 样本量合理性考察
如图1所示,稀释曲线和物种累积曲线结果显示各样本的有效序列(>40 000)和总的样本数量(40)都能使菌群得到有效的检测和覆盖。同时,所有样本的Good's coverage指数均达到99.8%以上,全部待测样本的测序覆盖率好,能代表粪便菌群中绝大部分细菌。

注:A1~A10.空白组10个样本;B1~B10.模型组10个样本;C1~C10.附子理中丸低剂量组10个样本;D1~D10.附子理中丸高剂量组10个样本图1 稀释曲线图(a)和物种累积曲线图(b)
3.3 菌群的多样性分析
采用α和β多样性分析,描述和评价菌群的整体结构。对α多样性指数进行SPSS统计分析(表2),表征菌群丰度的ACE(P<0.01)、Chao1(P<0.01)和多样性的Shannon(P<0.01)在空白组与模型组之间具有显著性差异,表明模型组的菌群丰度和多样性较空白组显著下降(P<0.01),模型组菌群整体结构发生了变化。相较于模型组,附子理中丸给药组的ACE、Chao1、Shannon指标有上升趋势,表明附子理中丸对菌群的丰度和多样性有一定的调节作用。β多样性分析中Unweighted unifrac距离矩阵热图(图2)显示空白组与模型组之间的颜色普遍较深,相异系数较大。空白组与附子理中丸低、高剂量组之间也有较深色块,但少于空白组与模型组之间,提示脾阳虚IBS-D造成了较大的菌群差异,而附子理中丸的干预有助于减少这种差异。

表2 α多样性指数统计分析结果表

根据信息的提取和特征值的排列,PCoA主坐标分析结果中第一主坐标(PC1)、第二主坐标(PC2)和第三主坐标(PC3)的贡献率分别为28.31%、11.62%、9.98%。图2中样品点距离的远近代表了样品中功能分类分布的相似性,距离越近,相似度越高。4个组组内聚集性良好,同组样本内部菌群结构的相似性明显。空白组和模型组之间的菌群结构有明显的差异;附子理中丸给药组呈现出明显的与模型组分离,向正常组靠近的趋势。

注:FLZP.附子理中丸;A1~A10.空白组10个样本;B1~B10.模型组10个样本;C1~C10.附子理中丸低剂量组10个样本;D1~D10.附子理中丸高剂量组10个样本图2 距离矩阵热图和主坐标分析图
3.4 菌群的丰度变化
3.4.1 脾阳虚IBS-D模型大鼠的肠道菌群变化 门水平:与空白组相比,模型组的拟杆菌门(Bacteroidetes)相对丰度显著降低(P<0.05)。纲水平:模型组的拟杆菌纲(Bacteroidia)相对丰度显著降低(P<0.05)。科水平:模型组的梭菌_1(Clostridiaceae_1)相对丰度显著升高(P<0.01),Muribaculacea相对丰度显著降低(P<0.01)。属水平:模型组的狭义梭菌属(Clostridium_sensu_stricto_1)、苏黎世杆菌属(Turicibacter)、布劳特氏菌属(Blautia)、乳杆菌属(Lactobacillus)的相对丰度均显著升高(P<0.01),如图3所示。
3.4.2 附子理中丸对脾阳虚IBS-D模型大鼠肠道菌群的影响 门水平:与模型组比较,附子理中丸给药组的拟杆菌门(Bacteroidetes)相对丰度显著增高(P<0.05,P<0.01)。纲水平:附子理中丸给药组的拟杆菌纲(Bacteroidia)相对丰度显著升高(P<0.05,P<0.01)。科水平:附子理中丸给药组的梭菌_1(Clostridiaceae_1)相对丰度显著降低(P<0.01),Muribaculacea相对丰度显著升高(P<0.05)。属水平:附子理中丸给药组的狭义梭菌属(Clostridium_sensu_stricto_1)、苏黎世杆菌属(Turicibacter)、布劳特氏菌属(Blautia)的相对丰度均显著降低(P<0.01)。附子理中丸给药组的乳杆菌属(Lactobacillus)相对丰度均出现升高,其中附子理中丸高剂量组出现显著升高(P<0.05),如图3所示。
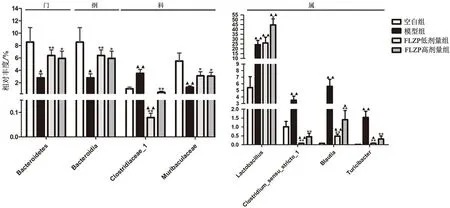
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,▲P<0.05,▲▲P<0.01;FLZP.附子理中丸。
3.4.3 差异菌群筛选 LEfSe分析结果显示,附子理中丸可以回调脾阳虚IBS-D紊乱的肠道菌群。拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)、Muribaculaceae、梭菌科(Clostridiaceae)、狭义梭菌属(Clostridium_sensu_stricto_1)、苏黎世杆菌属(Turicibacter)、布劳特氏菌属(Blautia)共7个肠道菌群类群在附子理中丸低、高剂量组均出现相同回调趋势,如表3和图4所示。附子理中丸高剂量组进一步提高了乳杆菌属(Lactobacillus)的相对丰度,如图4所示。

表3 标识性菌群分析结果表(n=10)

注:a.进化分支图;b.LDA值分布柱状图。n=10。
4 讨论
相比于正常的机体,拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)、Muribaculaceae、梭菌科(Clostridiaceae)、狭义梭菌属(Clostridium_sensu_stricto_1)、苏黎世杆菌属(Turicibacter)、布劳特氏菌属(Blautia)、乳杆菌属(Lactobacillus)在脾阳虚机体中都出现了显著性的变化,这些都可能是脾阳虚机体的特征菌群。
肠易激综合征(Irritable bowel syndrome,IBS)是临床最常见的功能性胃肠病之一,全球的发病率约为10%~20%[27]。IBS-D是IBS最主要表型之一,目前大多数学者认为IBS-D是多种因素共同作用的结果。其传统的治疗药物(如抗生素、胃肠动力调节剂、止泻剂等)常针对某一特定机制进行,无法标本兼治,且存在副作用,若用药失度易衍生新的医源性疾病。近年来,中医药治疗IBS-D取得了良好的效果[28-30]。作为治疗脾阳虚泄泻的经典方剂,附子理中丸全方由理中丸加补火助阳之附子而成,附子、干姜共用以温运中阳,驱散中寒。合白术以健脾燥湿,加党参以益气健脾,并行炙甘草以调和诸药,解其毒性兼补脾和中。故五药合用以奏温中焦,补下焦,脾肾并治,补肾火而温脾阳之效。在临床上附子理中丸被发现可以有效地提高IBS-D的治愈率[16-18]。越来越多的研究也发现,肠道菌群失调与IBS-D存在明显相关性,其机制可能是肠道菌群紊乱引起肠黏膜的过度免疫反应和持续的肠道慢性炎症,最终诱发IBS-D的发生[31]。故本研究建立大鼠脾阳虚IBS-D模型,重点选择与炎症/免疫反应密切相关的4个菌群,研究附子理中丸治疗脾阳虚IBS-D的机制。值得注意的是,脾阳虚证多由脾气虚日久累及脾阳而致,或由肾阳不足,命门火衰所致,故脾阳虚模型造模时间较长,在长期游泳致力竭以及寒凉药物泻下处理过程中,部分大鼠可能死亡,因此造模过程需要预留足够的样本量,以便后续实验的顺利开展。本实验以每组15只大鼠进行造模,在造模成功后每组选取10只进行后续给药及指标检测。
劳特氏菌属(Blautia)相对丰度与IL-6水平呈正相关性(P<0.05)[32]。如图5所示,布劳特氏菌属的变化可引起IL-6的变化,进而激活JAK-STAT信号通路,促进更多的免疫因子分泌,诱导机体的炎症及自身免疫反应。给予附子理中丸后,布劳特氏菌属相对丰度降低,可促使机体炎症反应得到改善。苏黎世杆菌属(Turicibacter)的相对丰度则与促进机体炎症反应和免疫激活的恒定自然杀伤T细胞之间存在着潜在的正相关[33-34]。给予附子理中丸后,苏黎世杆菌相对丰度的显著降低,也表明机体炎症得到改善。拟杆菌门(Bacteroidetes)作为人体及高等哺乳动物肠道内最为优势的革兰氏阴性菌之一,其死亡裂解脱落的脂多糖(LPS)与LPS结合蛋白(LBP,可作为内毒素血症的标记物)以及细胞表面的CD14分子结合后,可激活NF-κB信号通路,促进多种促炎因子的表达,导致内毒素血症,产生系统炎症[35-37]。在本研究中,LEfSe分析结果显示,在IBS-D模型组中拟杆菌门的相对丰度显著降低,给予附子理中丸后拟杆菌门的相对丰度显著升高。研究结果表明,附子理中丸可以通过回调相关菌群改善其异常紊乱状态,进而缓解脾阳虚IBS-D长期存在的过度免疫反应和持续的肠道慢性炎症。
乳杆菌属(Lactobacillus)作为机体重要的益生菌群,除了帮助机体转化营养物质外,更重要的是积极参与了机体的免疫系统[38]。一方面,乳杆菌可以通过和机体的信号交流调控免疫系统,增强机体抵抗疾病不良影响的能力,如来源于乳杆菌的P40蛋白在研究中被发现可以通过激活EGFR/NF-κB刺激肠道上皮细胞分泌APRIL,从而促进肠道抗感染抗体IgA的生成(图5)[39-41];另一方面,乳杆菌可以通过自身的增殖占位,形成生物屏障,拮抗病原微生物的定植,抑制肠道菌群的紊乱,同时使紧密连接相关蛋白重新分布,正常化肠道上皮细胞间紧密连接结构,并且抑制上皮细胞凋亡,最终协助恢复肠壁屏障的功能[38,40-41]。本文的研究结果显示,相对于空白组,脾阳虚IBS-D组乳杆菌属的相对丰度显著增加,一方面推测可能是因为乳杆菌作为与宿主协同互助的益生菌,当机体免疫力低下,可能发生疾病时,肠道上皮细胞和肠道淋巴组织与肠道菌群之间可能通过某种通路,进行信息传递与交换[41],乳杆菌数量通过机体的自我保护代偿性机制而受到调节并增多,进而促进机体恢复正常;另一方面,可能是因为模型组大鼠脾的运化功能受损,肠道菌群可利用的营养物质减少,乳杆菌属这一优势菌种能通过其优势生长,竞争性争夺潜在致病菌的营养,抑制肠道菌群的紊乱。给予附子理中丸后乳杆菌属的相对丰度进一步增长,推测可能是由于附子理中丸促进了脾的功能恢复,进而协助了机体内共生菌的增长,而共生菌的繁殖,进一步可持续参与肠道黏膜修复、免疫应答等一系列生理调节过程。
本研究结果表明,影响和调控肠道菌群是附子理中丸治疗IBS-D的重要机制之一,其通过增加乳杆菌和拟杆菌相对丰度,降低苏黎世杆菌和布劳特氏菌相对丰度,来改善机体的肠道微生态失衡状态,从而产生降低机体的低度炎症和减少免疫的过度激活等作用,进而发挥治疗IBS-D的作用。同时,从肠道菌群角度出发,目前也将益生菌疗法作为治疗IBS-D的有效方法[42-44]。有临床研究发现益生菌联合附子理中丸可进一步提高IBS-D治愈率[18],一定程度上与附子理中丸可以有效地提高乳杆菌属的相对丰度有关。本论文为附子理中丸的深入研究与临床应用提供了新的参考。

注:a.机制图;b.信号通路图

