衰弱杨梅树根际土壤微生物多样性研究
汪兆,任海英,郑锡良,俞浙萍,张淑文,戚行江*
(1.西北农林科技大学 园艺学院,陕西 杨凌 712100; 2.浙江省农业科学院 园艺研究所,浙江 杭州 310021)
杨梅(MyricarubarSieb.et Zucc.)是我国重要的亚热带经济果树,果实酸甜可口,富含花青素、维生素C和多种抗氧化物质[1]。近年来,在杨梅产区发现杨梅树体衰弱现象,该现象具有危害重、地域广等特点。该症状的发生以盛产期果园为主,在发生症状当年,树体年生长量减少、叶小且颜色变浅、落叶严重,结果量增多而果实品质下降,而后症状逐年加重。病情严重的果园中树体衰弱率可达50%以上,80%左右叶片脱落,树体顶端虽有少量叶片暂存,但叶色暗绿无光泽;在后期,根系出现腐烂,经过2~4 a树体死亡。目前,衰弱现象在各杨梅产区都有不同程度的发生,梅农损失严重,由于其成因仍不明确,尚无法采取有效防控措施。
随着对微生物功能的不断了解,研究发现,微生物菌剂是调理土壤环境、减少病害发生的有效措施,而研究植物根际微生物菌群的变化则是使用微生物技术防治植物病害的前提[2]。在对根际土壤进行深入研究后,发现根际是植物-微生物-土壤相互作用、进行物质能量交换和信号传递的重要界面。唐鑫等[3]发现,土壤真菌群落结构的变化与天麻患褐腐病密切相关;丁亚茹等[4]发现,健康与易感病烟田根际土壤微生物群落组成存在差异,易感病烟田中存在较多潜在病原菌,可通过调控措施改善土壤性质及微生物群落结构,减少病原菌定殖;武华周等[5]发现,抗青枯病桑树根际土壤富集了大量类诺卡氏菌属、芽胞杆菌属、鞘氨醇单胞菌属等生防菌。在农业生产中,分析根际微生物多样性以及微生物群落结构特征有利于深入研究和有效防治植物病害。目前,高通量测序技术被广泛应用于微生物群落结构的研究[6-8]。本研究采用微生物群落测序技术,对不同地区树势衰弱与健康杨梅的根际土壤样品进行分析,研究根际微生物群落结构和多样性,为探究杨梅树势衰弱成因及根际功能菌株的筛选提供理论依据。
1 材料与方法
1.1 果树样品的收集和指标测定
2016年7月选取树势衰弱严重的浙江省临海市弘宝杨梅园、仙居县西炉村杨梅园和瑞安高楼乡杨梅基地为取样点,在各地区同一果园分别选取有代表性的3棵健康植株和衰弱植株的东、南、西、北4个方向春梢各5支,共20支嫩梢,测量其梢长、梢粗。选取30片叶子,利用SPAD-502便携式叶绿素仪测定叶绿素含量,每片叶重复测3次。4个方位各采集成熟杨梅果实50颗,随机选择5颗用电子分析天平称量其质量,同时用手持糖度计(Pocket refractometer pal-1)测定可溶性固形物含量。VC采用2-6二氯靛酚滴定法[9]进行含量测定,总糖用蒽酮比色法[10]进行含量测定,可滴定酸采用酸碱滴定法[11]进行含量测定。
1.2 土壤样品的收集和测定
每个地区各选择3棵有代表性的健康与发病杨梅树,在地面以下10~20 cm处寻找杨梅细根,每棵树选择3个土壤采样点,去除易被抖落的土壤后装于无菌自封袋中,置于装有干冰的泡沫盒中,快速运至实验室[12]。在无菌工作台中,去除根部松散的土壤,使用无菌刷子从根部收集残留土壤。将每个地区取样的健康树和衰弱树根际土壤样本等量混匀,转移至10 mL离心管,标记样本信息后经液氮速冻,置于-80 ℃冰箱保存,共计6个样品。
1.3 基因组DNA提取、PCR扩增、文库构建和上机测序
采用CTAB法提取根际土壤微生物基因组DNA,用1%琼脂糖凝胶电泳进行DNA质量检测。利用New England Biolabs公司的High-Fidelity PCR Master Mix with GC Buffer和高保真酶进行PCR扩增。16S V4区引物选择515F和806R;ITS1区引物选择ITS5-1F-F和ITS1-1F-R。PCR反应体系为DNA模板1 μL,10×Buffer 5 μL,2.5 mmol·L-1dNTPs 4 μL,Taq DNA聚合酶0.5 μL,上、下游引物各1.5 μL,无菌超纯水补至50 μL。扩增程序为94 ℃预变性5 min;94 ℃变性50 s,50~60 ℃退火50 s(根据引物设计不同的退火温度),72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min,4 ℃保存。对PCR产物进行琼脂糖凝胶电泳检测,并利用QIAGEN公司的胶回收试剂盒对目的条带进行回收。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和q-PCR定量来检测文库质量,文库合格后,使用NovaSeq6000进行上机测序。采用Qiime、Uparse、Mothur等分析软件对测序结果进行微生物多样性分析[13]。
1.4 数据分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH对每个样本的reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags);将拼接得到的Raw Tags过滤处理得到高质量的Tags数据(Clean Tags)。参照Qiime的Tags质量控制流程,进行Tags截取和Tags长度过滤得到Tags,再进行去除嵌合体序列的处理,将Tags序列与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。
利用Uparse软件对所有样本的全部Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs,同时会选取OTUs的代表性序列,依据其算法原则,筛选OTUs中出现频数最高的序列作为代表序列。对OTUs序列进行物种注释,用Mothur方法与SILVA132的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在界、门、纲、目、科、属、种各个分类水平统计各样本的群落组成。使用MUSCLE软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后以样本中数据量最少的为标准进行均一化处理。
使用Qiime软件计算Observed-otus、Chao1、Shannon、Simpson、ACE、Goods-coverage指数。真菌的功能预测用FunGuild真菌环境功能数据库,查询文献中已有的物种在环境中的生态功能;细菌的功能预测用FAPROTAX原核生物环境功能数据库,基于扩增子物种注释结果,对数据库进行查询,获得已有文献支持的物种的环境功能信息。
2 结果与分析
2.1 健康与衰弱杨梅树体表型和果实品质
本研究对3个杨梅产地健康和衰弱树的叶片、枝条和果实的表型进行测定(表1)。在树体生长上,3个产地衰弱树的叶绿素含量、梢长、梢粗均低于健康杨梅树,其中叶绿素含量、梢长和梢粗的变化率依次为2.08%~11.10%、6.34%~35.59%和12.36%~16.96%(变化率=(衰弱样品数值-健康样品数值)/健康样品数值×100%)。仙居地区衰弱树叶绿素含量、梢长、梢粗的变化率最大。3个产地衰弱树的单果重、总糖、VC含量均低于健康树,其中单果重、总糖和VC含量的变化率依次为1.51%~9.89%、2.64%~6.48%和5.95%~8.59%;衰弱树果实的可溶性固形物含量低于健康树,临海地区降低3.09%,瑞安地区降低7.98%;衰弱树果实的可滴定酸含量均高于健康树。
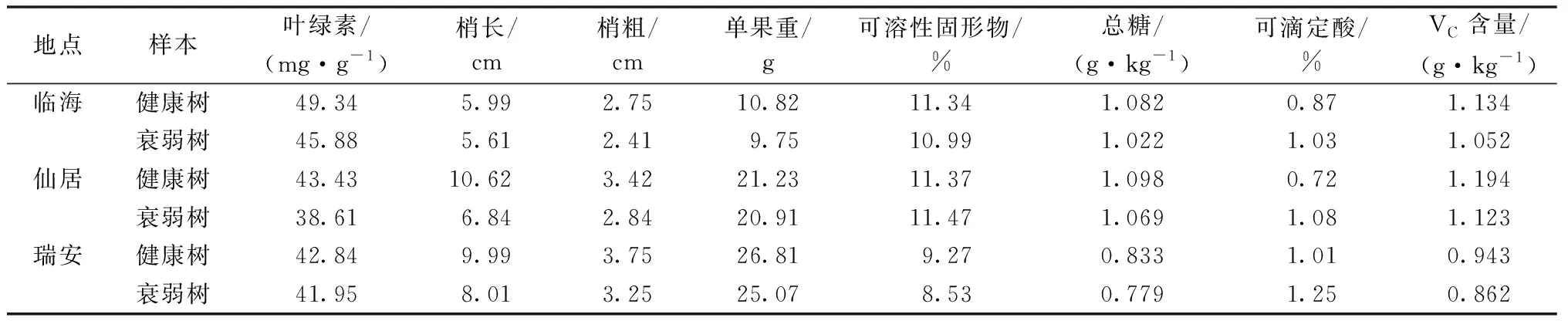
表1 健康和衰弱杨梅的表型和品质分析
2.2 杨梅根际土壤微生物α多样性分析
本研究对3个产地健康和衰弱树的根际土壤微生物进行了α多样性分析(表2),各样品的测序深度指标(Goods-coverage)均高于0.98,表明数据准确可用于后续分析。Shannon与Simpson指数值越大,表明群落多样性越高;Chao1与ACE指数越大,表明群落丰富度越高[14]。本研究中,临海地区健康树土壤细菌和真菌的Shannon、Chao1、ACE指数高于衰弱树。仙居地区健康树土壤细菌Shannon和Simpson指数均低于衰弱树,而健康树细菌Chao1与ACE指数值均高于衰弱树,仙居地区健康树土壤真菌4种α多样性指数均高于衰弱树。瑞安地区健康树的细菌Chao1和真菌Simpson指数值高于衰弱树,其他健康树的α多样性指数值均低于该地区衰弱树土壤微生物α多样性指数值。综合3个地区的土壤微生物α多样性来看,4种α多样性指数值并未呈现出与树体健康状况相关联的规律。

表2 衰弱、健康杨梅树根际土壤细菌和真菌α多样性分析
2.3 健康与衰弱杨梅树土壤微生物丰度比较
2.3.1 门和科水平细菌丰度分析
对3个产地健康和衰弱杨梅树的根际土壤进行微生物丰度分析,在平均相对丰度最高的10种细菌门中,4种细菌门在3个产地健康与衰弱树中呈基本一致的变化趋势,这4种细菌门分别是变形菌门、酸杆菌门、疣微菌门和拟杆菌门。变形菌门在临海、仙居和瑞安地区衰弱树土壤中的相对丰度均低于健康树。酸杆菌门、疣微菌门和拟杆菌门的相对丰度在3个地区均呈现出衰弱树高于健康树的趋势(表3)。
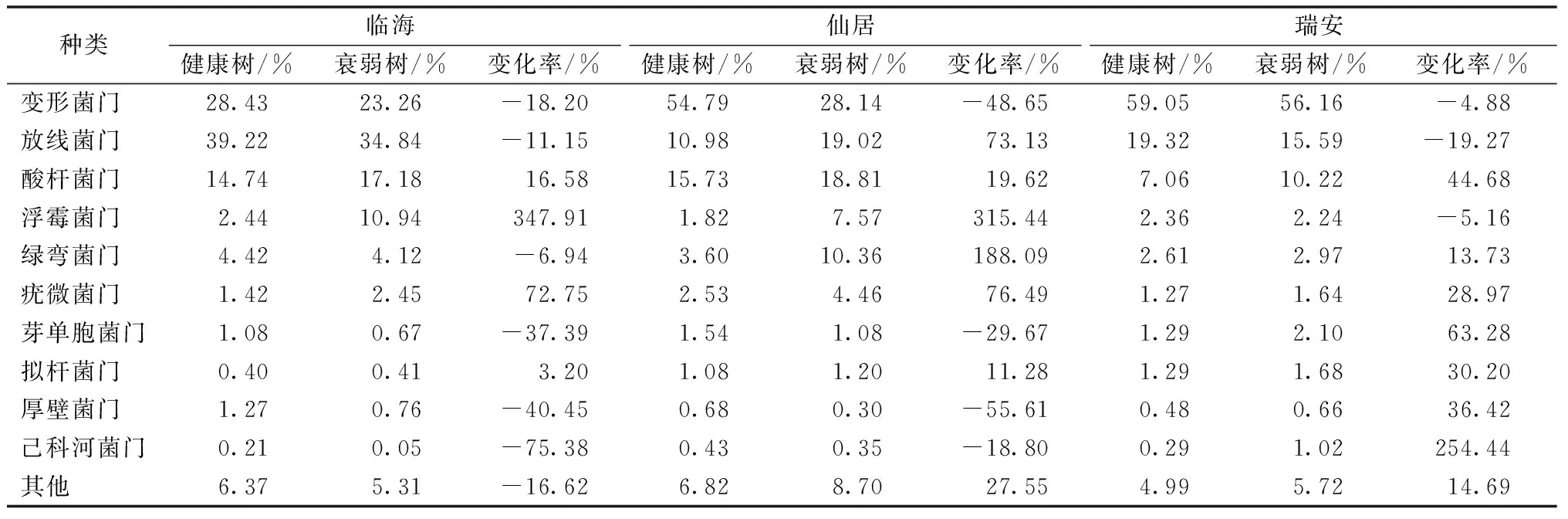
表3 门水平平均丰度最高的10类细菌相对丰度差异比较
对3个产地健康和衰弱树的根际土壤细菌在科水平进行相对丰度分析,在平均相对丰度最高的15种细菌中,3种细菌在3个产地健康与衰弱树中呈基本一致的变化趋势,其余12种细菌随着地区变化在健康与衰弱树中呈现不同的变化趋势(表4)。在临海、仙居和瑞安地区的健康树土壤中伯克氏菌的丰度分别为6.48%、23.79%和15.69%,而在对应地区衰弱树土壤中丰度分别为4.85%、2.66%和8.56%。链霉菌科在临海、仙居和瑞安的健康树土壤中丰度分别为12.68%、1.06%和4.28%,均低于相应的健康树。贝耶林克菌在健康树土壤中的相对丰度均高于衰弱树。以上结果表明,伯克氏菌、链霉菌科和贝耶林克菌等细菌在健康树土壤中的相对丰度均显著高于衰弱树(图1)。

表4 科水平平均丰度最高的10类细菌相对丰度差异比较

LHH代表临海地区健康树土样,LHD代表临海地区衰弱树土样;XJH代表仙居地区健康树土样,XJD代表仙居地区衰弱树土样;RAH代表瑞安地区健康树土样,RAD代表瑞安地区衰弱树土样。
2.3.2 门和属水平真菌相对丰度分析
对各土壤样品在门水平平均相对丰度前10的真菌进行分析,子囊菌门在6份样品中的平均相对丰度为79.18%,最高为仙居衰弱树(92.80%),最低为临海衰弱树(67.49%)(表5)。被孢霉门在3个地区的衰弱树土壤相对丰度高于健康树,该菌门在全部样品中的平均相对丰度为3.82%。在10种相对丰度最高的真菌门中,临海地区健康树土壤中未发现壶菌门、卡尔卡氏杆菌、捕虫霉门,衰弱树土壤中未发现捕虫霉门。在仙居地区,健康与衰弱树土壤中均未发现卡尔卡氏杆菌,仅在健康树土壤中发现了球囊菌门、罗兹菌门、捕虫霉门。在瑞安地区未发现球囊菌门、卡尔卡氏杆菌、捕虫霉门,仅在健康树土壤中发现了罗兹菌门,仅在衰弱树土壤中发现了壶菌门。

表5 门水平平均丰度最高的10种真菌相对丰度比较
在健康和衰弱树土壤中,属水平平均相对丰度最高的10种真菌中,6种真菌在不同地区的健康与衰弱树中呈不同变化趋势,青霉菌在3个地区都呈现健康树土壤中相对丰度高于衰弱土壤趋势(表6)。潘尼西里佛菌在3个地区的健康土样中的相对丰度均高于对应地区衰弱树土壤,此真菌属目前研究较少。多囊藻属、被孢霉属和镰刀菌属在3个地区的衰弱树土壤中的相对丰度均高于健康土样(图2)。

图2 属水平上有差异的3类细菌相对丰度

表6 属水平平均丰度最高的10种真菌相对丰度比较
2.4 细菌和真菌微生物功能预测
本研究将3个地区的衰弱树根际土壤微生物样本记为D组,健康树根际土壤微生物样本记为H组。在对细菌进行FAPROTAX功能预测后,发现衰弱杨梅根际土样中细菌与植物相关的功能为铁呼吸、纤维素水解作用、亚硝酸盐氧化、硫化合物的呼吸作用、硫酸盐呼吸、硫化合物的暗氧化等,而健康杨梅树根际土壤中细菌的功能为硝化作用、化学异养、光营养、芳香族化合物降解、芳香烃降解、硝酸盐还原、含氧光自养、碳氢化合物降解、光自养、脂肪族非甲烷烃降解、好氧化学异养、木质素分解等。
通过对真菌进行FunGuild功能预测,发现衰弱杨梅树根际土壤样品中真菌的主要功能为菌根、木材腐生菌、动物病原菌、植物病原菌等;在健康杨梅树根际土壤样品中,其功能为动物病原菌、植物病原菌、内生真菌、地衣、木腐菌、外生菌根、木材腐生菌、苔藓植物等。
由此可见,与健康树土壤微生物相比,衰弱杨梅树土壤中关于氮元素转化的细菌较少,细菌类群较少;在真菌方面,健康杨梅土壤样品相比于衰弱杨梅土样增加了地衣、苔藓等。
3 小结与讨论
本研究以3个地区的健康和衰弱杨梅树为对象,通过分析植株生长、果实品质指标和微生物多样性测序结果,发现衰弱树在树体生长和果实品质方面均差于健康树,4种α多样性指数值并未呈现出与树体健康状况相关联的规律。
植物根际微生物群落结构受病原菌和生防微生物等生物因子的影响[15-16],故对根际微生物群落进行分析,可得到与该植物相关的病原菌与生防微生物等微生物信息。对衰弱和健康杨梅根际土壤中细菌科水平的微生物相对丰度进行分析后发现,健康树的伯克氏菌、链霉菌、贝耶林克菌等有益细菌的相对丰度均高于衰弱树。伯克氏菌能产生挥发性含硫化合物从而抑制病害的发生[17]。链霉菌通过产生挥发性有机化合物,降低由真菌引起的植物病害的发病率,但同时会造成不同真菌的形态异常[18]。贝耶林克菌被研究者认为具有明显的固氮活性[19-20]。此外,纤线杆菌在衰弱土样中的相对丰度高于健康土样,但未见有文献对该菌有过详细报道。在对真菌属水平相对丰度进行分析后发现,多囊藻属、镰刀菌属和被孢霉属在3个地区衰弱土样中的相对丰度均高于健康土样。镰刀菌属能引起橡胶茎杆溃疡病[21]、马铃薯镰刀菌根腐病[22]、香蕉枯萎病[23]等病害,而被孢霉属的相对丰度在大豆、草莓和硒砂瓜连作时会出现大幅增加[24-26]。目前,关于多囊藻属的研究相对较少,在本研究中,多囊藻属在衰弱杨梅根际土壤中相对丰度较高,推测其与杨梅衰弱病的发生存在一定关联。因此,在总结3个地区的真菌和细菌微生物群落变化规律后发现,衰弱症的发生与土壤中伯克氏菌、链霉菌科和贝耶林克菌等有益细菌的减少呈现一致性规律;与土壤中多囊藻属、镰刀菌属、被孢霉属这3类真菌丰度的增加也呈现一致性规律。进一步对细菌和真菌的功能进行预测分析,发现健康杨梅树土壤中含有更多关于土壤氮元素转化的微生物,这与发现衰弱病土壤中具有固氮作用的贝耶林克菌丰度偏低的现象一致。
随着人们对微生物在农业生产中重要作用的认识不断加深,利用土壤微生物学特性来评价土壤的健康程度和质量逐渐被认可[27]。本研究从杨梅根际微生物菌群中找到了衰弱与健康杨梅的差异特征菌群,可为预测和防控杨梅衰弱病提供依据。基于本研究结论,利用多囊藻属、镰刀菌属和被孢霉属等真菌的相对丰度为预测指标,当相对丰度大幅上升则预示杨梅衰弱病的发生。同时,通过施用土壤菌剂来提高土壤中伯克氏菌、链霉菌、贝耶林克菌等细菌的丰度,或可以防控杨梅衰弱病。
本研究以浙江3个杨梅产地健康杨梅树为对照,对衰弱症状的杨梅叶片、枝条、果实性状和根际土壤微生物多样性进行了分析。结果表明:衰弱杨梅树的叶绿素含量、梢长、梢粗、单果重、总糖和VC含量均有不同程度的降低,衰弱杨梅树果实的可滴定酸含量均高于健康树;进一步对衰弱土样中细菌和真菌的相对丰度开展研究,发现在衰弱杨梅土壤中伯克氏菌、链霉菌、贝耶林克菌等细菌相对丰度降低,而镰刀菌属、被孢霉属和多囊藻属等真菌相对丰度增加,同时衰弱杨梅树土壤中关于氮元素转化的细菌类群较健康植株少。初步推测,衰弱杨梅土壤中有益菌的减少及有害菌的增加可能是造成杨梅树势衰弱的重要原因。

