过硫酸氢钾复合物粉质量研究
黎健业,梁劲康,吴志玲,雍 燕,黎乃添,温永茹,梁惠莲,张桂君
(广东温氏大华农生物科技有限公司,云浮527400)
过硫酸氢钾复合物粉主要成分包括过硫酸氢钾复合盐、氯化钠和表面活性剂等。过硫酸氢钾复合物粉在水中溶解后可经链式反应持续产生新生态氧、次氯酸和自由羟基等,可通过氧化作用使菌体蛋白质变性凝固、改变细胞膜的通透性使之破裂;同时也可作用于DNA和RNA的磷酸二酯键,干扰病原菌DNA和RNA的合成,从而杀灭目标病原菌[1-2]。过硫酸氢钾复合物粉水溶液可自然分解,对水体和土壤无污染,在动物疫病的防控中具有广阔的应用前景。在过硫酸氢钾复合物粉现行的质量标准中,规定了其性状、溶解性、pH值、氯化钠和有效氯的含量等理化指标[3],却未能为养殖临床的合理使用提供更充分的技术指导。因此,在参考《消毒技术规范》(2002年版)的基础上[4],进一步开展过硫酸氢钾复合物粉的水中溶解度、有效氯稳定性、金属腐蚀性、局部刺激性以及对目标病原微生物的杀灭效果等质量评价工作,以期为其在养殖临床中的科学使用提供一定的参考依据。
1 材料与方法
1.1 仪器 PHS-3C pH计,上海精密科学仪器有限公司;CPA225D电子天平,德国Sartorius公司;Milli-Q超纯水仪,美国Millipore公司;LDZX-75KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;LRH-250A生化培养箱,广东省韶关市鑫腾科普仪器有限公司;ZQLY-180 N振荡培养箱,上海知楚仪器有限公司。
1.2 药品与试剂 过硫酸氢钾复合物粉,批号:20190803,含有效氯不得少于10.0%,广东温氏大华农生物科技有限公司动物保健品厂提供;碳钢、不锈钢、铜和铝等标准腐蚀试片:圆形,直径24.0 mm,厚1.0 mm,穿一直径为2.0 mm 小孔,表面积总值约为9.80 cm2,购自扬州科力环保设备有限公司;碘化钾和冰乙酸均为分析纯,购自上海润捷化学试剂有限公司;硫代硫酸钠,分析纯,购自天津福晨化学试剂有限公司;营养肉汤培养基和营养琼脂培养基,均购自广东环凯微生物科技有限公司。
1.3 试验动物 6只普通级新西兰雄性长耳兔,2.0~2.5 kg,由广东温氏大华农生物科技有限公司提供(动物使用许可证号:SYXK(粤)2018-0087)。试验前先饲养5 d,试验期间自由饮水和饲喂。
1.4 试验菌株、毒株及细胞 金黄色葡萄球菌标准菌株(ATCC 6538和ATCC 29213)、大肠杆菌标准菌株(8099和ATCC 25922)、沙门氏杆菌标准菌株(ATCC 14028)以及链球菌标准菌株(ATCC 43765),均来源于中国医学细菌保藏管理中心。非洲猪瘟病毒毒株:ASFV/China/GZ201801,由国家非洲猪瘟区域实验室(广州)分离鉴定;原代猪肺泡巨噬细胞(PAMs),由华南农业大学兽医学院分离鉴定。
1.5 水中最大溶解度试验 称取10.0 g过硫酸氢钾复合物粉样品于烧杯中,加入1 L水,充分搅拌,待样品全部溶解后,继续加入1.0 g样品,重复上述操作,直至样品溶液变浑浊或烧杯底部出现不溶物,即为过硫酸氢钾复合物粉在水中的最大溶解度。
1.6 水中稳定性试验 精密称取10.0 g过硫酸氢钾复合物粉样品于1000 mL容量瓶中,加入适量水振摇使溶解并稀释至刻度,摇匀。将上述样品溶液转移至烧杯中,室温下放置,分别于第0、1、2、3、5、8、10 d取样,并按照有效氯含量测定方法的相关要求检测各样品溶液中有效氯的含量[3],计算有效氯含量的下降率。
1.7 金属腐蚀性试验 参考《消毒技术规范》(2002年版)的相关要求[4],采用浸泡法开展过硫酸氢钾复合物粉对金属的腐蚀性试验。待碳钢、不锈钢、铜和铝等标准样片进行充分清洗、干燥和恒重后,分别将其完全浸泡在浓度为5.0 g/L的过硫酸氢钾复合物粉溶液中;同时另取上述金属标准样片浸泡于相同体积的超纯水中,作为空白对照。室温下浸泡72 h后,取出各金属样片,观察其外观性状变化,并按规定进行水冲洗、去除腐蚀物、干燥和称重,计算各金属腐蚀速率。
1.8 局部刺激性试验
1.8.1 皮肤刺激性试验 参考《消毒技术规范》(2002年版)的相关要求[4],开展过硫酸氢钾复合物粉溶液对家兔的皮肤刺激性试验。在试验前24 h,用脱毛剂去除3只家兔背部脊柱两侧的毛且不得损伤皮肤,去毛范围为左、右各约3 cm×3 cm。次日将浓度为10.0 g/L的过硫酸氢钾复合物粉溶液滴到面积为2.5 cm×2.5 cm的两层纱布上,并敷贴在左侧去毛皮肤表面,用一层无刺激塑料膜覆盖,然后用无刺激胶布固定。另取等体积的生理盐水同法操作,敷贴在右侧去毛皮肤表面,作为空白对照。敷贴时间为4 h。试验结束后,用温水除去残留过硫酸氢钾复合物粉溶液。分别于去除过硫酸氢钾复合物粉溶液后1、24和48 h观察皮肤局部反应,并对其进行刺激反应评分[1,4]。
1.8.2 急性眼刺激性试验 参考《消毒技术规范》(2002年版)的相关要求[4],开展过硫酸氢钾复合物粉溶液对家兔的急性眼刺激性试验。吸取新配制浓度为10.0 g/L的过硫酸氢钾复合物粉溶液0.1 mL,滴入家兔左侧眼结膜囊内,右侧眼以生理盐水作为正常对照。滴入消毒剂溶液后,将兔眼被动闭合4 s,30 s后用生理盐水冲洗。在滴眼后24、48、72 h,肉眼观察兔眼结膜、角膜和虹膜的损伤与恢复情况,并对眼角膜、虹膜和结膜的急性刺激反应进行评分[1,4]。
1.9 细菌杀灭评价试验
1.9.1 中和剂鉴定试验 以金黄色葡萄球菌ATCC 6538和大肠杆菌8099为试验菌,按照《消毒技术规范》(2002年版)中消毒剂杀微生物试验项下中和剂鉴定试验的相关规定进行操作及结果判定[4]。
1.9.2 悬液定量杀菌试验 参考《消毒技术规范》(2002年版)的相关要求[4],分别制备金黄色葡萄球菌ATCC 6538和大肠杆菌8099菌悬液,并用0.03 mol/L PBS缓冲液(pH=7.2)稀释至3.0×107~5.0×107CFU/mL。用无菌标准硬水将过硫酸氢钾复合物粉分别配制成5.0 g/L和2.5 g/L的溶液,置于20 ℃±1 ℃水浴中备用。分别吸取0.5 mL菌悬液与4.5 mL过硫酸氢钾复合物粉溶液混匀,置于20 ℃±1 ℃水浴中作用至预定时间,立即吸取上述菌悬液1.0 mL,加入9.0 mL中和剂混匀,中和10 min后,吸取1.0 mL样液,进行活菌计数培养,计算杀菌率。对照组以无菌标准硬水代替过硫酸氢钾复合物粉溶液,同时进行上述步骤。上述试验重复3次。
1.9.3 定性杀菌试验 参考《消毒技术规范》(2002年版)的相关要求[4],分别制备金黄色葡萄球菌ATCC 29213、大肠杆菌ATCC 25922、沙门氏杆菌ATCC 14028和链球菌ATCC 43765菌悬液,并用0.03 mol/L PBS缓冲液(pH=7.2)稀释至1.0×107~1.0×109CFU/mL。用无菌标准硬水将过硫酸氢钾复合物粉分别配制成5、2.5、1.25和1.0 g/L等4个浓度的溶液,分别移取上述各浓度溶液8.0 mL于无菌试管中,然后于每管内加入1.0 mL菌悬液混匀。待作用至预定时间,立即吸取上述菌悬液1.0 mL,加入9.0 mL中和剂混匀,中和10 min后,再取出0.5 mL加入至4.5 mL营养肉汤培养基中,同时接种阳性对照,37 ℃培养24 h。若培养基管发生浑浊即表示有细菌生长;若培养基管不浑浊,继续培养至第7天,若仍不浑浊则判定为无菌生长。以无菌生长管消毒液的最低浓度为最低杀菌有效浓度。上述试验重复3次。
1.10 非洲猪瘟病毒杀灭评价试验 在农业农村部颁布的《非洲猪瘟疫情应急实施方案(2020年第二版)》中[5],推荐使用过硫酸氢钾类消毒剂,并按推荐使用的高浓度进行非洲猪瘟疫情的消毒防控。因此,本文委托了国家非洲猪瘟广州区域实验室开展过硫酸氢钾复合物粉对非洲猪瘟病毒(ASFV)的杀灭效果评价试验。
1.10.1 载体细胞毒性验证试验 用PBS溶液配制浓度为100 g/L的过硫酸氢钾复合物粉贮备溶液,进行逐级稀释后配得10.0、1.0、0.1、0.01 g/L等系列浓度的试液。同法采用含20%胎牛血清的PBS溶液配制相同系列浓度的试液。分别取上述试液与原代猪肺泡巨噬细胞(PAMs)作用2 h,然后弃去消毒剂溶液,另加细胞维持培养液,置于37 ℃二氧化碳培养箱中培养48 h,采用CCK8法测定细胞的活性,以确定消毒剂对PAMs的安全浓度范围。
1.10.2 非洲猪瘟病毒杀灭试验 为了避免消毒剂溶液影响PAMs细胞的生长,根据1.10.1项下的试验结果,将过硫酸氢钾复合物粉溶液与ASFV悬液反应后的试液稀释至安全浓度后再转移至细胞培养基中进行后续的考察试验。分别用无菌PBS溶液或含20%胎牛血清的PBS溶液将过硫酸氢钾复合物粉稀释成5.0 g/L和2.5 g/L等浓度的试液。分别将0.5 mL上述试液与0.5 mL ASFV悬液(病毒滴度为1.0×105HAD/50)混匀。待作用至预定灭活时间,将反应产物稀释100倍,稀释液接种到PAMs细胞上,孵育2 h,弃去反应产物,另加细胞维持培养液,置37 ℃二氧化碳培养箱中培养48 h。另将病毒悬液分别稀释100倍和10000倍后接种到PAMs细胞上,作为阳性对照组;将PBS溶液接种到PAMs细胞上,作为阴性对照组,同法进行培养处理。培养结束后,向上述不同处理试验组中加入猪红细胞,观察红细胞吸附现象,以判断ASFV的杀灭效果。上述活病毒操作试验均在华南农业大学动物生物安全三级实验室中进行。
2 结果与分析
2.1 水中最大溶解度试验结果 根据过硫酸氢钾复合物粉现行的质量标准,其溶解性检查项要求:0.5 g样品在50 mL水中经充分搅拌后应全部溶解[3]。本文采用的过硫酸氢钾复合物粉样品在水中的最大溶解度为60.0 g/L,为现行质量标准溶解性要求的6倍,能够满足养殖临床消毒防控的需求。
2.2 水中稳定性试验结果 由表1可知,过硫酸氢钾复合物粉水溶液在常温下放置8 d后,有效氯含量仍保持在10%左右;10 d后,有效氯含量仍保持在9.5%以上,稳定性较好。因此,过硫酸氢钾复合物粉在水中溶解后有效氯的稳定性可维持10 d左右。
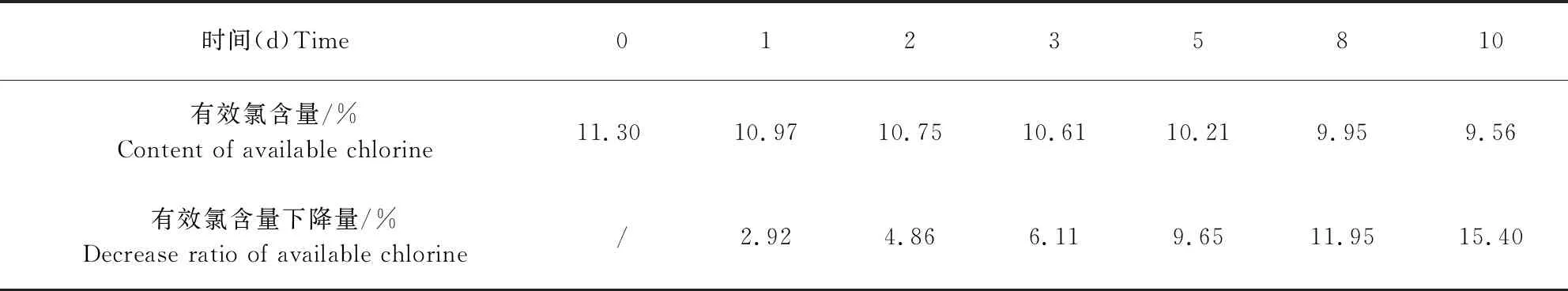
表1 过硫酸氢钾复合物粉溶液中有效氯的稳定性试验结果(n=2)Tab 1 The available chlorine stability results of potassium peroxymonosulphate solution
2.3 金属腐蚀性试验结果 由表2可知,过硫酸氢钾复合物粉溶液在常温下对不锈钢、铝、铜和碳钢等金属的腐蚀速率分别为0.0002、0.0598、0.3498和0.4515 mm/a,表明过硫酸氢钾复合物粉溶液对不锈钢基本无腐蚀作用,但是对铝具有轻度腐蚀作用以及对铜和碳钢具有中度腐蚀作用。
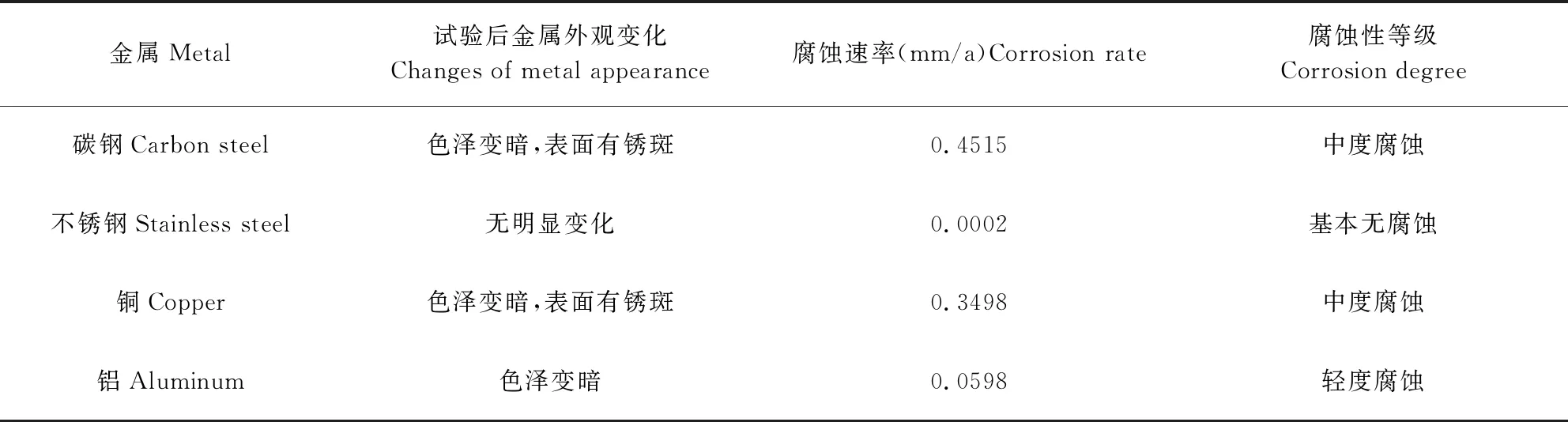
表2 过硫酸氢钾复合物粉溶液对不同金属的腐蚀性试验结果(n=2)Tab 2 Different metal corrosion results in potassium peroxymonosulphate solution
2.4 刺激性试验结果
2.4.1 皮肤刺激性试验结果 由表3可知,在试验结束1 h后,部分家兔皮肤出现了轻微的红斑症状,但24 h后红斑症状消失,皮肤恢复正常。由于在48 h观察期内,家兔的皮肤刺激指数均小于0.5,则可认为上述试验浓度的过硫酸氢钾复合物粉溶液对家兔皮肤无刺激性,与文献报道结果一致[1]。
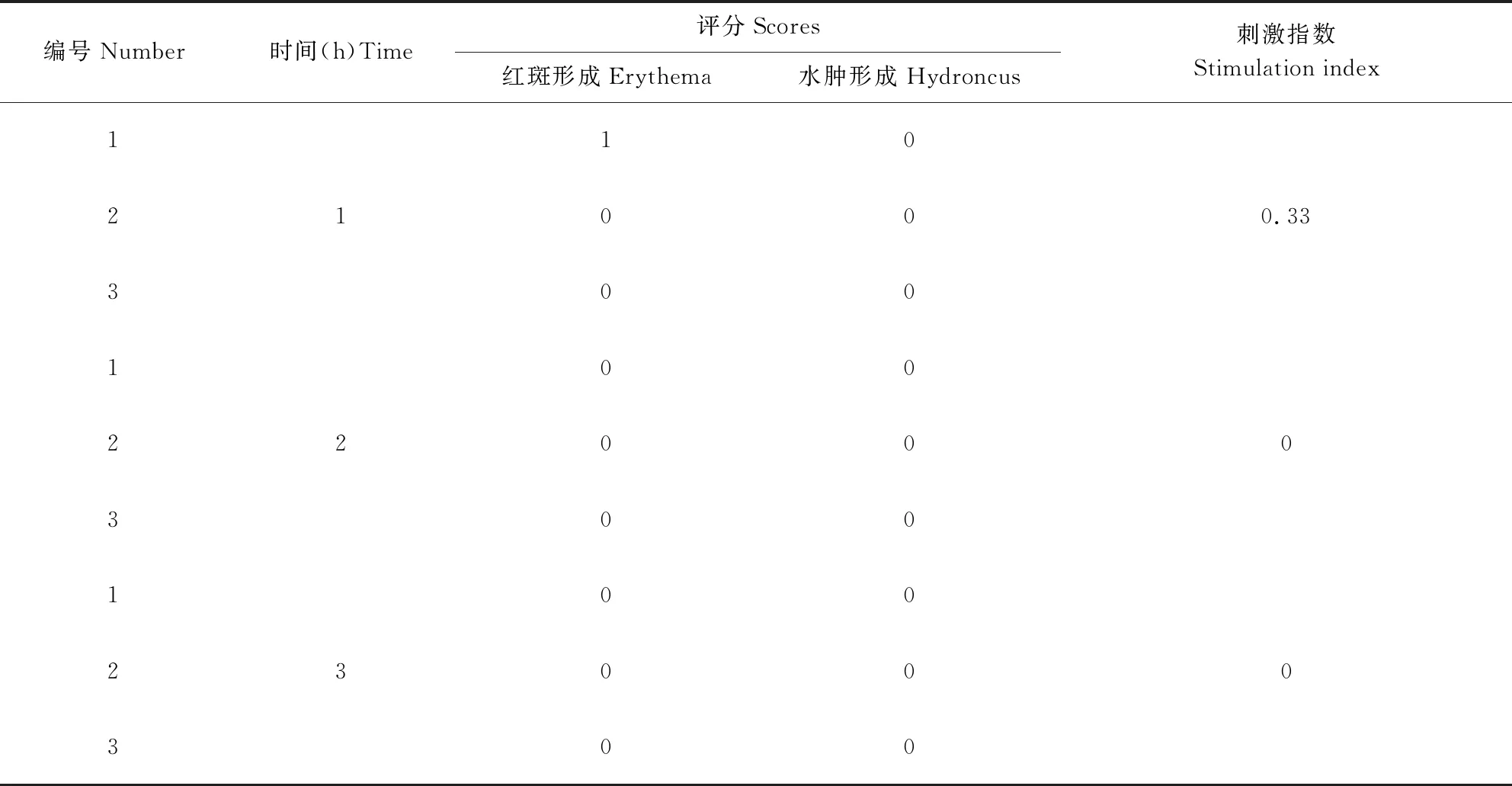
表3 家兔皮肤刺激试验结果Tab 3 Results of rabbit skin irritation test
2.4.2 急性眼刺激性试验结果 由表4可知,在试验结束24 h后,部分家兔的虹膜或者结膜出现了轻微的充血或者水肿症状,但是48 h后充血或水肿症状消失,家兔的虹膜和结膜均恢复正常。在72 h观察期内,3只家兔急性眼刺激试验的平均评分为:角膜损害<1、虹膜损害<1、结膜充血<2和结膜水肿<2。因此,可认为上述试验浓度的过硫酸氢钾复合物粉溶液对家兔眼睛无明显刺激性,与文献报道结果一致[1]。
2.5 细菌杀灭评价试验结果
2.5.1 中和剂鉴定试验结果 经验证,以含0.5%硫代硫酸钠的PBS缓冲液(pH=7.2)作为中和剂,可有效中和过硫酸氢钾复合物粉溶液对试验菌的作用,满足试验要求。
2.5.2 悬液定量杀菌试验结果 由表5可知,浓度为5.0 g/L和2.5 g/L的过硫酸氢钾复合物粉溶液与两种试验菌作用5 min后,杀灭率均达到99.99%以上,表现出较强的杀菌活性。

表5 过硫酸氢钾复合物粉悬液定量杀菌试验结果Tab 5 Suspension quantitative germicidal test results of potassium peroxymonosulphate powder
2.5.3 定性杀菌试验结果 在悬液定量杀菌试验的基础上,本文进一步通过定性杀菌试验来评价过硫酸氢钾复合物粉对金黄色葡萄球菌、大肠杆菌、沙门氏杆菌和链球菌等禽畜养殖临床中常见致病菌的杀灭活性[6]。由表6可知,浓度为1.0 g/L的过硫酸氢钾复合物粉溶液,作用5 min后可有效杀灭大肠杆菌和金黄色葡萄球菌,作用10 min后可有效杀灭沙门氏菌和链球菌。

表6 过硫酸氢钾复合物粉定性杀菌试验结果Tab 6 Qualitative germicidal test results of potassium peroxymonosulphate powder
2.6 非洲猪瘟病毒杀灭评价试验
2.6.1 载体细胞毒性试验结果 在ASFV杀灭效果评价试验中,为了避免消毒剂影响载体细胞的生长,需开展不同浓度消毒剂溶液对PAMs细胞的毒性作用。试验结果表明,当过硫酸氢钾复合物粉分别用PBS溶解稀释至0.1 g/L或者用含20%胎牛血清PBS溶解稀释至1.0 g/L时,对PAMs细胞生长无影响。因此,在开展ASFV杀灭试验中,综合消毒剂的考察浓度,宜将过硫酸氢钾复合物粉与病毒悬液反应产物进行稀释100倍后再继续后续的评价试验。
2.6.2 非洲猪瘟病毒杀灭试验结果 如图1所示,PBS阴性组未观察到红细胞吸附现象(HAD阴性);如图2所示,ASFV病毒悬液组则可观察到典型的红细胞吸附现象(HAD阳性)。根据以上判定依据得出试验结果,如表7所示,过硫酸氢钾复合物粉用PBS溶液按1∶400倍稀释后(即浓度为2.5 g/L),与5×104HAD/50的非洲猪瘟病毒作用5 min后能够完全杀灭ASFV;而用含胎牛血清的PBS溶液将过硫酸氢钾复合物粉溶解稀释至同样浓度时(胎牛血清最终含量为10%),与5×104HAD/50的非洲猪瘟病毒作用5 min后也能够完全杀灭ASFV。

图1 红细胞吸附试验阴性Fig 1 Negative result of erythrocyte adsorption test
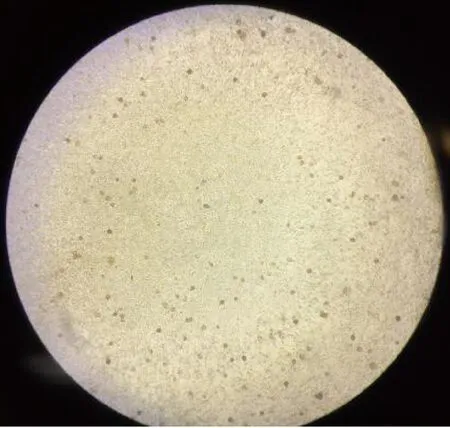
图2 红细胞吸附试验阳性Fig 2 Positive result of erythrocyte adsorption test
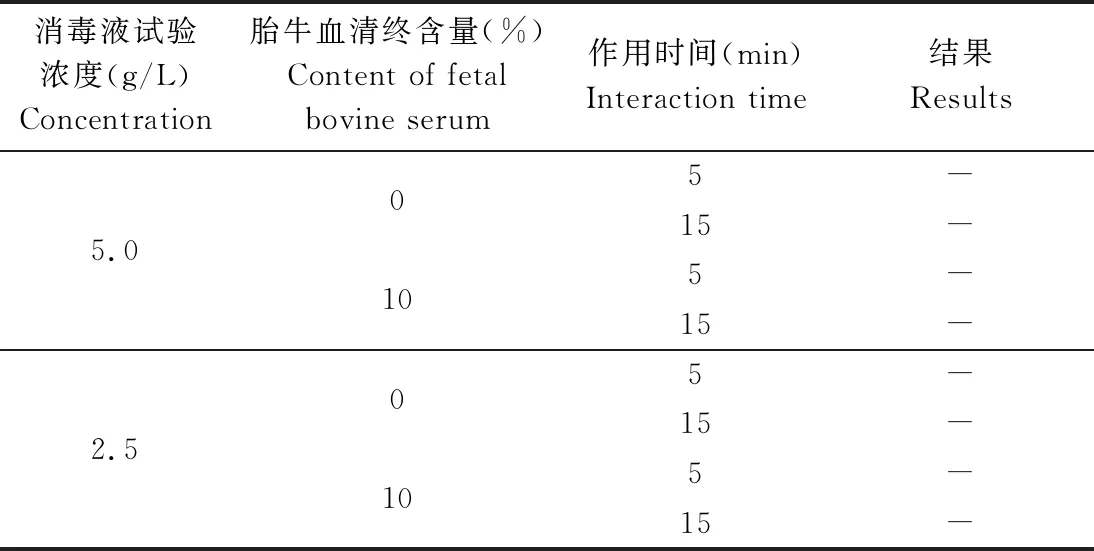
表7 过硫酸氢钾复合物粉对非洲猪瘟病毒杀灭效果试验结果Tab 7 Results of killing effect of potassium peroxymonosulphate powder on ASFV
3 讨论与结论
过硫酸氢钾复合物粉主要由过硫酸氢钾复合盐、氯化钠和表面活性剂等水溶性成分组成,因此水溶解性较好,但不同的制剂工艺会在一定程度上影响其在水中的溶解性。本文所采用的过硫酸氢钾复合物粉在水中最大溶解度可达到60 g/L(约为推荐使用最高浓度的12倍),完全能够满足养殖临床使用的需求。过硫酸氢钾复合物粉在水中溶解后,可经链式反应持续产生有效氯和活性氧等杀菌成分,这也是过硫酸氢钾复合物粉溶液中有效氯能维持稳定的主要原因。
由于过硫酸氢钾复合物粉溶液呈较强的酸性(pH为2.35~2.65),其对各类金属仍具有一定的腐蚀作用。经验证,浓度为5.0 g/L的过硫酸氢钾复合物粉溶液在常温下对不锈钢、铝、铜和碳钢的腐蚀速率分别为0.0002、0.0598、0.3498、0.4515 mm/a,但其腐蚀速率却远低于1.0 g/L单过硫酸氢钾复合盐溶液对上述金属的腐蚀速率[7]。这主要因为过硫酸氢钾复合物粉中含有一定量的缓蚀剂,能够在一定程度上降低过硫酸氢钾复合物溶液对金属的腐蚀性。为了降低消毒剂对金属容器的腐蚀作用,在实际应用时应注意及时用清水擦拭等方式去除残留的消毒液。
虽然过硫酸氢钾复合物粉对碳钢等金属具有一定的腐蚀性,但是浓度为10.0 g/L(推荐使用最高浓度的2倍)的过硫酸氢钾复合物粉溶液对家兔并未表现出明显的皮肤刺激性或眼刺激性,与文献报道结果基本一致[1]。这也进一步验证了过硫酸氢钾复合物粉的使用安全性,甚至可以应用于带畜消毒。
为了验证过硫酸氢钾复合物粉溶液对目标病原菌的杀灭活性,本文也开展了不同使用浓度以及不同作用时间对不同目标病原微生物的杀灭评价试验。依据《消毒技术规范》(2002年版)的相关要求[4],本文通过悬液定量杀菌试验验证了推荐使用最高浓度(5.0 g/L)以及稀释一倍后(2.5 g/L)的过硫酸氢钾复合物粉溶液在5 min内能够完全杀灭金黄色葡萄球菌和大肠杆菌等病原微生物。在此基础上,进一步通过定性杀菌试验验证了过硫酸氢钾复合物粉对4种禽畜养殖临床中常见致病菌的最低杀灭浓度为1.0 g/L,但对大肠杆菌和金黄色葡萄球菌最短作用时间为5 min;而对沙门氏菌和链球菌最短作用时间则为10 min。上述试验结果均表明了过硫酸氢钾复合物粉对禽畜致病菌具有较良好的杀灭活性。但是,也要注意有机干扰物、温度和水质等环境因素对其消毒效果的影响[6]。因此,在畜牧养殖临床实际应用中,宜先用水将粪便和饲料等有机残余物冲洗干净后,再使用过硫酸氢钾复合物溶液进行消毒防控。同时,也可以通过适当提高消毒剂的使用浓度、适当升高环境温度和延长作用时间等措施来提高消毒剂的杀菌效果[8-9]。
根据农业农村部颁布的《非洲猪瘟疫情应急实施方案(2020年第二版)》的相关要求[5],开展高浓度过硫酸氢钾复合物溶液对非洲猪瘟病毒的杀灭效果评价试验。结果表明,2.5 g/L(推荐使用最高浓度稀释一倍)的过硫酸氢钾复合物粉溶液能够在5 min内有效杀灭非洲猪瘟病毒,且在该作用浓度下过硫酸氢钾复合物溶液对ASFV的杀灭作用不受有机物的影响。而实际上,过硫酸氢钾复合物粉对非洲猪瘟的最低有效浓度可达到1000 mg/L,且在该浓度下作用5 min即可有效杀灭ASFV,充分表明了过硫酸氢钾复合物粉在非洲猪瘟疫情生物安全的防控中也具有广阔的应用前景[10-11]。
在过硫酸氢钾复合物粉现行国家质量标准的基础上,进一步开展了其水中溶解度、有效氯稳定性、金属腐蚀性、局部刺激性以及对目标病原微生物的杀灭效果等质量评价试验,建立了过硫酸氢钾复合物粉更全面的质量评价体系,同时也为该消毒剂的养殖临床科学使用提供了参考依据。

