肉豆蔻中二芳基丙烷类抗炎活性成分
李大山,曾天艳,马 莎,王文静,邵立东
云南中医药大学中药学院云南省南药资源可持续利用重点实验室,昆明 650500
肉豆蔻属于肉豆蔻科植物肉豆蔻(Myristicafragrans)的干燥种仁,被《中国药典》2015年版一部收录,功能与主治:温中行气,涩肠止泻,用于脾胃虚寒,久泻不止,脘腹胀痛,食少呕吐[1]。据文献报道,肉豆蔻的化学成分主要是木质素、苯并呋喃类新木质素、非苯并呋喃类新木质素[2,3],而二芳基丙烷类成分的报道比较少见[4]。肉豆蔻中的化学成分特别是酚类成分具有广泛的生物活性,目前的活性研究主要集中在抗炎[5]和抗肿瘤活性[6]两方面。除此之外,作用于中枢神经系统方面如神经保护[7]、抗焦虑[8]、抗菌[9]和治疗糖尿病[10]等方面也有相关报道。
炎症已被研究证明是自体免疫紊乱[11]和肿瘤[12]等疾病发生过程中共同的病理机制。当免疫细胞受到炎症介质等物质刺激时,会促进一氧化氮合酶(iNOS)的大量表达,释放一氧化氮(NO)引起免疫应答,因此抑制NO生成是评价化合物抗炎活性的直接指标[13]。
传统的抗炎药物环氧化酶-2(COX-2)抑制剂对心血管系统和胃粘膜存在着副作用[14],需研究开发新型抗炎药物。鉴于前期关于肉豆蔻中酚类成分的抗炎活性报道,而同为酚类的二芳基丙烷成分的研究较少[4],为了丰富其二芳基丙烷类化学成分,发现新型抗炎活性的先导化合物,本文对肉豆蔻果实丙酮提取物乙酸乙酯部位的二芳基丙烷类成分进行了分离纯化和结构鉴定,并测试了分离化合物对小鼠RAW264.7巨噬细胞的NO生成抑制活性。
1 实验部分
1.1 材料
肉豆蔻采购于昆明螺蛳湾药材市场,经云南中医药大学王文静教授鉴定为肉豆蔻(Myristicafragrans),原植物标本(20190503)现存于云南中医药大学中药学院科研实验室。
1.2 仪器与试剂
AM-500 MHz核磁共振仪(德国Bruker公司);UV-2401A紫外光谱仪(日本Shimadzu公司);Affinity-1S红外光谱仪(日本Shimadzu公司);VG Auto Spec-3000质谱仪(英国VG PRIMA公司);薄层层析硅胶GF254和柱层析硅胶(200(300目,青岛海洋化工有限公司);RP-18反相材料(40~63 μm,德国Merk公司);Sephadex LH-20(40~70 μm,瑞士Amersham Biosciences AB公司);提取和柱层析溶剂石油醚、氯仿、乙酸乙酯、丙酮、甲醇(工业级,重蒸后使用);其余试剂均为分析纯。
1.3 提取与分离
干燥的肉豆蔻果实3.0 kg,粉碎后用70%的丙酮/水溶液(10 L)室温浸泡提取3次(每次2天),提取液合并,减压蒸馏出去大部分丙酮/水得浸膏,加入2 L水,然后分别用石油醚,乙酸乙酯各萃取3次(3×2 L),减压回收萃取溶剂后得乙酸乙酯部分230 g。
乙酸乙酯部分用500 g硅胶(200~300目)拌样,1.0 kg硅胶(200~300目)进行硅胶柱层析,石油醚/丙酮(100∶0→20∶1→10∶1→5∶1→1∶1)梯度洗脱,TLC检测并合并相同的部分,得到5个组分Fr.1~5。
Fr.4(33 g)采用反相RP-18进行柱层析,MeOH/H2O(30∶70→95∶5)梯度洗脱,得到4个组分Fr.4.1~Fr.4.4。Fr.4.2(2.3 g)经Sephadex LH-20(CHCl3/MeOH,3∶2)凝胶柱层析得到3个组分Fr.4.2.1~Fr.4.2.3。Fr.4.2.2(243 mg)依次通过硅胶柱层析(石油醚/丙酮,20∶1→5∶1;氯仿/丙酮,15∶1→5∶1)得到化合物1(8 mg)、2(11 mg)和4(16 mg)。
Fr.5(26 g)采用反相RP-18进行柱层析,MeOH/H2O(20∶80→95∶5)梯度洗脱,得到4个组分Fr.5.1~Fr.5.4。Fr.5.2(1.2 g)经Sephadex LH-20(CHCl3/MeOH,3:2)凝胶柱层析得到3个组分Fr.5.2.1~Fr.5.2.3。Fr.5.2.2(122 mg)依次通过硅胶柱层析(氯仿/甲醇,20∶1→5∶1;氯仿/丙酮,10∶1→1∶1)得到化合物3(21 mg)和5(18 mg)。
1.4 NO生成抑制活性检测
采用Griess法对分离化合物1~5进行体外抗炎活性筛选,评价其抑制NO生成活性。将小鼠RAW264.7巨噬细胞接种至96孔板,用1 μg/mL LPS进行诱导刺激,同时加入待测化合物(2.5、5.0、10.0和20.0 μM)处理,设置不含药物组和L-NMMA阳性药物组做对照。细胞过夜培养后取培养基检测NO生成,在540 nm处测定吸光值,实验重复三次。在剩余培养基中加入MTS进行细胞存活率检测,排除化合物对细胞的毒性影响。NO生成抑制率=[(非药物处理组OD540nm-样品组OD540nm)/非药物处理组OD540nm]× 100%。半数抑制浓度(IC50,50% concentration of inhibition)按Reed&Muench法计算[13]。
2 结果与讨论
2.1 化合物结构解析
化合物1~5的结构如图1所示(*标示的是新化合物)。
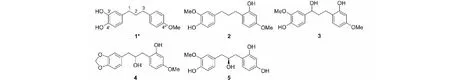
图1 肉豆蔻果实中化合物1~5的结构Fig.1 Structures of compounds 1-5 from the fruits of M.fragrans
化合物1淡黄色无定型粉末;UV(MeOH)λmax(logε)202(4.55),223(3.98)nm;IR(KBr)νmax3 371,2 932,2 848,1 608,1 511,1 450,1 370,1 286,1 238,1 180,1 111,1 029,816;1H和13C NMR见表1。结合HR-EI-MS:m/z258.125 5 [M]+(calcd for C16H18O3,258.125 6)和1H NMR、13C NMR(DEPT)谱,确定分子式为C16H18O3。红外光谱在νmax3 371cm-1有吸收,表明有羟基的存在。在其1H NMR谱(见表1)中可观察到一个ABX自旋系统6.70(1H,d,J= 2.0 Hz,H-2′),6.77(1H,d,J= 8.0 Hz,H-5′),6.61(1H,dd,J= 8.0,2.0 Hz,H-6′)和一个AA′BB′自旋系统7.09(2H,d,J= 8.7 Hz,H-2″和H-6″),6.83(2H,d,J= 8.7 Hz,H-3″和H-5″)以及1个甲氧基信号3.80(3H,s,4″-OMe)。在其13C NMR(DEPT)谱(见表1)中可观察到14个碳信号,包括10个芳基碳信号[其中δC129.4(d,C-2″和C-6″)和113.9(d,C-3″和C-5″)分别为两个碳信号的重叠,即这10个芳基碳信号共包含12个碳原子],3个亚甲基和1个甲氧基。综合以上的高分辨质谱和核磁数据分析,可以推测化合物1是二芳基丙烷类化合物。

表1 化合物1的1H(500 MHz)和13C(125 MHz)NMR的核磁数据(CDCl3)Table 1 1H (500 MHz) and 13C (125 MHz) NMR data of compound 1 (CDCl3)
通过文献查阅比较化合物1和已报道的化合物horsfielenide E(1-(3′,4′-methylenedioxyphenyl)-3-(4′′-methoxyphenyl)propane)[15]的1H NMR和13C NMR(DEPT)谱数据,可以看出化合物1和horsfielenide E具有相似的分子骨架,两者不同之处在于horsfielenide E的C-3′和C-4′位连接的是亚甲二氧基(-OCH2O-),而化合物1的C-3′和C-4′分别为酚羟基取代。
通过二维核磁1H-1H COSY、HSQC、HMBC谱对化合物的碳、氢信号进行了全归属(见表1)。在1H-1H COSY谱中(见图2),H-1/H-2,H-2/H-3的相关信号确证了C1-C2-C3的连接方式。在HMBC谱中,δH2.52(2H,t,J= 7.5 Hz,H-1)与135.8(s,C-1′),115.7(d,C-2′),121.0(d,C-6′)有相关信号,表明C-1连接在一个芳环的C-1′位上;2.57(2H,t,J= 7.5 Hz,H-3)与134.6(s,C-1″),129.4(d,C-2″和C-6″)有相关信号,表明C-3连接在另一个芳环的C-1″上。3.80(3H,s,4″-OMe)与157.8(s,C-4″)有相关信号,表明甲氧基连接在C-4″上。综上所述,化合物1的被确定为如图1所示结构,命名为1-(3′,4′-dihydroxyphenyl)-3-(4″-methoxyphenyl)-propane。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
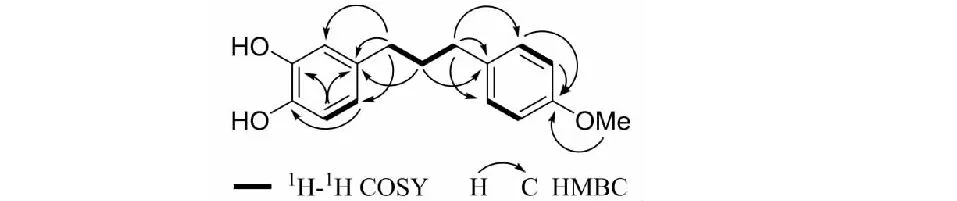
图2 化合物1关键的1H-1H COSY和HMBC相关Fig.2 Key 1H-1H COSY and HMBC correlations for 1
化合物2无色无定形粉末;1H NMR(500 MHz,CDCl3)δ:7.02(1H,d,J= 8.2 Hz,H-6″),6.83(1H,d,H-5′),6.74(1H,d,J= 1.9 Hz,H-2′),6.70(1H,dd,J= 8.0,1.9 Hz,H-6′),6.44(1H,dd,J= 8.2,2.5 Hz,H-5″),6.40(1H,d,J= 2.5 Hz,H-3″),3.88、3.75(各3H,s,3′,4″-OMe),2.75~2.51(4H,m,H-1,3),2.09~1.70(2H, m, H-2);13C NMR(125 MHz,CDCl3)δ:159.2(s,C-4″),154.6(s,C-2″),146.7(s,C-3′),144.9(s,C-4′),134.5(s,C-1′),130.7(d,C-6″),121.5(s,C-6′),120.8(d,C-1″),114.6(d,C-5′),111.4(d,C-2′),106.3(d,C-5″),102.2(d,C-3″),56.0(q,C-4″-OMe),55.3(q,C-3′-OMe),35.4(d,C-3),32.0(d,C-1),28.9(d,C-2)。以上数据与文献[16,17]报道基本一致,故鉴定化合物2为1-(4′-hydroxy-3′-methoxyphenyl)-3-(2″-hydroxy-4″-methoxyphenyl)-propane。
化合物3无色油状物;1H NMR(500 MHz,(CD3)2CO)δ:7.07(1H,d,J= 1.8 Hz,H-2′),6.97(1H,J= 8.4 Hz,H-6″),6.90(1H,dd,J= 8.1,1.8 Hz,H-6′),6.83(1H,d,J= 8.1 Hz,H-5′),6.44(1H,dd,J= 8.4,2.6 Hz,H-5″),6.38(1H,d,J= 2.5 Hz,H-3″),4.96(1H,dd,J= 10.3,2.3 Hz,H-1),3.86(3H,s,3′-OMe),3.74(3H,s,4″-OMe),2.93~2.86(1H,m,H-3a),2.70(1H,dt,J= 16.2,4.3 Hz,H-3b),2.17~2.12(1H,m,H-2a),2.05~1.98(1H,m,H-2b);13C NMR(125 MHz,(CD3)2CO)δ:160.1(s,C-4″),157.0(s,C-2″),148.3(s,C-3′),147.3(s,C-4′),134.3(s,C-1′),130.9(d,C-6″),119.7(d,C-6′),115.5(d,C-5′),114.7(s,C-1″),110.6(d,C-2′),107.7(d,C-5″),102.4(d,C-3″),78.6(d,C-1),56.3(q,C-3′-OMe),55.4(q,C-4″-OMe),30.8(t,C-3),25.1(t,C-2)。以上数据与文献[18]报道基本一致,故鉴定化合物3为horsfielenidine A。
化合物4淡黄色无定型粉末;1H NMR(500 MHz,CDCl3)δ:6.91(1H,d,J= 8.2 Hz,H-6″),6.69~6.65(3H,m,H-2′,5′,6′),6.51(1H,d,J= 1.8 Hz,H-3″),6.42(1H,dd,J= 8.2,1.8 Hz,H-5″),5.92(2H,s,H-7(-OCH2O-),4.10(1H,m,H-2),3.77(3H,s,4″-OMe),2.76~2.54(4H,m,H-1,3);13C NMR(125 MHz,CDCl3)δ:159.9(s,C-4″),156.6(s,C-2″),147.5(s,C-3′ or 4′),145.8(s,C-C-4′ or 3′),132.0(s,C-1′),131.4(d,C-6″),122.2(d,C-6′),117.3(s,C-1″),109.5(d,C-2′ or 5′),108.5(d,C-5′ or 2′),106.2(d,C-5″),102.8(d,C-3″),100.8(t,C-7′-OCH2O-),74.9(d,C-2),55.2(q,C-4″-OMe),42.9(t,C-1 or 3),38.1(t,C-3 or 1)。以上数据与文献[19]报道基本一致,故鉴定化合物4为1-(2′-hydroxy-4′-methoxyphenyl)-3-(3″,4″-methylenedioxyphenyl)-propan-2-ol。
化合物5黄色粉末;1H NMR(500 MHz,(CD3)2CO)δ:6.83(1H,d,J= 1.9 Hz,H-2′),6.80(1H,d,J= 8.2 Hz,H-6″),6.73(1H,d,J= 8.0 Hz,H-5′),6.66(1H,dd,J= 8.0,1.9 Hz,H-6′),6.34(1H,d,J= 2.4 Hz,H-3″),6.26(1H,dd,J= 8.1,2.5 Hz,H-5″),4.13~4.09(1H,m,H-2),3.82(3H,s,3′-OMe),2.78~2.63(4H,m,H-2,H-3);13C NMR(125 MHz,(CD3)2CO)δ:158.3(s,C-4′′),158.1(s,C-2′′),148.2(s,C-3′),145.9(s,C-4′),133.0(d,C-6′′),131.3(s,C-1′),122.9(d,C-6′),117.8(s,C-1′′),115.7(d,C-5′),114.0(d,C-2′),107.5(d,C-5′′),104.6(d,C-3′′),75.2(d,C-2),56.3(q,3′-OMe),43.9(t,C-1),39.1(t,C-3)。以上数据与文献[20]报道基本一致,故鉴定化合物5为virolanol B。
2.2 抗炎活性评价
采用Griess法测定了化合物1对小鼠RAW264.7巨噬细胞NO生成抑制活性的筛选,结果见表2。与阳性对照一氧化氮合酶抑制剂NG-单甲基-L-精氨酸(L-NMMA,IC50=10.18 μmol/L)相比,化合物1对RAW264.7细胞有明显的NO生成抑制作用(IC50=4.00 μmol/L)。

表2 化合物1体外NO生成抑制活性Table 2 In vitro NO production inhibitory activities of compound 1
3 结论
本文对肉豆蔻果实70%丙酮提取物的乙酸乙酯部位进行了化学成分的研究,共分离和鉴定了5个二芳基丙烷类化合物,其中化合物1为新化合物。对化合物的NO生成抑制活性测试发现,化合物1(IC50=4.00 μmol/L)对小鼠RAW264.7巨噬细胞的NO生成抑制作用明显强于阳性对照L-NMMA(IC50=10.18 μmol/L)。本研究结果可以为拓宽中药肉豆蔻抗炎的药用范围提供物质基础。

