高效液相色谱-串联质谱法同时测定发酵液中喷司他丁和2′-氨基-2′-脱氧腺苷
赵敏敏, 张宏宇*, 娄婷婷, 赵孔祥, 王素英
(1. 天津商业大学生物技术与食品科学学院, 天津市食品生物技术重点实验室,天津 300134; 2. 天津海关动植物与食品检测中心, 天津 300461)
喷司他丁(pentostatin)是一种嘌呤核苷类抗生素,在临床上主要治疗急性T细胞型淋巴细胞白血病[1,2]、毛细胞白血病[3,4]及慢性淋巴细胞白血病[5,6]。喷司他丁在人体中主要作为腺苷脱氨酶抑制剂[7-9],可明显抑制腺苷脱氨酶的活性,使癌变细胞中的脱氧腺苷大量积累,抑制癌细胞的核酸合成,从而起到治疗作用。1974年,Peter等[10,11]从链霉菌(Streptomycesantiboticus)的发酵液中首次分离到喷司他丁,美国食品药品监督管理局(FDA)于1991年正式批准其作为注射剂上市,药品名为Nipent[12]。目前,主要通过微生物发酵法获得喷司他丁,而针对发酵液中喷司他丁的检测方法主要包括高效液相色谱法(HPLC)[13-15]和高效液相色谱-串联质谱法(HPLC-MS/MS)[16-19]。李晓辉[15]采用HPLC的方法,以乙酸铵-甲醇作为流动相,使用Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm, 5 μm)对发酵液中喷司他丁的检测条件进行了优化,但整个洗脱程序耗时较长(25 min),喷司他丁保留时间为10.1 min,不利于快速检测,而且检测过程伴随着杂质的干扰,分离度低,需要进一步优化。杨鹏等[16]采用HPLC-MS/MS,以乙酸铵-甲醇-乙腈为流动相,使用Hypersil ODS2色谱柱(250 mm×4.6 mm, 5 μm),使得喷司他丁保留时间缩短到6 min,但使用该方法连续大量测样后,喷司他丁保留时间出现偏移,峰形变形,色谱柱柱效严重降低。巫攀等[17-19]应用HPLC-MS/MS对喷司他丁进行检测,选择含0.15%三氟乙酸的甲醇为流动相,采用Shimadzu Inertsil ODS-3反相色谱柱(250 mm×4.6 mm, 5 μm)进行分离,但分析时间仍需30 min以上。以上方法均没有实现喷司他丁的高效检测。随着HPLC-MS/MS技术的愈加成熟,近年来在食品[20,21]、药品[22,23]等领域被广泛应用,相较HPLC技术,其分离速度、灵敏度等各方面都有显著提升。基于此,本研究主要通过优化色谱柱、流动相及洗脱程序,充分发挥HPLC-MS/MS的检测优势,以缩短喷司他丁的检测时间,增强其分离度和检测精确度,同时实现了喷司他丁伴生产物2′-氨基-2′-脱氧腺苷含量的准确检测。该方法快速、灵敏,准确度高,重复性好,为从微生物发酵液中检测喷司他丁和2′-氨基-2′-脱氧腺苷提供了方法学基础和借鉴。
1 实验部分
1.1 仪器、试剂与材料
Transcend高效液相色谱-串联TSQ Quantum Ultra质谱装置(美国Thermo Fisher公司); Milli-Q超纯水制备仪(美国Millipore公司);分析天平(瑞士Precisa公司); H1850R高速冷冻离心机(长沙湘仪仪器公司);漩涡振荡器(海门仪器制造公司)。
喷司他丁标准品(纯度≥98%)、2′-氨基-2′-脱氧腺苷标准品(纯度≥98%)、甲酸铵(纯度≥99%)(上海阿拉丁生化科技股份有限公司);甲醇(色谱纯,瑞典Oceanpak公司);本实验所有用水均为Milli-Q超纯水。
1.2 标准溶液的配制
分别精确称取0.251 0 mg喷司他丁和0.253 0 mg 2′-氨基-2′-脱氧腺苷标准品,用超纯水溶解并定容至50 mL,配制成5 mg/L的标准储备液,分装至1.5 mL离心管中,于-80 ℃保存。准确吸取适量喷司他丁和2′-氨基-2′-脱氧腺标准储备液,配制成500 μg/L的混合标准溶液,于-80 ℃保存,备用。
1.3 样品前处理
取5 mL发酵液,于4 ℃以10 000 r/min离心10 min,取100 μL上清液,用水稀释500倍,经0.22 μm水系滤膜过滤后,进行HPLC-MS/MS检测。
1.4 色谱条件
色谱柱:保护柱(5 mm×2.1 mm, 5 μm,美国Waters公司), Atlantis®T3液相色谱柱(100 mm×2.1 mm, 5 μm,美国Waters公司);柱温:25 ℃;流动相A: 10 mmol/L甲酸铵(含0.1%甲酸),流动相B:甲醇(含0.02%甲酸);流速:0.3 mL/min;进样体积:10 μL。梯度洗脱程序见表1。

表 1 喷司他丁和2′-氨基-2′-脱氧腺苷的梯度洗脱程序
1.5 质谱条件
离子源:电喷雾离子(ESI)源;离子源温度:350 ℃;多反应监测(MRM)、正离子扫描模式;喷雾电压:3.5 kV;辅助气压力:103.4 kPa;鞘气压力:310.3 kPa;毛细管温度:300 ℃。母离子、定量离子、离子聚焦透镜电压(tube lens offset)及碰撞能(CE)见表2。

表 2 喷司他丁和2′-氨基-2′-脱氧腺苷的监测离子对、离子聚焦透镜电压和碰撞能
2 结果与讨论
2.1 质谱条件的优化
实验采用注射泵直接进样的方式将5 mg/L的2种标准品依次注入质谱仪器中,分别在ESI+和ESI-模式下,进行全扫描,从而确定合适的电离方式,并选择响应较高的离子作为母离子。结果显示,2种标准品均在ESI+模式下响应值较高。然后对其离子聚焦透镜电压进行优化。在此基础上,对各母离子进行子离子扫描,选择质谱丰度响应值高且信号稳定的碎片离子作为定量离子,随后对其碰撞能进行优化,以获得更具特异性的质谱方法。优化后得到的喷司他丁和2′-氨基-2′-脱氧腺苷的质谱参数见表2。仪器自动优化功能得到的其他质谱参数详见1.5节。
2.2 色谱柱的选择
本实验比较了Waters公司的Atlantis®dC18色谱柱(150 mm×2.1 mm, 5 μm)、Atlantis®C18色谱柱(250 mm×4.6 mm, 5 μm)和Atlantis®T3色谱柱(100 mm×2.1 mm, 5 μm)。在相同的流动相洗脱条件下,观察标准品的峰形和出峰时间。结果显示,当选择Atlantis®C18色谱柱检测时,喷司他丁保留时间在6 min左右,半峰宽略宽,而且随着长时间连续测样后,保留时间出现一定偏移,有严重的拖尾现象,柱效明显降低;当选择Atlantis®dC18色谱柱和Atlantis®T3色谱柱时,喷司他丁在保留时间上相差不大,均在2 min左右,但Atlantis®T3色谱柱在保留和分离强极性化合物上较Atlantis®dC18色谱柱更加优越,而且pH值耐受范围更宽。考虑到发酵液中基质的复杂性,以及实现快速检测的目的,实验最终选用Atlantis®T3色谱柱,并且添加了Waters公司对应的保护柱(5 mm×2.1 mm, 5 μm)以更好地维护色谱柱柱效及寿命。
2.3 流动相的选择
本研究在选用Atlantis dC18色谱柱(150 mm×2.1 mm, 5 μm)的条件下,分别考察了以10 mmol/L甲酸铵(含0.1%甲酸)-甲醇(含0.02%甲酸)、10 mmol/L甲酸铵(含0.1%甲酸)-乙腈-甲醇(含0.02%甲酸)作为流动相时,喷司他丁和2′-氨基-2′-脱氧腺苷的保留时间、峰形和响应强度。结果显示,当选择10 mmol/L甲酸铵(含0.1%甲酸)-乙腈-甲醇(含0.02%甲酸)为流动相时,喷司他丁和2′-氨基-2′-脱氧腺苷的峰形不对称,分离度差,均有严重的拖尾现象(见图1a)。当选择10 mmol/L甲酸铵(含0.1%甲酸)-甲醇(含0.02%甲酸)为流动相时,喷司他丁和2′-氨基-2′-脱氧腺可与干扰峰分开,峰宽较小,峰形更好(见图1b)。因此,实验选择10 mmol/L甲酸铵(含0.1%甲酸)-甲醇(含0.02%甲酸)作为流动相。
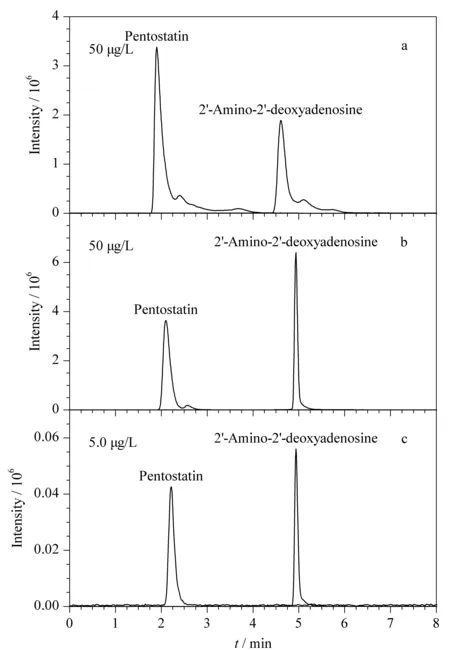
图 1 不同色谱条件下喷司他丁和2′-氨基-2′-脱氧腺苷混合标准溶液的色谱图Fig. 1 Chromatograms of the pentostatin and 2′-amino- 2′-deoxyadenosine in mixed standard solutions using the different chromatographic conditions Mobile phase: (a) 10 mmol/L ammonium formate (0.1% formic acid)-acetonitrile-methanol (0.02% formic acid); (b, c) 10 mmol/L ammonium formate (0.1% formic acid)-methanol (0.02% formic acid). Column: (a, b) Atlantis® dC18 column (150 mm×2.1 mm, 5 μm); (c) Atlantis® T3 column (100 mm×2.1 mm, 5 μm).
基于Atlantis®T3色谱柱在保留和分离强极性化合物上的优势,采用Atlantis®T3色谱柱和优化后的流动相10 mmol/L甲酸铵(含0.1%甲酸)-甲醇(含0.02%甲酸),对5.0 μg/L的混合标准溶液进行HPLC-MS/MS测定。结果显示,喷司他丁和2′-氨基-2′-脱氧腺苷均被有效分离,出峰时间稳定,且响应值与峰形良好(见图1c)。
2.4 基质效应
基质效应(ME)是指样品中除分析物以外的组分对分析过程存在一定的干扰,从而影响分析结果的准确性。本实验首先采用1.3节样品前处理方法制备空白基质溶液,然后分别以超纯水和空白基质溶液为溶剂,配制质量浓度为100 μg/L的喷司他丁和2-氨基-2-脱氧腺苷混合标准溶液,每个样品各6份,进行HPLC-MS/MS检测,以考察本方法的基质效应(基质效应=基质标准溶液中目标物含量/溶剂标准溶液中目标物含量×100%)[24]。
研究表明,喷司他丁和2′-氨基-2′-脱氧腺苷的基质效应分别为103.65%(RSD为2.01%)和107.72%(RSD为2.14%),发酵液中的其他组分会引起一定的基质增强现象,但总体上基质影响较小,比值均接近100%,说明本方法可有效避免基质效应的影响。
2.5 方法学考察
2.5.1线性关系、检出限和定量限
准确吸取500 μg/L喷司他丁和2′-氨基-2′-脱氧腺苷标准储备液,将其配制成1.0、5.0、10、25、50、100、200和250 μg/L的混合标准溶液。在优化后的色谱和质谱条件下制作标准曲线,其中,纵坐标是喷司他丁和2′-氨基-2′-脱氧腺苷的峰面积(y),横坐标是与之相对应的质量浓度(x, μg/L)。结果显示,2种化合物在1.0~250 μg/L范围内呈现出良好的线性,相关系数(R2)均大于0.99。将10 μg/L的混合标准溶液重复进样8次,得出峰面积的相对标准偏差(RSD)为6.51%~8.35%(见表3)。

表 3 喷司他丁和2′-氨基-2′-脱氧腺苷的线性范围、线性方程、相关系数、检出限及定量限
本实验分别以3倍和10倍信噪比(S/N)的响应值作为喷司他丁和2′-氨基-2′-脱氧腺苷的检出限(LOD)和定量限(LOQ)。检测结果表明,喷司他丁和2′-氨基-2′-脱氧腺苷的检出限为0.003~0.060 μg/L,定量限为0.010~0.200 μg/L。
2.5.2准确度及精密度
为了验证该方法的准确度和精密度,综合考虑标准曲线的线性范围和实际检测中喷司他丁和2′-氨基-2′-脱氧腺苷的含量范围,向发酵液样品中添加了3个水平(1.0、5.0和25 μg/L)的混合标准溶液,进行加标回收率试验,每个加标水平做6次重复试验,结果见表4。喷司他丁和2′-氨基-2′-脱氧腺苷的加标回收率分别为97.94%~104.46%和89.96%~107.21%。表明该方法重复性良好,准确度可达到分析要求。

表 4 发酵液样品中喷司他丁和2′-氨基-2′-脱氧腺苷的加标回收率和相对标准偏差(n=6)
2.6 实际样品检测
从本实验室中随机抽取一株产喷司他丁的突变株,摇瓶发酵后,按照1.3节前处理方法处理发酵液,利用所建立的分析方法对发酵液进行检测。得出该突变株喷司他丁的产量为71.32 mg/L, 2′-氨基-2′-脱氧腺苷的产量为168.60 mg/L(见图2)。从实际样品的色谱图中可明显看出,检测的化合物得到了高效分离,响应高,峰形较好。

图 2 实际样品中喷司他丁(71.32 mg/L)和2′-氨基-2′-脱氧腺苷(168.60 mg/L)的色谱图Fig. 2 Chromatogram of the pentostatin (71.32 mg/L) and 2′-amino-2′-deoxyadenosine (168.60 mg/L) in actual sample
3 结论
本文建立了高效液相色谱-串联质谱检测发酵液中喷司他丁和2′-氨基-2′-脱氧腺苷的分析方法,并进行了一系列的方法学验证。该方法可操作性强,稳定性高,检测快速,极大地缩短了上机检测时间,有效避免了基质效应对目标化合物的影响,并且为其他发酵液或相似基质中喷司他丁和2′-氨基-2′-脱氧腺苷的定性和定量检测提供了借鉴。

