蜜蜂兰组培快繁技术体系的建立
饶宝蓉 刘忠辉 周先治 陈泳和


摘 要:為了筛选蜜蜂兰组培快繁的最佳外植体以及蜜蜂兰种子诱导增殖、生根的最佳培养基配方。以未成熟蒴果果荚、成熟略黄蒴果果荚(未裂开)、成熟至裂开蒴果果荚3种不同成熟度的蜜蜂兰蒴果果荚作为外植体,研究不同成熟度果荚对蜜蜂兰诱导培养的影响;以MS为基本培养基及附加卡拉胶,采用四因素三水平正交试验方法研究添加不同浓度6BA、NAA、IBA、活性炭、香蕉泥对蜜蜂兰丛生芽诱导增殖的影响;以1/2MS为基本培养基及附加白糖、卡拉胶、香蕉泥,研究添加IBA、NAA、活性炭对蜜蜂兰丛生芽生根培养的影响。结果表明:蜜蜂兰以成熟且未开裂蒴果果荚作为外植体进行组培快繁表现最优,其诱导时间短、诱导率高、感染率低,且生长情况良好。蜜蜂兰丛生芽诱导增殖最佳培养基为MS+6BA 2.0 mg·L-1+NAA 0.15 mg·L-1+香蕉泥120 g·L-1+蔗糖35 g·L-1+卡拉胶7.0 g·L-1,增殖系数可达到3.1;生根壮苗最佳培养基为1/2MS基本培养基+NAA 0.9 mg·L-1+IBA 0.9 mg·L-1+香蕉泥120 g·L-1+蔗糖20 g·L-1+卡拉胶7.0 g·L-1,此培养条件下蜜蜂兰根系粗壮整齐,其生根率可达100%。
关键词:蜜蜂兰;组织培养;种子;增殖;生根
中图分类号:S 682 文献标志码:A 文章编号:0253-2301(2021)03-0032-05
DOI: 10.13651/j.cnki.fjnykj.2021.03.007
Abstract: In order to screen the best explant for the tissue culture and rapid propagation of Cymbidium floribundum Lindl., and the best medium formula for the seed inducible proliferation and rooting of Cymbidium floribundum Lindl., three kinds of capsule pods of Cymbidium floribundum Lindl. with different maturity were used as explants to study the effects of pods with different maturity on the inducing culture of Cymbidium floribundum Lindl. By using MS as the basal medium and adding carrageenan, the effects of different concentrations of 6BA, NAA, IBA, activated carbon and banana paste on the induction and proliferation of cluster buds of Cymbidium floribundum Lindl. were studied by orthogonal experiment with four factors and three levels. The effects of different hormone combination of IBA, NAA and activated carbon on the rooting culture of cluster buds of Cymbidium floribundum Lindl. were studied by using 1/2 MS as the basal medium and adding sugar, carrageenan and banana paste. The results showed that the fruit pods of mature and indehiscent capsules of Cymbidium floribundum Lindl. were the best explants for the tissue culture and rapid propagation, with short induction time, high induction rate, low infection rate and good growth. The optimal medium for the induction and proliferation of cluster buds of Cymbidium floribundum Lindl. was MS+6BA 2.0 mg·L-1+NAA 0.15 mg·L-1+banana paste 120 g·L-1+sucrose 35 g·L-1+carrageenan 7.0 g·L-1, and the multiplication coefficient reached 3.1. The optimal medium for the rooting and strong seedling was 1/2 MS basal medium+NAA 0.9 mg·L-1+IBA 0.9 mg·L-1+banana paste 120 g·L-1+sucrose 20 g·L-1+carrageenan 7.0 g·L-1. Under this culture condition, the root system of Cymbidium floribundum Lindl. was strong and neat, and the rooting percentage could reach 100%.
Key words: Cymbidium floribundum Lindl.; Tissue culture; Seed; Proliferation; Root
蜜蜂兰Cymbidium Fioribundum Var.pumilum为兰属多年鳞茎兰科附生植物,喜阴,怕阳光直射,喜湿润,忌干燥,其叶革质肥厚,并具有光泽,抗旱防寒力强。蜜蜂兰花小,不香或微香,花虽小,但花序较大。每个花序上花朵数较多,又名多花兰,花色为鲜艳的红色,生长势强健,能耐高温和低温。亦有较高的观赏价值,是较理想的盆栽花卉之一。蜜蜂兰主要分布于我国台湾、福建、浙江、江西、湖南、湖北、四川、贵州、广东、广西、云南等地(北纬28°线以南各省均有分布)。生长于海拔300~1600 m的林缘树干上或溪边石壁上。多花兰多数生长在山岩之上,也有的附生于大树枝杈上。蜜蜂兰不仅具有较高的观赏价值还深受养蜂人的喜爱。蜜蜂兰不仅外形酷似雌蜂,还能散发出独特气味吸引雄蜂前来交配,不仅为兰花授粉,养蜂人可以利用此特性来帮助吸引野蜂,将其驯化为家养蜂,还可产纯蜜蜂兰蜂蜜。
兰花主要以分株繁殖为主,繁殖系数低,自然条件下种子需要特定的真菌共生,萌发率极低[1],兰花种子萌发分为共生萌发和非共生萌发(无菌播种)两种。其中非共生萌发是指在人工培养基上不需要任何真菌侵染就可以使兰花种子萌发,它能够在短期内获得大量幼小植株,是现阶段经济有效的快速繁殖方法[2],在蝴蝶兰[3]、铁皮石斛[4]、四季兰[5]、带叶兜兰[6]等许多兰花上的应用报道较多,而在蜜蜂兰的研究上较少。本研究以蜜蜂兰不同成熟度蒴果果荚作为外植体进行诱导培养,探究不同成熟度蒴果果荚作外植体对蜜蜂兰组培快繁技术的影响,通过研究筛选蜜蜂兰丛生芽诱导与增殖及生根培养基配方,建立蜜蜂兰组培快繁技术体系,以期为蜜蜂兰的组培快繁生产提供参考。
1 材料与方法
1.1 试验时间、地点
试验于2018年在南平市农业科学研究所组培室进行。
1.2 试验材料
试验材料为蜜蜂兰蒴果,蒴果果荚采自南平市顺昌县洋墩乡洋坑村,将果荚分为3类:未成熟蒴果果荚、成熟略黄蒴果果荚(未裂开)、成熟至裂开蒴果果荚。
1.3 试验方法
1.3.1 不同成熟度蜜蜂兰蒴果消毒处理 取蜜蜂兰完好蒴果,稍用流水冲洗,用一定浓度的洗洁精浸泡10 min左右,继续用流水冲洗干净,将蒴果转入超净工作台,先用75%酒精消毒20~40 s,用无菌水冲洗2次,再用0.1%HgCl2消毒8 min,用无菌水冲洗5次,用滤纸吸干水分,放入无菌盘子上用刀片将其剥开,将种子用适量蒸馏水稀释,后用胶头滴管吸取滴入无菌诱导培养基表面[7-9]。取蜜蜂兰成熟至开裂的蒴果,直接放置超净工作台上将蒴果内的粉末状种子拨至无菌滤纸上,然后将其包好,将包好的种子带滤纸放置无菌瓶内用75%酒精消毒20~40 s,用无菌水冲洗2次,再用0.1%HgCl2消毒8 min后,用无菌水冲洗5次,尽量轻轻摇晃,以免滤纸破损。消毒结束后用镊子打开滤纸将种子用适量蒸馏水稀释,后用胶头滴管吸取滴入诱导培养基表面,2周左右,当看到由原来的黄色粉末状种子未被感染且开始转为绿色小原球茎时,即无菌系建立,可用于进一步试验。
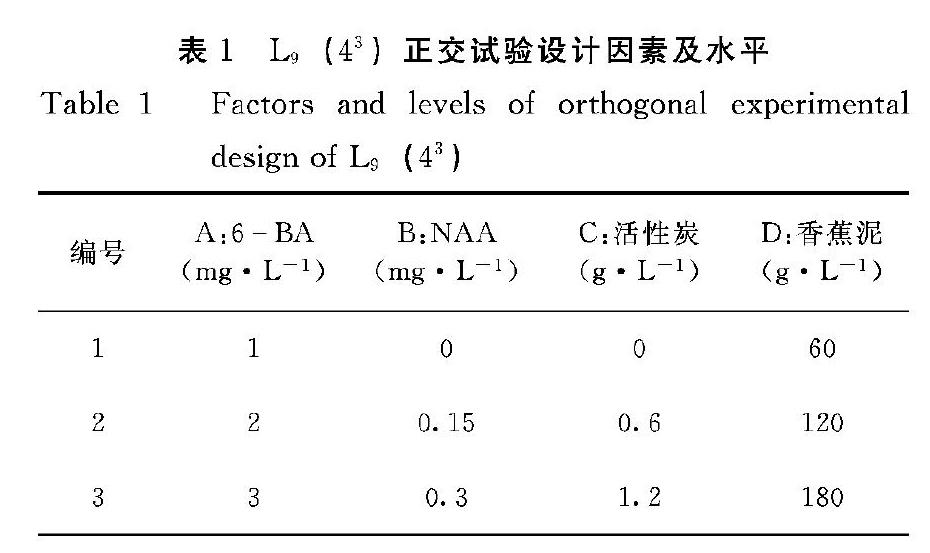
1.3.2 丛生芽诱导与增殖 通过无菌体系建立获得的无菌芽,经过继代转接,获得一定数量的丛生芽作为增殖培养试验材料。丛生芽增殖采用四因素三水平L9(43)正交试验设计,选择MS基本培养基,以6BA、NAA、活性炭、香蕉泥为试验因素,代号为A、B、C、D,各因素取3个水平(表1),各处理培养基均附加卡拉胶7.8 g·L-1 。每个处理接种9瓶,每瓶接种10个诱导芽,3次重复。增殖培养45 d后统计丛生芽增殖系数(增殖系数=增殖芽数/接种数)。
1.2.3 生根培养 将获得的健壮丛生芽切割成单芽(芽大小为1.5~2.0 cm),并接种于生根培养基上进行培养。以1/2 MS为基本培养基,附加白糖20 g·L-1、卡拉胶7.8 g·L-1、香蕉泥120 g·L-1。添加不同含量NAA(0.3、0.6、0.9 mg·L-1)和IBA(0.3、0.6、0.9 mg·L-1)及活性炭(0、0.6 g·L-1),其组合见表2,共12个处理,每个处理9瓶,每瓶接种10株,3次重复,生根培养45 d后统计生根情况。
1.2.4 培养方式与培养条件 采用固体培养基培养,pH值5.6~5.8,在温度为121℃,压强131 kPa下灭菌22 min。培养基放置无菌室内备用,1周后无感染即可使用。材料接种后,在光照强度2500 lx左右的光照下培养,光照时间11 h·d-1,培养室温度保持(25±1)℃。
1.2.5 数据统计 采用Excel、正交设计助手V 3.1以及JMP软件进行分析。
2 结果与分析
2.1 不同成熟度果荚对蜜蜂兰诱导培养的影响
兰科种子在野外难萌发不仅是因为种子本身需要经过漫长时间的成熟转化,还与环境因子如氧气、水分、光照、温度等以及共生菌有关[10]。从表3可以看出, 不同成熟度果荚对蜜蜂兰诱导培养有一定影响,以成熟且未开裂的蒴果果荚表现最优,其诱导时间短、诱导率高、感染率低,且生长情况良好。成熟裂开的果荚次之,在诱导时间上长于未裂开的果荚,且诱导率降低,这可能与种子直接接触灭菌剂有一定的关系。而未成熟的蒴果表现较差,诱导时间长,转类原球茎的数量少,时间长,不宜作为蜜蜂兰组织培养的外植体。
2.2 不同因素对蜜蜂兰试管苗增殖的影响
芽的增殖是组培快繁的重要环节,增殖率影响增殖效率。如表4,从K值大小可以看出,在蜜蜂兰丛生芽增殖培养过程中,6BA对蜜蜂兰丛生芽增殖的影响作用最大,添加活性炭不利于蜜蜂兰丛生芽的增殖,以不添加为宜;NAA 添加量以0.15 mg·L-1为宜,香蕉泥对蜜蜂兰丛生芽增殖也有一定的影响。从极差R值大小可以看出,不同因素对蜜蜂兰丛生芽增殖影响的主次关系为A>C>B>D,这表明四因素对蜜蜂兰丛生芽增殖影响最大的是6BA,其次是活性炭,再次是NAA和香蕉泥添加量,其中活性炭浓度较高对增殖不利。因此,活性炭应控制在较低浓度或者以不添加为宜。丛生芽增殖最佳处理组合是A2B2C1D2。即MS培养基+6BA 2 mg·L-1+NAA 0.15 mg·L-1+香蕉泥120 g·L-1,45 d后蜜蜂蘭丛生芽增殖系数可达3.0以上。
从表5可知,6BA、NAA、活性炭和香蕉泥四因素中只有6BA显著影响蜜蜂兰丛生芽增殖系数,NAA、活性炭和香蕉泥对增值系数的影响未达到显著水平,从F比可以看出影响程度最大的为6BA,与极差分析结果一致。
2.3 添加NAA、IBA、活性炭对蜜蜂兰试管苗生根培养的影响
植物生长调节剂NAA 、IBA对试管苗根的诱导有调控作用,在一定程度上影响着组培苗的生根时间、根系数量和瓶苗生长情况等。从表6可看出,在MS基本培养基中单独添加生长调节剂NAA或者IBA的生根效果不及两者混用的效果好。处理1、2、3(单独添加NAA 0.3、 0.6、 0.9 mg·L-1)蜜蜂兰根的生长势随着NAA浓度的增加而逐渐递增,平均生根系数为1.20~1.93,生根率也逐渐递增(91%~98%),地上部分苗的高度也逐渐增高。处理4、5、6(单独添加IBA 0.3、0.6、0.9 mg·L-1)蜜蜂兰根的生根系数随着IBA浓度的增加略有所下降,但差异不显著,生根率呈现先升高后降低的趋势,地上部分的高度也呈先升高后降低,根粗度逐渐增大。当同时添加NAA、IBA时各指标都优于单一激素的指标,如处理7、8、9。可见两种激素对蜜蜂兰生根起着协同作用。添加活性炭处理对蜜蜂兰生根有负面影响,这可能与活性炭的吸附性有关。本研究结果表明,蜜蜂兰生根培养最佳培养基为1/2 MS培养基+NAA 0.9 mg·L-1+IBA 0.9 mg·L-1+香蕉泥120 g·L-1。
3 结论与讨论
本研究初步建立了一套较完整的蜜蜂兰组织培养快速繁殖体系。目前有2000多种作物均可用组织培养获得其再生植株的途径,而用成熟的蒴果消毒后进行无菌播种形成原球茎,并经过增殖分化发育成完整植株是兰科属用的方法较为多的一种,也可以选择适宜的外植体(茎段、茎尖、幼芽、叶片等)诱导形成拟原球茎或者丛生芽来实现快繁易解决作物资源紧缺问题。组织培养的生长过程主要受培养基和培养条件等因素的共同影响,其中激素种类和浓度至关重要[11-12]。本试验分别用不同成熟度的蒴果果荚作为外植体,探究不同成熟度果荚对蜜蜂兰诱导时间和诱导率的影响,结果表明未成熟的蒴果果荚内种子成熟度不够,萌发时间长,诱导率低;而成熟开裂果荚在消毒灭菌上更难操作,且果荚内的种子直接与灭菌剂接触使得种子容易受伤,导致诱导率下降,萌发时间增长,因此蜜蜂兰以成熟但果荚完好不开裂蒴果果荚作为外植体为佳。
本研究还设置激素不同浓度对已萌发的原球茎的分化、增殖和生根壮苗的影响,筛选出适合蜜蜂兰诱导增殖与生根的培养基配方。不同学者在兰科作物组织培养中所用生长素的种类和浓度不同,唐桂香等
[13]研究表明,MS基本培养基中添加6BA 1.0 mg·L-1和NAA 0.1 mg·L-1有利于铁皮石斛原球茎的诱导增殖。本研究结果发现,MS基本培养基中添加6BA 2.0 mg·L
-1和NAA 0.15 mg·L-1有利于蜜蜂兰原球茎的诱导增殖,而1/2MS基本培养基中添加NAA 0.9 mg·L-1和IBA 0.9 mg·L-1有利于蜜蜂兰原球茎的生根培养。
兰科作物果荚内种子数量极多,快速繁殖可利用该一优势,利用种子进行非共生萌发,继而不断进行分化和增殖。本试验结果表明选用成熟且未开裂的蒴果果荚作为外植体最为理想,感染率低,萌芽率最高。适合蜜蜂兰种子诱导增殖的培养基为MS基本培养基+6BA 2.0 mg·L-1+NAA 0.15 mg·L-1+香蕉120 g·L-1+蔗糖35 g·L-1+卡拉胶7.0 g·L-1,增殖系数可达3.1;适合蜜蜂兰生根壮苗的培养基为1/2 MS基本培养基+NAA 0.9 mg· L-1+ IBA 0.9 mg·L-1+香蕉泥120 g·L-1+蔗糖20 g·L-1+卡拉胶7.0 g·L-1,根系粗壮整齐,其生根率达100%。在试管苗培育成功后,关键问题是试管苗的移栽环节,如何提高试管苗移栽的成活率将是下一步的研究方向。
参考文献:
[1]董芳.几种兰科植物菌根真菌的筛选及种子萌发条件的研究[D].北京:北京林业大学,2008.
[2]朱泉,田甜,杨澍,等.兰科植物种子的非共生萌发研究进展[J].江苏农业科学,2009(4):205-208.
[3]丁峰,徐建新,孙莉,等.蝴蝶兰无菌播种快繁技术[J].江苏农业科学,2005(4):79-80.
[4]宋顺,许奕,林妃,等.铁皮石斛兰种子萌发及其原球茎的快繁培养条件研究[J].安徽农业科学,2013,41(21):8850-8852.
[5]田梅生,王伏雄,钱南芬,等.四季兰种子离体萌发及器官建成的研究[J].Journal of Integrative Plant Biology,1985(5):455-459.
[6]曾宋君, 陈之林, 段俊. 带叶兜兰的无菌播种和离体快速繁殖[J].植物生理学通讯,2006(2):247.
[7]饶宝蓉,陈泳和,江文清,等.铁皮石斛不同外植体组培快繁技术比较[J].安徽农业科学, 2017,45(4):138-141.
[8]李泽生,白燕冰,耿秀英,等.铁皮石斛茎段丛生芽诱导研究[J].热带农业科技,2011,34(2):28-31.
[9]张红梅,刘建东,王岩花,等.铁皮石斛茎段快繁技术研究[J].山西农业大学学报(自然科学版),2010,30(6):495-499.
[10]戴小英,张淑霞,周莉荫,等.铁皮石斛不同外植体组培快繁技术比较研究[J].中国农学通报,2011,27(10):122-126.
[11]刘明志,朱京育.培养基、BA和复合添加物对大花蕙兰增殖和分化的影响[J].暨南大学学报(自然科学与医学版),2000(3):100-105.
[12]范树国,李应安,邱璐,等.蝴蝶兰原球茎诱导因素初探[J].安徽农业科学,2009,37(3):976-978.
[13]唐桂香,黄福灯,周伟军.铁皮石斛的种胚萌发及其离体繁殖研究[J].中國中药杂志,2005(20):23-26.
(责任编辑:林玲娜)

