QuEChERS结合高效液相色谱串联质谱法测定饲料中氯霉素
陈其煌

摘 要:建立QuEChERS结合高效液相色谱串联质谱法测定饲料中氯霉素方法。样品经水相分散后用乙腈提取,经QuEChERS方法净化后,采用高效液相色谱串联质谱法测定,外标法定量。以超纯水和甲醇作为流动相,用Hypersil GOLD C18色谱柱(1.9 μm,2.1 mm×100 mm)进行梯度洗脱,采用电喷雾离子源(ESI-)、负离子扫描多反应监测(MRM)模式进行定性和定量分析。结果表明:氯霉素在5.0~200.0 ng·mL-1的范围内线性关系良好(r=0.9992)。在10.0、20.0、50.0 μg·kg-1添加水平下的回收率为84.2%~89.7%,相对标准偏差(n=6)为6.5%~8.8%,检出限(以信噪比>3计)为0.2 μg·kg-1,定量限(以信噪比>10计)为0.6 μg·kg-1。该方法精密度好,灵敏度高,能简便地准确测定饲料中的氯霉素。
关键词:QuEChERS;高效液相色谱串联质谱法;氯霉素;饲料
中图分类号:S 816.17 文献标志码:A 文章编号:0253-2301(2021)03-0046-07
DOI: 10.13651/j.cnki.fjnykj.2021.03.010
Abstract: This study aimed to establish a method for the determination of chloramphenicol in feed by using QuEChERS combined with the high performance liquid chromatographytandem mass spectrometry method. After water dispersion, the samples were extracted with acetonitrile. And then after the purification by QuEChERS method, the samples were determined by high performance liquid chromatographytandem mass spectrometry and quantified by external standard method. By using the ultrapure water and methyl alcohol as mobile phases, the gradient elution was carried out by Hypersil GOLD C18 column (1.9 μm, 2.1 mm×100 mm). And then the qualitative and quantitative analysis was carried out by using the electrospray ionization (ESI-) and anion scanning multiple reaction monitoring (MRM) modes. The results showed that the linear relation of chloramphenicol was good in the range of 5.0-200.0 ng·mL-1 (r=0.9992). The recoveries at the adding levels of 10.0, 20.0 and 50.0 μg·kg-1 ranged from 84.2% to 89.7%, the relative standard deviations (n=6) were 6.5%-8.8%, the limits of detection (based on S/N>3) were 0.2 μg·kg-1, and the limits of quantitation (based on S/N>10) were 0.6 μg·kg-1. The method had good precision, high sensitivity and could be used to determine the chloramphenicol in feed simply and accurately.
Key words: QuEChERS;High performance liquid chromatographytandem mass spectrometry;Chloramphenicol;Feed
氯霉素(Chloramphenicol,分子式:C11H12Cl2N2O5,分子量:323.14,CAS:56757)屬于酰胺醇类抗生素,是一种广谱抑菌性抗生素,对多种病原菌具有较强的抑制作用,被广泛应用在水产、畜禽养殖上。氯霉素会抑制骨髓细胞中蛋白质的合成,对人类和动物的骨髓细胞和肝细胞具有毒性作用,不仅可引起细胞减少性贫血、血小板减少和再生障碍性贫血,还可导致严重的胃肠道反应、二重感染等,对人体产生毒性[1-2]。为进一步规范养殖用药行为,保障动物源性食品安全,2019年12月27日,农业农村部发布第250号公告,将氯霉素列入食品动物中禁止使用的药品及其他化合物清单。因此,加强对饲料中氯霉素残留的检测具有非常重要意义。
目前,饲料中氯霉素的检测方法主要有酶联免疫吸附测定法(ELISA)[3-5]、气相色谱法[6]、气相色谱质谱联用法[7-8]、高效液相色谱法(HPLC)[9-10]和高效液相色谱串联质谱法(HPLCMS/MS)[11-19],大多采用固相萃取或液液分配萃取净化,前处理操作比较复杂烦琐,溶剂消耗量大。QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)方法是由Anastassiades等于2003年提出[20],该方法在农药残留、兽药残留及非法添加物测定等领域得到广泛应用,并在应用中不断改善,已成为农药兽药等残留定性定量的方法之一[21-26]。采用QuEChERS方法测定饲料中氯霉素尚未见研究报道,本研究建立的QuEChERS结合高效液相色谱串联质谱法测定饲料中氯霉素的方法,操作快捷、简便、实用,灵敏、准确可靠,可为检测饲料中是否非法添加氯霉素提供可靠手段,满足饲料中氯霉素的快速测定要求。
1 材料与方法
1.1 试验仪器
SHIMADZU 30A(CBM30ACTO30ALC30ADSIL30ACDGU20A5R,日本Shimadzu公司);Triple Quad 5500三重四极杆质谱仪(美国AB Sciex公司);KQ500DE型数控超声波清洗器(昆山市超声仪器有限公司);MilliQ去离子水发生器(美国MILLIPORE公司);CF16RXⅡ高速冷冻离心机(日本HITACHI公司); PL602S电子天平[梅特勒托利多(上海)有限公司];VORTEX GENIUS 3 旋涡混合器(德国IKA公司);VXⅢ多管涡旋振荡器[安简(北京)科技有限公司]。
1.2 试验试剂
氯霉素标准品(Chloramphenicol)(德国 Dr.Ehrenstorfer GmbH 公司,纯度99.9%);甲醇、乙腈为色谱纯试剂(美国TEDIA公司);甲酸为分析纯(国药集团化学试剂有限公司);氯化钠为分析纯(国药集团化学试剂有限公司);实验室用水为MilliQ高纯水;QuEChERS萃取盐包(Part No.59827555,内含1.5 g NaCl、6.0 g MgSO4,美国Agilent公司);QuEChERS净化管A(Part No.5982
5421CH,2 mL,内含50 mg PSA、50 mg C18EC、150 mg MgSO4,美国Agilent公司);QuEChERS净化管B(Part No.59825421CH,2 mL,内含50 mg PSA、50 mg C18EC、50 mg GCB、150 mg MgSO4,美国Agilent公司);有机相针式滤器(尼龙,13 mm,0.22 μm,上海安谱实验科技股份有限公司)。
1.3 试验方法
1.3.1 样品前处理 (1)样品制备。按照GB/T 14699.1-2005/ISO 6497:2002进行采样[27],按GB/T 20195-2006/ISO 6498:1998[28]要求对样品进行制样处理,饲料样品粉碎后过1 mm 孔徑的分析筛,混匀后装入密闭封口塑料袋中,避光冷藏保存,备用。(2)提取与净化。准确称取2 g(精确到0.01 g)饲料样品于50 mL离心管内,加入超纯水4 mL,浸泡涡旋充分混匀,再准确加入乙腈4.0 mL和4 g氯化钠,涡旋混匀并振荡5 min后,8000 r·min-1离心10 min,取出上层有机相1 mL至QuEChERS净化管A内,涡旋混匀并振荡2 min,于15000 r·min-1高速离心10 min,取上清液适量过0.22 μm有机相滤膜,供高效液相色谱串联质谱仪测定。同步做空白提取液和空白添加试样。
1.3.2 标准溶液配制 精密称取氯霉素标准品10 mg至100 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,即含氯霉素100 μg·mL-1标准储备液,于-18℃避光保存备用,有效期6个月。量取储备液用甲醇稀释到1 μg·mL-1,作为氯霉素标准中间液,于-18℃避光保存备用,有效期3个月。精密称取适量的氯霉素标准中间液用同类基质空白样品提取液配制,制得5.0、10.0、20.0、50.0、100.0、200.0 ng·mL-1对照溶液,供高效液相色谱串联质谱仪测定。
1.3.3 提取溶剂和提取方式选择 分别采用乙腈、0.1%甲酸乙腈溶液、0.2%甲酸乙腈溶液、0.5%甲酸乙腈溶液、1.0%甲酸乙腈溶液作为提取溶剂,其余步骤均按1.3.1
(2)提取与净化进行,添加氯霉素标准溶液进行提取回收率试验,确定最佳提取溶剂。
取阴性饲料样品添加氯霉素标准溶液后,在加入水和乙腈后,分别同步采用涡旋振荡和超声2种方式进行提取,其余步骤均按1.3.1(2)提取与净化进行,比较考察2种提取方式的回收率情况。
1.3.4 净化条件优化 试验进行QuEChERS净化管A和QuEChERS净化管B两种净化管的加标回收率和净化效果对比试验,分别采用A、B两种净化管净化样品提取液,其他步骤均按1.3.1(2)操作进行。
1.3.5基质效应 取阴性饲料样品按1.3.1(2)提取与净化制备空白样品提取液配制基质标准曲线与溶剂标准曲线进行上机分析,比较考察氯霉素的响应强度。
1.4色谱与质谱条件
1.4.1 色谱条件 色谱柱:Hypersil GOLD C18色谱柱(1.9 μm,2.1 mm×100 mm);流动相:A相为超纯水,B相为甲醇;流速:0.30 mL·min-1;洗脱程序:0~0.5 min维持10% B,0.5~4 min线性变化至95% B,4~7 min维持95% B,7.0~7.1 min线性变化至10% B,并维持到10 min。柱温30℃。进样量:1.0 μL。
1.4.2 质谱条件 电喷雾离子源(ESI-),负离子扫描模式,扫描方式为多反应监测(MRM);电喷雾电压(IS)为-4500 V,辅助气温度(TEM)550℃,雾化气(GS1)压力50 psi,辅助气(GS2)压力50 psi,气帘气(CUR)压力35 psi。
1.5 定性与定量分析
在相同试验条件下,检出物质的色谱峰保留时间与标准品的保留时间偏差在±2.5%之内,并且样品谱图中定性离子的相对丰度与同等条件下得到的标准溶液谱图相比,允许偏差符合欧盟2002/657/EC《质谱分析方法鉴定点数》中的规定,则可判定样品中存在对应的被测物。基质标准工作溶液注入仪器检测,获得质量浓度与响应值(色谱峰面积)线性相关的标准工作曲线,外标法定量。
2 结果与分析
2.1 色谱条件优化
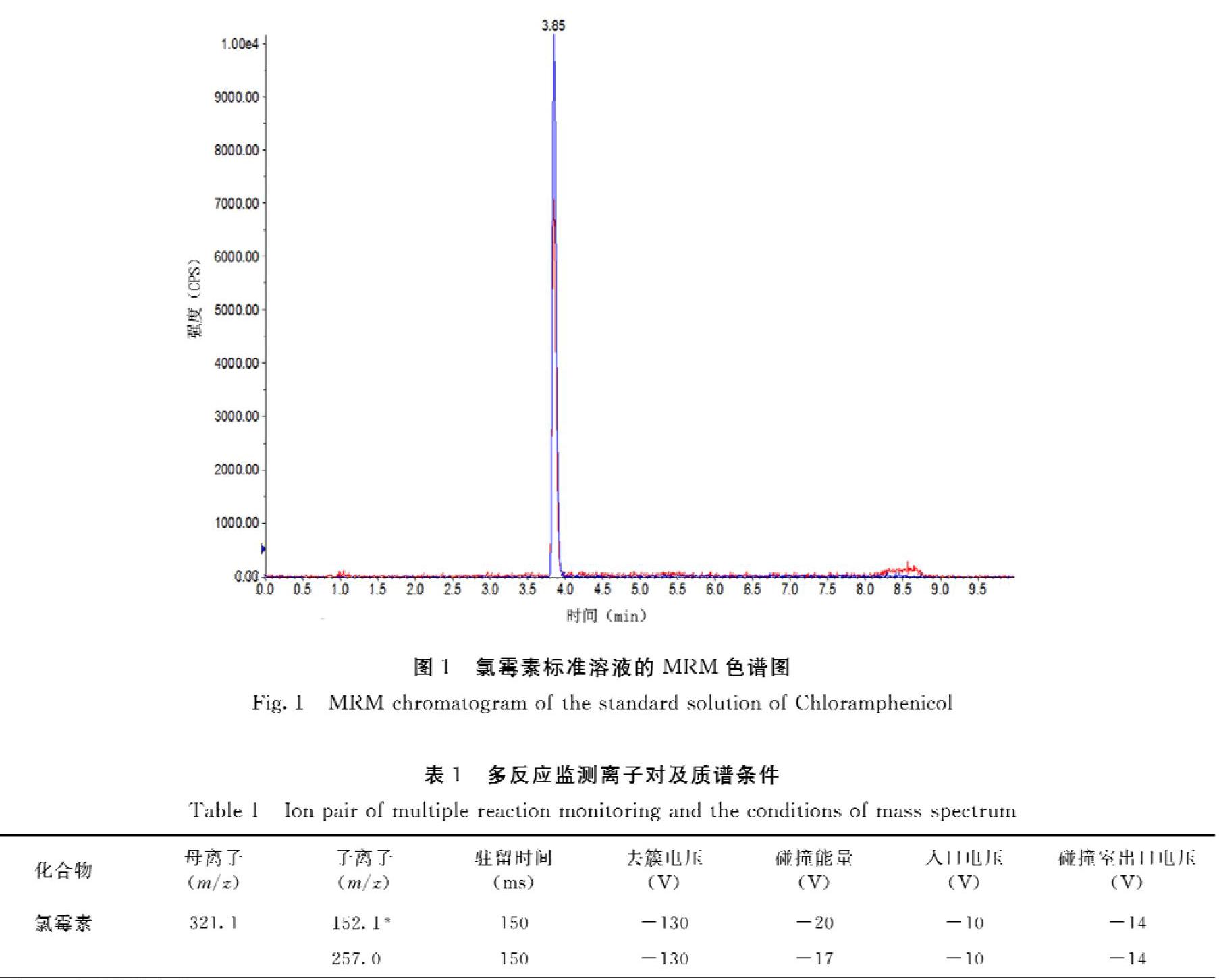
甲醇和乙腈常被用于反相液相色谱的流动相,本试验分别以乙腈和甲醇作为液相洗脱流动相考察氯霉素的分离度和灵敏度。结果表明以乙腈和甲醇2种有机试剂作为流动相都能达到分离度要求,灵敏度差别不大。从经济方面考虑,本研究选择甲醇作为洗脱流动相。以甲醇和超纯水为流动相,优化梯度洗脱方法,缩短分析时间,确保保留时间稳定,获得理想的峰形和灵敏度。图1为5.0 ng·mL-1氯霉素标准溶液的MRM色谱图。
2.2 质谱条件优化
氯霉素由于其化学结构中羟基、酰胺键的存在,具有很强的极性,在负离子模式下有较高的响应[14]。 在电喷雾离子源负离子模式(ESI-)下进行全扫描,采用质量浓度1.0 μg·mL-1的氯霉素标准溶液以10.0 μL·min-1的流速针泵连续注入质谱仪进行全扫描,获得[MH]的准分子离子峰,以其作为母离子进行轰击,获得碎片子离子,选择信号较强的两个碎片子离子和母离子组成两对监测离子对,在多反应监测(MRM)模式下,进一步优化去簇电压(DP)、碰撞能量(CE)、入口电压(EP)和碰撞室出口电压(CXP)等参数。优化获得的MRM离子对及质谱条件见表1。
2.3 提取溶剂和提取方法的确立
饲料基质复杂,含有大量的干扰物,会干扰目标化合物的分析,这就要求前处理必须能够净化饲料复杂基质, 同时又要能够提取出目标化合物。氯霉素易溶于乙腈、甲醇和乙酸乙酯,考虑到甲醇和乙酸乙酯的盐析效果较差,不利于分层,因此选用乙腈作为主提取溶剂做进一步考察优化。试验结果表明,用乙腈、0.1%甲酸乙腈溶液、0.2%甲酸乙腈溶液、0.5%甲酸乙腈溶液、1.0%甲酸乙腈溶液提取的添标回收率分别为83.5%~89.4%、82.1%~86.3%、81.3%~90.2%、68.7%~76.6%、65.3%~75.2%,前三者差别不大,均比用后二者提取的回收率高。综合考虑选择乙腈作为提取溶剂。
试验还考察比较涡旋振荡和超声2种提取方式对回收率的影响。结果表明,涡旋振荡和超声2种提取方式的回收率分别为84.6%~87.2%、83.8%~85.6%,综合考虑操作简便和时耗等因素,最终确定选用涡旋振荡提取方式。
2.4 净化条件优化
试验结果表明,净化管A净化后的样品加标回收率在80%~110%,而净化管B净化后的样品加标回收率在65%~80%,两种净化管净化后的样品色谱图杂峰不多,均有较好的净化效果,因此选择净化管A作为前处理净化管。
2.5 基质效应分析
取阴性饲料样品按1.3.1(2)提取与净化制备空白样品提取液配制基质标准曲线与溶剂标准曲线进行比较分析。试验结果表明,在相同仪器条件下,相同浓度的氯霉素基质标准溶液的质谱响应值均比溶剂标准溶液的响应值高,表明氯霉素在饲料基质中有较强的基质增强效应。为降低基质效应影响,提高准确性,本方法采取基质匹配标准曲线定量分析。
2.6 方法学考察
2.6.1 方法的线性范围 采用本研究建立的方法获得的基质匹配标准曲线线性良好,在5.0~200.0 ng·mL-1的质量浓度范围内,氯霉素质量浓度X与其峰面积Y的标准曲线线性方程为Y=5.43×103X+8.43×103,线性相关系数r为0.9992。图2为氯霉素基质匹配标准曲线图。
2.6.2 方法的灵敏度 以空白样品低水平加标测试方法的检出限(LOD)和定量限(LOQ),以3倍信噪比(S/N=3)对应的浓度为方法的检出限,以10倍信噪比对应的浓度为方法的定量限。通过计算,该方法检出限为0.2 μg·kg-1,定量限为0.6 μg·kg-1。参考GB/T 21108-2007《饲料中氯霉素的测定 高效液相色谱串联质谱法》中氯霉素的方法最低检出限为5 μg·kg-1,定量限为10 μg·kg-1[11],农业部2483号公告-8-2016《饲料中氯霉素、甲砜霉素和氟苯尼考的测定液相色谱串联质谱法》中氯霉素的方法检出限为0.3 μg·kg-1,定量限为1 μg·kg-1[19],本方法的灵敏度能够满足检测要求。
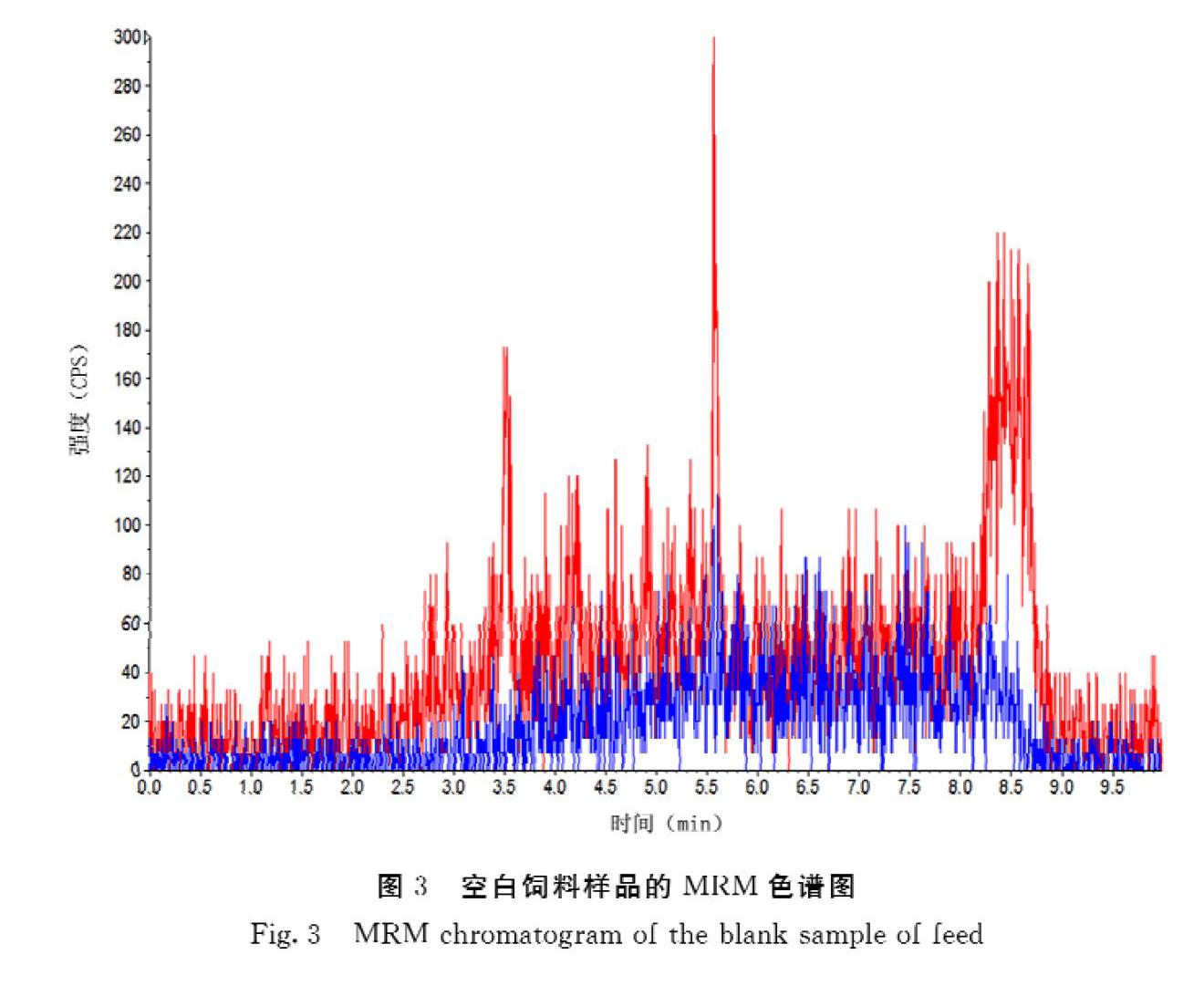
2.6.3 方法的精密度和准确度 分别添加适量的标准溶液至空白饲料样品中,制得10.0、20.0、50.0 μg·kg-1 3种添加水平的样品各6个,按照建立的方法处理样品并进行HPLCMS/MS分析测定,图3~4为空白饲料样品和加标水平为50.0 μg·kg-1的饲料样品MRM色谱图。结果(表2)表明,氯霉素的回收率为84.2%~89.7%,相对标准偏差(n=6)为6.5%~8.8%,本方法具有良好的准确性,能够满足兽药残留的分析要求。
2.7 实际样品检测
用本方法對12份来自饲料样品进行检测,所测样品均未检出氯霉素残留。样品谱图本底干净没有干扰峰,质控样品添加氯霉素标准溶液回收率为85.7%,符合GB/T 27417-2017《合格评定 化学分析方法确认和验证指南》的相关规定[29]。
3 结论与讨论
本研究采用QuEChERS方法前处理用于饲料中氯霉素的测定,结果表明,氯霉素在5.0~200.0 ng·mL-1的范围内线性关系良好(r=0.9992)。在10.0、20.0、50.0 μg·kg-1添加水平下的回收率为84.2%~89.7%,相对标准偏差(n=6)为6.5%~8.8%,检出限(以信噪比>3计)为0.2 μg·kg-1,定量限(以信噪比>10计)为0.6 μg·kg-1。试验过程中发现,石墨化碳黑(GCB)对色素有较强的吸附作用,在用含有GCB的净化管净化后,样品颜色较浅,但氯霉素添标回收率降低,表明GCB对样品中的氯霉素有吸附损失,本试验进样量较少,因此综合考虑选择不添加GCB。如遇样品色素较深且需要大体积进样时,建议在确保回收率的同时,优化适量添加GCB。本研究建立了高效液相色谱串联质谱法测定饲料中氯霉素的方法,样品经水相分散后,用乙腈提取QuEChERS方法净化,以基质配制标准溶液外标法定量。样品前处理简单,消耗有机溶剂较少,线性范围宽,方法的定量限低,精密度和准确度高,符合方法学要求。该方法适合于批量实际样品的快速检测,能够满足药物残留分析要求,可用于饲料中氯霉素非法添加的检测监控。由于条件等限制,本试验未将同属于酰胺醇类抗生素的甲砜霉素和氟甲砜霉素同时进行考察试验,下一步将进行深入考察探究,以满足样品多项目同时测定的需要。
参考文献:
[1]赵雅楠,闫玉杰,杨赵伟,等.超高效液相色谱串联质谱法检测貉子肉中氯霉素、氟甲砜霉素的残留量[J].养殖与饲料,2019(8):15-18.
[2]罗昭军,陈幸,单乃荣,等.高效液相色谱法检测鸡蛋中氯霉素类药物残留[J].中国畜牧兽医文摘,2018,34(3):72-74.
[3]贾涛.酶联免疫法检测饲料中氯霉素的探讨[J].饲料研究,2009(9):39-40.
[4]贾涛.酶联免疫法检测饲料中氯霉素的探讨(续)[J].饲料研究,2009(10):38-39.
[5]贾涛.酶联免疫法检测饲料中氯霉素的方法条件研究[J].饲料与畜牧,2013(8):43-46.
[6]中华人民共和国国家质量监督检验检疫总局.GB/T 8381.9-2005饲料中氯霉素的测定气相色谱法[S].北京:中国标准出版社,2005.
[7]王丙涛.气质联用检测饲料中氯霉素的方法研究[J].现代畜牧兽医,2007(5):62-64.
[8]刘红云,蔡海莹.饲料中氯霉素气相色谱质谱检测方法的研究[J].兽药与饲料添加剂,2008,13(6):25-27.
[9]戴华,王美玲,李拥军,等.饲料中氯霉素、甲砜霉素和氟甲砜霉素含量的HPLC测定方法[J].光谱实验室,2006,23(6):1208-1212.
[10]冯娅,程传民.超高效液相色谱(UPLC)测定饲料中氯霉素残留量[J].中国饲料,2008(4):32-33.
[11]中华人民共和国国家质量监督检验检疫总局.GB/T 21108-2007 饲料中氯霉素的测定 高效液相色谱串联质谱法[S].北京:中国标准出版社,2007.
[12]李红权,孙良娟,伍志强,等.高效液相色谱串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留[J].分析测试学报,2012,31(11):1396-1400.
[13]吕飞,周宇,余优军,等.LCMS/MS测定饲料中氯霉素残留量两种不同前处理方法的比较[J].粮食与饲料工业,2012(8):61-64.
[14]贾涛,关洪英.液相色谱串联质谱法检测饲料中的氯霉素[J].饲料广角,2012(4):38-39,42.
[15]李佩佩,张小军,梅光明,等.超高效液相色谱串联质谱法检测渔用饲料中氯霉素类药物[J].中国渔业质量与标准,2013,3(3):44-50.
[16]冯民,魏云计,朱臻怡,等.高效液相色谱串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留量[J].分析测试学报,2013,32(1):117-121.
[17]魏云计,冯民.高效液相色谱质谱法测定配合饲料中氯霉素残留量的研究[J].饲料博览,2013(4):5-8.
[18]张伟,彭麟,江善祥.超高效液相色谱串联质谱法测定畜禽饲料中氯霉素类药物含量[J].南京农业大学学报,2015,38(3):453-458.
[19]中华人民共和国农业部.农业部2483号公告-8-2016 饲料中氯霉素、甲砜霉素和氟苯尼考的测定 液相色谱串联质谱法[S].北京:中国农业出版社,2016.
[20]ANASTASSIADES M,LEHOTAY S J,STAJNBAHER D,et al.Fast and Easy multiresidue method Employing Acetonitrile Extraction/Partitioning And ″Dispersive Solidphase Extraction″ for the Determination of Desticide Residues in Produce[J].J AOAC Int,2003,86(2):412-431.
[21]易江华,段振娟,方国臻,等.QuEChERS方法在食品农兽药残留检测中的应用[J].中国食品学报,2013,13(2):153-158.
[22]刘满满,康澍,姚成.QuEChERS方法在農药多残留检测中的应用研究进展[J].农药学学报,2013,15(1):8-22.
[23]倪建秀,陈涛,陈桂芳.QuEChERS方法在食用农产品农兽药残留检测中的应用进展[J].现代农药,2016,15(5):5-8,11.
[24]郑佳,郗存显,曹淑瑞,等.QuEChERS超高效液相色谱串联质谱法同时测定保健食品中21种非法添加化学药物[J].色谱,2017,35(12):1257-1265.
[25]刘畅,孙安敏.QuEChERS 方法在食品非法添加物检测中的应用[J].农业科学研究,2019,40(2):46-51,56.
[26]于霞,马凯,黄永桥,等.QuEChERS方法在食品农兽药残留检测中的应用[J].现代食品,2019(9):14-17,28.
[27]中华人民共和国国家质量监督检验检疫总局.GB/T 14699.1-2005/ISO 6497:2002 饲料 采样[S].北京:中国标准出版社,2005.
[28]中华人民共和国国家质量监督检验检疫总局.GB/T 20195-2006/ISO 6498:1998 动物饲料 试样的制备[S].北京:中国标准出版社,2006.
[29]中华人民共和国国家质量监督检验检疫总局.GB/T 27417-2017 合格评定 化学分析方法确认和验证指南[S].北京:中国标准出版社,2017.
(责任编辑:林玲娜)

