渔用氧化剂对水源水和池塘水中磺胺类抗性基因sul1的去除作用
赵晓雨,苏浩昌,徐 煜,徐武杰,胡晓娟,文国樑,曹煜成,余招龙
(1.上海海洋大学水产与生命学院,上海 201306; 2.中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300; 3.中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121; 4.广东冠利海洋生物有限责任公司,广东 茂名 525400)
抗生素的大量使用及其在生物体内的不完全代谢使其在自然界水体环境中残留[1-2],并通过养殖水源水的传播途径进入养殖环境,还可能诱导形成抗生素抗性菌 (Antibiotic resistant bacteria, ARB) 和抗性基因 (Antibiotic resistant genes, ARGs)。近年来,ARGs已成为环境中的新型污染物,其借助可移动遗传元件转移到病原菌的基因组中,使病原菌产生抗生素耐药性,对养殖动物甚至人体健康造成潜在威胁[3-5]。因此,抗生素及其ARGs的环境残留问题受到广泛关注。黄志坚等[6]选取了139 株分离自水产养殖环境中的细菌,对氟氯霉素、磺胺、链霉素和甲氧苄啶等多种抗生素的抗性基因进行了特征分析,结果显示上述ARGs在所测菌株中均被检出。据Su等[7]和Wang等[8]报道,在中国南方对虾养殖主产区,sul1和cmlA等多种ARGs在养殖水源水、池塘水、底泥和对虾肠道中均有检出。可见,已有不同种类的ARGs在水产养殖环境中传播。
有学者认为造成水产品中抗生素抗性残留的主要原因是未经处理的养殖尾水在养殖生产中被重复使用[9]。科学使用氧化剂对养殖水环境和相关设施进行有效消毒,可防止水产病原菌积累,促进养殖生物健康生长。渔用氧化剂在水产养殖中的使用量大,且目前常用渔用氧化剂主要有氯制剂、溴制剂以及高锰酸钾 (KMnO4)等[10]。渔用氧化剂中,含氯消毒剂 [ 次氯酸钠 (NaClO) 和漂白粉等]价格较低、杀菌广谱,其通过次氯酸的氧化作用对水体环境中的细菌起到杀灭作用;溴类消毒剂的主要作用成分是次溴酸,具有广谱杀菌作用[10-11];KMnO4是强氧化剂,溶于水后释放新生态氧,使有机物氧化从而起到杀菌作用,在改良水质方面也有很好的效果[12]。这些消毒剂因价格低廉、杀菌广谱且高效,在水产养殖业中应用广泛[11-12]。氧化剂对水体中微生物的不同细胞成分 (如氨基酸、脂类和核酸等) 的氧化能力存在较大差别,这也使得其对细胞内抗性基因 (Intracellular antibiotic resistant genes,iARGs) 和细胞外抗性基因 (Extracellular antibiotic resistant genes, eARGs) 的去除作用差异显著[13]。随着qPCR技术的发展与应用,ARGs的检测与定量不再受限于抗性菌的可培养性,该技术也被广泛用于定量研究ARGs的去除[13-14]。近年来,城市污水处理领域的相关研究显示,活性氯和臭氧等普通氧化剂以及紫外线或过渡金属离子参与的高级氧化作用均对ARGs产生了较强的去除效果[13-18]。这表明氧化消毒技术可以有效去除并控制水环境中ARGs的传播。
水产养殖业中所用的氧化剂、消毒方法以及对水体环境的水质需求,都与污水处理行业存在巨大差异,目前有关渔用氧化剂与消毒方法对水环境中ARGs的作用效果少见报道。对此,基于水产养殖行业中氧化消毒技术的生产实践,本研究选用NaClO、二溴海因 (C5H6Br2N2O2) 和KMnO43种常用渔用氧化剂,探讨其对养殖水源水和池塘体水中常见的磺胺类抗性基因sul1的去除作用,探讨从源头上控制水产养殖环境中ARGs传播的可行性,为今后进一步建立养殖环境质量安全控制技术提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂和仪器 KMnO4,磷酸氢二钠(Na2HPO4)、磷酸二氢钠 (NaH2PO4)、氯化钠(NaCl)、硫代硫酸钠 (Na2S2O3)、浓硫酸 (H2SO4)、无水乙醇 (C2H6O)、异丙醇 (C3H8O)均为分析纯(AR),购自广州化学试剂厂。C5H6Br2N2O2(纯度≥98%) 购自麦克林 (上海)。NaClO储备液 (质量分数≥7.5%) 购自广州化学试剂厂,用于产生活性氯 (Free available chlorine, FAC)[14]。N,N'-二乙基-1,4-苯二胺硫酸盐 (C10H18N2O4S, ≥98%) 和 2,2'-联氨-双 (3-乙基苯并噻唑啉-6-磺酸) 二胺盐 (C18H24N6O6S4,>98%) 购自梯希爱 (上海) 化成工业发展有限公司。TB Green Real Time qPCR Kit 购自日本TaKaRa公司。Power Soil Kit购自美国MOBIO公司,十六烷基三甲基溴化铵 (C19H42BrN, ≥99%) 购自阿拉丁。实验用水均为屈臣氏蒸馏水。实验主要使用仪器为LightCycler 480实时荧光定量PCR仪 (Roche,瑞士)和紫外分光光度计(AOE instrument,上海)。
1.1.2 养殖水源水和池塘养殖水准备 本实验所使用的养殖水源水和池塘养殖水体,均采自广东冠利海洋生物有限责任公司的集约化养殖基地。对采水器具进行提前消毒并用水源水或池塘水清洗3次,从水源和对虾养殖池塘选3个采水点,使用不锈钢采水器采集水样并分别混合到一起,装入聚乙烯塑料桶中。用塑料瓶 (1 L) 收集采集到的水样用于测定水质 (全程低温放置至实验室)。水源水和池塘水的pH值均为6.6,其氨氮亚硝酸盐氮和总有机碳 (TOC) 质量浓度见表1。
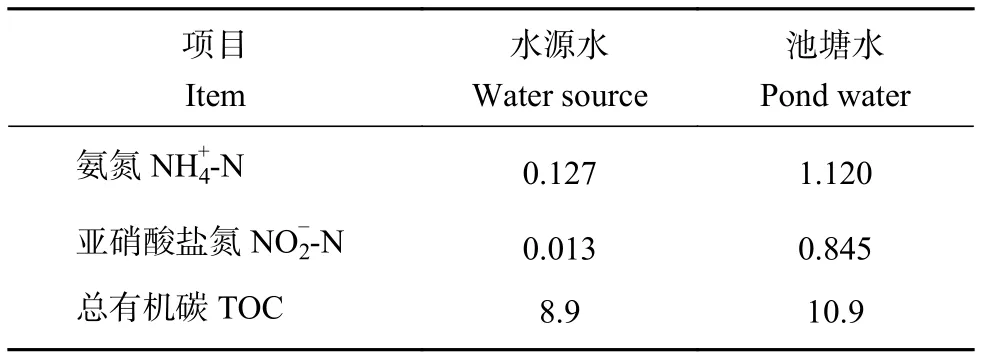
表1 水源水和池塘水中氨氮、亚硝酸盐氮和总有机碳质量浓度Table 1 Concentrations of NH4+ -N, NO2− -N and TOC in water source and pond water mg·L−1
1.2 实验方法
1.2.1 氧化剂浓度的测定 根据养殖生产中所使用渔用氧化剂的实际浓度范围,将其使用质量浓度设为15 mg·L−1。实验前对所用KMnO4储备液(5 g·L−1)、C5H6Br2N2O2储备液 (0.2 g·L−1)和 NaClO储备液 (质量分数≥7.5%) 进行有效浓度测定。其中,以ABTS分光光度法测定KMnO4浓度[19]和有效溴浓度[20],以DPD分光光度法测定有效氯浓度[21]。
1.2.2 实验分组与样品采集 分别按养殖水源水和池塘水设置NaClO组、C5H6Br2N2O2组、KMnO4组和对照组,每组3个平行。对照组和实验组分别为未添加任何氧化剂和添加相应氧化剂的养殖水源水和池塘养殖水体。将测试的养殖水源水和池塘水分别注入灭菌的200 mL带盖圆口瓶中,采集实验组和对照组中的样品用于检测各组中的初始eARGs和iARGs。随后加入相应的氧化剂并缓慢搅拌使其达到设定的初始浓度。实验体系设为50 mL,环境温度为25 ℃,样品瓶置于暗处反应2 h。取样时间设为第5、第10、第30、第80和第120分钟,测定各样品瓶水体中的残留氧化剂浓度,氧化剂作用效果以常用于消毒工程中的单位浓时积 (Cumulative integrated exposures, CT values) 表示[14]。反应 2 h后,即时在水样中加入大于氧化剂20倍摩尔浓度的 Na2S2O3溶液 (60 mmol·L−1) 中止反应,并将水样以0.22 μm孔径滤膜过滤。所得滤膜与水样置于−20 ℃保存,分别用于iARGs和eARGs检测。
1.2.3 ARGs的检测 以qPCR技术测定各样品中ARGs的拷贝数,定量监测sul1在渔用氧化剂作用下的含量变化。其中,用Power Soil Kit提取滤膜中的总DNA作为iARGs样品。用CTAB法提取水样中的总DNA作为eARGs样品[22]。
所有样品的qPCR检测参考SYBR Green Real Time qPCR试剂盒、LightCycler 480荧光定量PCR仪的产品使用方法。本研究检测的ARG为磺胺类抗性基因sul1,将克隆有目标抗性基因的大肠杆菌(Escherichia coli) 标准菌株SR1在微生物培养箱(37 ℃) 中培养20 h,用天根质粒提取试剂盒 (上海) 提取标准质粒并用NanoDrop2000测定提取质粒的浓度以及纯度。参照Wang等[8]的方法绘制标准曲线以及确定qPCR的反应体系。目的基因的引物序列以及退火温度见表2。反应结束后,查看熔解曲线以确定检测的为目标基因,查看扩增曲线的反应效率,获得目标基因拷贝数,并换算为所测样品中目标基因的绝对浓度(拷贝·mL−1)。

表2 qPCR所需引物Table 2 Primers used for quantitative PCR
1.3 数据分析
浓时积和对数去除值的计算公式为[17]:浓时积(mg·L−1·min) =氧化剂质量浓度 (mg·L−1)×反应时间(min);对数去除值 (拷贝·mL−1) =log(C0·C−1)。其中,C0为反应开始时ARGs的浓度,C为反应结束时的浓度。
以Excel 2010软件绘制图表。图中数据结果以“平均值±标准差 (±SD)”表示,采用SPSS 22.0软件以独立样本t检验方法对数据进行统计分析,显著性水平设为P<0.05。
2 结果
2.1 3种渔用氧化剂对ARGs的去除效果
sul1在水源水和池塘水中检出量均较高。水源水中细胞内sul1 (i-sul1) 浓度和细胞外sul1 (e-sul1)浓度分别约为 2.67×105和 1.15×105拷贝·mL−1。渔用氧化剂作用2 h后,水源水中的i-sul1和e-sul1均有不同程度的去除。其中i-sul1的去除效果为NaClO 组 (1.2 log,P<0.05) >C5H6Br2N2O2组 (0.4 log,P<0.05) >KMnO4组 (0.2 log,P=0.184) (图1-a)。e-sul1的去除效果为NaClO组 (1.4 log,P<0.01)=C5H6Br2N2O2组 (1.4 log,P<0.01) >KMnO4组(1.3 log,P<0.01) (图1-b)。
池塘水中细胞内i-sul1和e-sul1浓度分别约为3.57×106和 7.88×104拷贝·mL−1。渔用氧化剂作用2 h后,池塘水中的i-sul1和e-sul1均有不同程度的去除。其中,仅NaClO组表现出对池塘水中isul1的去除能力,对应的对数去除值为1.3 log(P<0.01,图2-a)。e-sul1的去除效果为KMnO4组(1.2 log,P<0.01) >NaClO组 (0.5 log,P=0.065) >C5H6Br2N2O2组 (0.1 log,P=0.751,图2-b)。
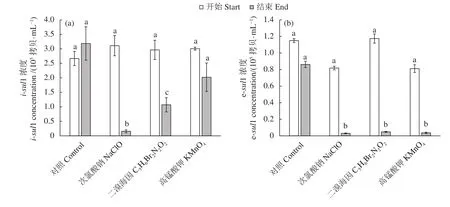
图1 消毒前后水源水中i-sul1 (a) 和e-sul1 (b) 浓度的变化同一图中标有不同字母代表有显著差异 (P<0.05);图2同此Figure 1 Change in concentrations of i-sul1 (a) and e-sul1 (b) in water source before and after disinfectionDifferent letters in the same figure indicate significant difference (P<0.05).The same case in Figure 2.

图2 消毒前后池塘水中i-sul1 (a) 和e-sul1 (b) 浓度的变化Figure 2 Change in concentrations of i-sul1 (a) and e-sul1 (b) in pond water before and after disinfection
2.2 渔用氧化剂在养殖水源水和池塘水中的浓度变化
在水源水和池塘水中,活性氯的质量浓度在初始阶段变化最快。反应5 min时,活性氯在水源水和池塘水中的质量浓度分别降低了72%和66%(图3-a);2 h后活性氯浓度仅为其初始浓度的12%(1.8 mg·L−1,水源水) 和 3% (0.4 mg·L−1,池塘水)。过程中活性氯在水源水中所达到的最高CT值(215.3 mg·L−1·min) 为池塘水中相应值 (75.2 mg·L−1·min)的 2.86 倍 (图3-b)。

图3 消毒过程中活性氯质量浓度 (a) 及其所达到的浓时积 (b) 的变化Figure 3 Change in concentration of FAC (a) and reached CT value (b) during disinfection
KMnO4的质量浓度在初始阶段变化最快。反应5 min时,KMnO4在水源水和池塘水中的质量浓度分别降低了 18% (2.3 mg·L−1) 和 30% (4.5 mg·L−1,图4-a);2 h后KMnO4质量浓度为其初始浓度的61% (9.1 mg·L−1,水源水) 和 46% (6.9 mg·L−1,水源水)。相较于活性氯,KMnO4在养殖水体系中均能保持较高浓度,且其在水源水中所能达到的最高 CT 值 (1 095.9 mg·L−1·min) 为池塘水中相应值(825.2 mg·L−1·min) 的 1.33 倍 (图4-b)。

图4 消毒过程中高锰酸钾质量浓度 (a) 及其所达到的浓时积 (b) 的变化Figure 4 Change in concentration of KMnO4 (a) and reached CT value (b) during disinfection
3 讨论
3.1 渔用氧化剂对iARGs和eARGs的去除效果
氧化剂被广泛用于杀菌消毒和改善水质,在水产养殖中发挥着重要作用。本研究选用3种常用的渔用氧化剂NaClO、C5H6Br2N2O2和KMnO4,研究了其在养殖相关水环境中对ARGs (iARGs和eARGs) 的去除作用。结果显示,水源水和池塘水中i-sul1浓度远高于e-sul1 (P<0.01),说明养殖相关的水环境中,i-sul1是水环境中sul1的主要存在形式,抗性菌是sul1在水环境中传播的主要介质,这与Mao等[24]报道的多种自然水体环境中iARGs浓度远高于eARGs浓度的结果一致,可见,尽管eARGs不容忽视,但养殖水环境中ARGs的去除主要取决于iARGs的去除。Jeon等[25]研究表明池塘养殖环境中的和有机质等还原性物质均会与次氯酸和次溴酸反应生成氯胺(NH2Cl)、溴胺 (NH2Br) 及有机氯 (溴) 化物,且其过程的反应速率 (高水平) 快于DNA与氧化剂的反应速率 (中等水平),从而对所添加的氧化剂造成消耗,高锰酸钾也会与无机氮和醇、醛、酯、酸等多种有机物反应且被广泛用于水环境中污染物的去除[26]。有研究报道,污水体系中上述还原性物质含量显著影响ARGs的氧化去除效率[17]。表1显示池塘水中还原性物质浓度高于水源水,表明池塘水还原性强于水源水。此外,化学需氧量 (COD) 是衡量水环境还原性强弱的重要指标,是特定条件下水环境中还原性物质的需氧量。COD可由水环境中KMnO4的消耗量换算为O2的消耗量得出,此情况下其被称为KMnO4指数。在本研究的养殖水体系中,水源水中KMnO4消耗量 (5.9 mg·L−1)低于池塘水 (8.1 mg·L−1),这间接反映了COD的高低,从而也表明池塘水还原性强于水源水。
标准电极电势数据 (25 ℃) 表明:Mn7+/Mn4+(1.68 V) > Cl+/Cl−(1.48 V) > Br+/Br−(1.33 V),故本研究所选3种氧化剂中,次氯酸的氧化性强于次溴酸,且Mn7+氧化能力最强。水源水和池塘水中,NaClO对i-sul1的去除效果强于C5H6Br2N2O2和KMnO4[水源水 (1.2 log>0.4 log>0.2 log) 和池塘水(1.3 log>0 log)],i-sul1位于抗性菌内,因此渔用氧化剂必须首先作用于细胞且进入细胞内才可与其反应。活性氯与细胞结构中的多种物质都有较强的反应活性,同时它还可以穿透细胞膜进入细胞,而不会造成显著的细胞膜损伤[27],这保证了其对iARGs的去除效果。C5H6Br2N2O2的主要活性成分为次溴酸,其与NaClO同属卤素类消毒剂,虽性质相似,但次溴酸氧化能力弱于次氯酸,这可能是本研究中其对ARGs的去除能力低于NaClO的原因。虽然Mn7+/Mn4+氧化还原电势最高,但其氧化性在酸性条件下较强且受体系pH影响最大 (由能斯特方程得出)。本研究中氧化作用在接近于中性的体系中进行 (所选水源水和池塘水的pH均为6.6),这解释了本研究中KMnO4对i-sul1的去除效果最弱的原因,说明其在养殖水体系中对细胞内抗性基因的氧化能力较弱。
在水源水中,渔用氧化剂NaClO、C5H6Br2N2O2和KMnO4均对e-sul1有较强的去除效果 (1.4 log、1.4 log和1.3 log);在池塘水中,NaClO和C5H6Br2N2O2对e-sul1的去除效果相对较弱 (分别为0.5 log和0.1 log),而KMnO4对e-sul1的去除效果为1.2 log,显著强于另外两种渔用氧化剂 (P<0.05)。这表明池塘水中还原性较强的特点并未影响KMnO4对eARGs的去除效果,却显著减弱了NaClO和C5H6Br2N2O2对eARGs的去除效果。在水产养殖中,KMnO4不仅可以灭活微生物,还有促进絮凝、改善水质的作用[12],这是因为KMnO4氧化还原性物质的过程会生成促凝剂,其主要包括二氧化锰 (MnO2) 或水合氧化锰等一些锰氧化物[28],这些促凝剂会增强KMnO4对污染物的去除作用。有研究报道,KMnO4在中性条件下会生成溶解性较低且吸附作用强的水合MnO2胶体,使得该条件下水环境中有机污染物的去除效果超过50%,明显优于酸性或碱性条件下的相应效果[26]。Zhang等[15]的研究也表明KMnO4单独作用对ARGs无去除效果,而锰氧化物的絮凝作用和KMnO4的氧化作用相结合时,却表现出较强的ARGs去除效果 (0.6~4.23 log)。故本研究所选养殖水中还原性物质含量较高的特点有利于KMnO4对ARGs的去除,这可能是KMnO4在还原性较强的池塘水中仍能有效去除e-sul1的原因,也是与NaClO和C5H6Br2N2O2相比,KMnO4去除eARGs过程的特点。然而本研究的KMnO4组中,i-sul1的去除效果弱于e-sul1,这也与Zhang等[15]的结论一致,这可能与细胞结构对iARGs的保护作用有关,其机理有待进一步研究。
3.2 消毒过程中渔用氧化剂浓时积的变化
从消毒剂浓度变化的角度看,反应2 h后池塘水中活性氯质量浓度仅为0.4 mg·L−1,而水源水中则为1.8 mg·L−1,说明活性氯在池塘水中的消耗大于其在水源水中的消耗,这可能与池塘水还原性较强有关 (表2)。活性氯在还原性较弱的水源水中所达到的最高浓时积约为池塘水中相应值的2.86倍(P<0.05),说明其浓时积受水环境还原性影响显著。水处理工艺中常规氯化作用浓时积范围为10~100 mg·L−1·min (25 ℃)[13],而水产养殖研究领域暂未见关于消毒过程中浓时积的相关报道,本研究中初始质量浓度为15 mg·L−1的活性氯在水源水和池塘水中达到的浓时积范围远高于污水处理 (75.2~215.3 mg·L−1·min)。有研究显示,在还原性弱的中性磷酸盐缓冲液体系中,上述浓时积范围内的氯化作用对ARGs去除效果可达到4 log[17-18]。而还原性强的污水体系中ARGs的去除效果相对较低,15 mg·L−1活性氯对城市污水体系中e-amp和iamp的去除效果为 1~1.5 log,且 12.5 mg·L−1以上的活性氯才对eARGs和iARGs均有去除效果[17];15 mg·L−1活性氯对另一污水体系中i-sul1的去除效果仅为0.19~0.27 log,所对应的CT值却高达450 mg·L−1·min[29]。以上研究表明,不同的水介质由于还原性不同,氧化作用对ARGs的去除效果及其对应的浓时积也不同。本研究中NaClO在水产养殖相关的水环境中也可去除eARGs (0.5~1.4 log)和iARGs (1.2~1.3 log),其效果与对应的CT值可为实际养殖中的消毒过程提供参考。
养殖水中C5H6Br2N2O2的浓度未被检出,但其仅在还原性较弱的水源水中表现出较强的ARGs去除效果 (0.4~1.4 log),表明其可能在还原性强的池塘水中被迅速消耗。尽管有研究报道10 mg·L−1的C5H6Br2N2O2可有效灭活养殖水环境中的细菌和弧菌[30],但本研究表明 15 mg·L−1的 C5H6Br2N2O2对池塘水中ARGs的去除能力有限。与NaClO组一致,KMnO4在两种体系中的浓时积值差异显著(P<0.05),但均持续升高,最高值仅相差1.33倍(差异小于NaClO组对应的2.86倍),这与Fan等[31]的研究结果一致,说明其氧化性受还原性物质的影响小于NaClO,其氧化持久性的特点有利于其对养殖水中的eARGs表现出更强的去除作用。
此外,反应第2小时氧化剂的浓度已趋于稳定,按照其此时的消耗量,水源水和池塘水中所需的活性氯质量浓度需分别高于13.2和14.6 mg·L−1,所需的KMnO4质量浓度需分别高于5.9和8.1 mg·L−1。这有助于氧化剂游离活性成分的产生 (如发生折点氯化作用),从而实现更好的ARGs氧化去除效果。从该角度看,对于所选质量浓度15 mg·L−1,两种体系中NaClO的剂量适中,而KMnO4剂量则相对过高。结合本研究中氧化剂去除ARGs效果,养殖清塘中可使用价格较低、效果较好的含氯氧化剂去除ARGs,但本研究表明其浓时积受水体还原性影响较大 (相差2.86倍),在池塘水中需要过量使用以达到持久氧化的效果。KMnO4在清塘环节可以持久、有效地去除eARGs,从而切断其水平传播途径,且KMnO4浓时积受水体还原性影响较小 (相差1.33倍),无需过量使用。
3.3 影响养殖水环境中ARGs去除的因素
首先,本研究所用氧化剂的质量浓度均为15 mg·L−1,通常的水产养殖过程中,在苗种放养前的清塘消毒环节会使用到如此高浓度的氧化剂,即利用渔用氧化剂去除养殖水环境中的ARGs可以在清塘环节实现,且选择含氯氧化剂效果更佳[32]。此外,本研究表明NaClO和C5H6Br2N2O2在水源水环境中可有效去除iARGs (0.4~1.2 log) 和eARGs(1.4 log),即养殖前使用高浓度卤族氧化剂对水源水进行消毒可实现从水源途径控制ARGs的传播。而在池塘水环境中,NaClO对iARGs和eARGs的去除效果均较好,故而应被选用。其次,本研究表明水源水和池塘水体系还原性的不同影响了ARGs的去除效果,强还原性减弱了NaClO和C5H6Br2N2O2对eARGs的去除效果,但有利于KMnO4去除eARGs。所以,在考虑ARGs的去除时,计算氧化剂实际用量时应将环境中还原性物质的影响考虑在内。使用含氯氧化剂前,可以采取一些措施 (如预氧化、增氧和曝气等) 尽可能降低养殖水中的还原性,使得ARGs的去除效果更佳,另外还可以结合KMnO4的持久氧化作用更好地去除eARGs。再者,本研究表明iARGs为ARGs的主要存在形式,因此应将iARGs的去除作为控制ARGs在养殖水环境中传播的重要因素。
水产养殖池塘是一个复杂的生态系统,其水质和底质的环境状况和生物群落组成等因素有可能影响氧化剂去除ARGs的效果,ARGs在不同环境条件下的响应机制有待进一步研究。

