胰淀素在神经系统和认知功能中的作用
张雨潇,严鸿飞,严 超,季卫东,刘 帅,3
(1.上海市脑功能基因组学重点实验室(教育部)华东师范大学附属精神卫生中心心理与认知科学学院 华东师范大学, 上海 200062 2.上海市长宁区精神卫生中心,上海 200335;3.纽约大学-华东师范大学脑与认知科学联合研究中心(上海纽约大学),上海 200062)
参与中枢调控的重要外周信号包括瘦素、胰岛素、胰淀素等[1-2]。其中胰淀素对摄食行为和认知功能的重要影响正越来越受到关注。胰淀素是随胰岛素一起分泌的一种肽类,类似于胰岛素,能降低血糖浓度并作为饱腹信号,其受体在外周和中枢神经都有广泛表达[3-4]。不少研究发现胰淀素与情绪以及阿尔兹海默症(Alzheimer’s disease, AD)之间存在一定联系[5-7],因此认为胰淀素是调控摄食、能量平衡与认知功能的关键因素之一,同时胰淀素受体也可以作为认知障碍治疗上的一个重要潜在靶点。本文从胰淀素受体表达、信号通路及对神经元和认知功能调控等方面,总结目前研究中胰淀素在认知功能重要脑区中的作用机制,并进一步探讨胰淀素在辅助治疗认知功能障碍上的治疗前景。
1 胰淀素受体在中枢神经中的表达
胰淀素可以透过血脑屏障激活中枢神经中的胰淀素受体[3-4,8-9],其作为G蛋白偶联受体(G-protein coupled receptor, GPCR)家族成员,通过G蛋白(Gs和Gq)激活下游信号通路。胰淀素受体由降钙素受体(calcitonin receptor, CTR)和修饰蛋白(receptor activity-modifying proteins, RAMPs)共同表达构成,RAMP可以改变CTR与胰淀素类似物的结合力。如果缺少修饰蛋白RAMPs,内源性的胰淀素就不能产生相应的生理作用[4]。
脑干是维持生命活动的重要中枢,其中包括延髓后区(area postrema, AP)、VTA、中缝背核(dorsal raphe, DR)、蓝斑(locus coeruleus, LC)等重要核团,这些核团同时是合成和释放儿茶酚胺神经递质的主要来源,对大脑各个区域有着较为广泛的投射,从而调控神经活动以及行为和认知。通过放射性显影术,Paxinos等[3,9]发现脑干中DR、穹隆下器官(sub fornical organ, SFO)、LC、AP等核团有高密度的胰淀素或鲑鱼降钙素(salmon calcitonin, sCT)结合,孤束核(nucleus of the solitary tract, NTS)、PBN等有中等密度的胰淀素或sCT结合。这表明脑干中大量神经元表达了胰淀素受体或降钙素受体。血清中胰淀素可以通过血脑屏障,因此当血清中胰淀素含量发生变化时,可以影响脑干神经元的活动,从而调控大脑儿茶酚胺的浓度以及其下游投射来调控认知功能。
边缘系统掌控感知觉信息、情绪以及学习和记忆,这些都是重要的认知功能。在边缘系统的核团中,NAc、下丘脑部分核团、CeA等在放射性显影实验中有大量的sCT结合[3,9],培养的海马神经元的神经再生在孵育胰淀素的情况下则会被抑制[10]。因此胰淀素或其类似物可以直接作用边缘系统来调控认知功能。
前额皮层(prefrontal cortex, PFC)是调控执行功能的重要结构[11]。放射性显影技术没有在大鼠PFC区域发现胰淀素的结合[9],但是在猴子PFC中发现一定程度sCT的结合[3]。这说明胰淀素自身不一定能影响PFC的活动,需要结合力更强的胰淀素类似物如sCT来激活PFC的胰淀素受体。Nashawi等[12]则通过qPCR发现RAMP1,2,3以及CTRa在PFC中有一定程度的表达。结合以上研究,说明内源性胰淀素可能难以直接作用到PFC神经元,但是高结合力的外源性胰淀素类似物可以通过作用PFC神经元调控认知功能。
2 胰淀素对神经元功能的调控
胰淀素对神经元的调控通过G蛋白偶联受体进行信号的转导[2,4](图1)。Gq和Gs可以激活膜上部分钙离子通道从而提高神经元的兴奋性,此外Gq和Gs也可以通过激活蛋白激酶A(protein kinase A, PKA)或蛋白激酶C(protein kinase C, PKC)来介导细胞外调节蛋白激酶(extracellular-signal-regulated-kinase, ERK)通路。在下丘脑部分核团、NTS、AP核团中,免疫组织化学(immunohistochemistry, IHC)以及蛋白免疫印迹(western blotting, WB)的研究发现胰淀素受体的激活都可以利用MAPK/ERK信号通路,ERK通路在AP核团介导的抑制摄食行为中又起到了必要的作用[13-14]。因此胰淀素信号可以是通过ERK通路改变神经元活动。在培养的HEK293细胞上,抑制ERK通路可以提高GABAAR的电流峰值,揭示ERK通路可以负面调控GABAAR受体,同时这种负面调控可能通过α亚基磷酸化实现降低GABAAR受体的功能[15]。因此ERK通路的激活可以通过降低抑制性输入使细胞去极化。在离体海马细胞中,ERK通路则能下调Kv4.2钾离子通道[16],通过减少钾离子外流使细胞去极化。在脑干中,胰淀素能强烈地激活AP神经元,通过增加突触前谷氨酸释放增加兴奋性传递,从而大幅提高AP神经元的放电频率[17]。在下丘脑外侧核(lateral hypothalamus, LH)中,相当数量的神经元表达了瘦素受体(ObRB),这些LH-ObRB神经元对摄食和体重的控制起到了重要作用,胰淀素则既能激活一部分下丘脑外侧核表达瘦素受体的(LH-ObRb)神经元,也能抑制部分LH-ObRb神经元[18]。由此可以看出不同脑区胰淀素对神经元可能产生不同的活动,甚至一部分受体通过突触前的改变影响神经元的活动,一部分受体通过突触后的作用改变神经元的放电。但是胰淀素对神经元活动的调控以及突触传统的变化是否依赖ERK通路尚未有直接证明。目前还需要通过更深入地研究来揭示从膜上蛋白到神经元去极化、超级化、放电频率以及可兴奋性变化的具体分子通路。
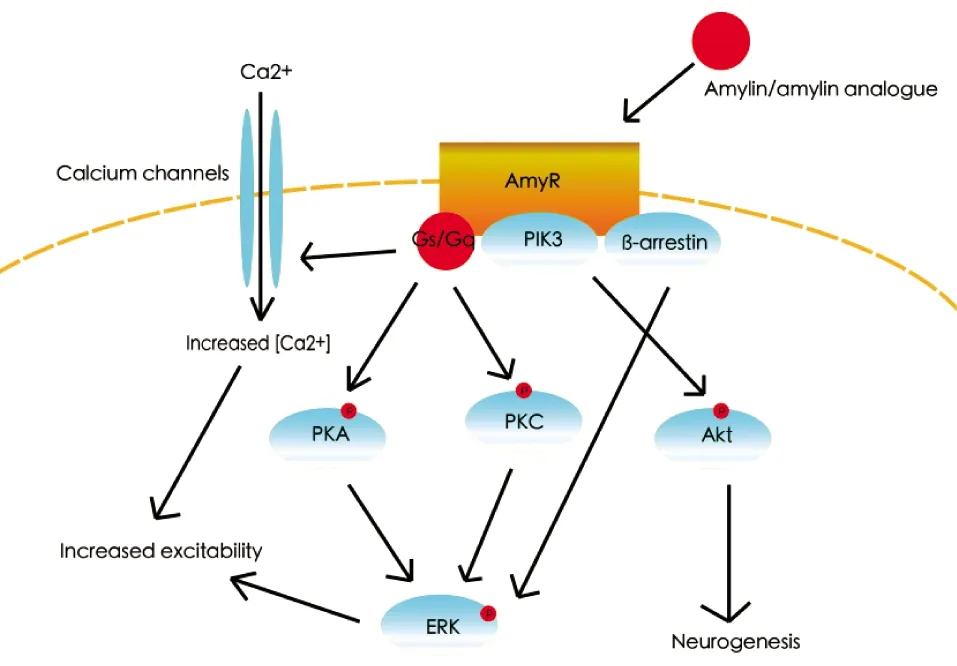
在一些神经上,胰淀素受体可以通过Gs或Gq激活膜上部分钙通道增加钙离子的流入从而提高神经元活动,同时能使PKA、PKC磷酸化从而激活ERK通路;胰淀素受体还能通过激活Akt增加神经元的再生;胰淀素受体也能利用β-arrestin介导的ERK通路。Amylin analogue:胰淀素类似物;Calcium channels:钙离子通道;PIK3:自噬信号通路;PKA/PKC:激酶蛋白A/C; ERK:胞外调节蛋白激酶;Neurogenesis:神经再生
除MAPK/ERK通路外,胰淀素也可以利用磷酸腺苷蛋白激酶(AMP-activated protein kinase, AMPK)、JAK/STAT信号通路以及蛋白激酶B(phosphatidylinositol 3′-kinase, PI3K/AKT)信号通路调控神经元的活动[19-20]。AMPK通路在细胞和全身层面都可以调控能量平衡[20],因此对葡萄糖敏感的神经元,在其胰淀素受体激活的情况下,可以通过AMPK通路改变神经元的活动。下丘脑核团中的ObRb神经元需要通过JAK/STAT通路调控摄食行为[21],胰淀素则可以类似瘦素激活下丘脑神经元的JAK/STAT通路,与瘦素协同调控摄食行为[22]。胰淀素和瘦素造成的LH-ObRb神经元活动的改变[18]可能也是通过JAK/STAT通路调控的。PI3K/Akt信号通路则与细胞生长与增殖有关[20],PI3K的磷酸化同时可以激活mTOR通路促进神经元树突的分叉化,从而形成新的突触连接[23]。因此胰淀素可以通过此通路增加神经元之间的突触连接的强度,或是产生新的突触连接,从而改变神经元的功能。类似ERK通路,胰淀素如何通过AMPK等通路影响神经元的活动亦缺乏直接的证明。这些通路对胰淀素受体是否能发挥全部作用的必要性也缺乏更深入的研究。
GPCR不只与G蛋白形成复合体,同时也与β-arrestin偶联,并可以通过β-arrestin激活下游信号通路[24-25],有研究也证实CGRP受体家族可以利用β-arrestin[26-27]。β-arrestin可以介导CGRP受体的失敏与内吞,其介导的ERK通路与焦虑和恐惧相关行为有关[28],多巴胺1型受体(D1R)与2型受体(D2R)偶联的β-arrestin则与阿片或精神药物导致的急性多动与位置偏好有关[29]。这些研究说明β-arrestin在认知功能上可能存在重要的调控作用,但CGRP受体或胰淀素受体偶联的β-arrestin的功能与神经机制尚不明确,需要更多的研究证实β-arrestin在胰淀素受体中发挥其正常功能的必要性。
3 胰淀素在行为和认知上的调控
中脑边缘奖赏系统主要包括VTA、NAc以及杏仁核,胰淀素受体在这些核团中都有广泛的表达[3,9,28-29]。VTA定位注射sCT可以在不产生焦虑样反应的情况下抑制摄食行为[28];NAc定位注射sCT则能抑制进食行为以及探索和运动的意愿[25]。VTA的多巴胺神经元对NAc有大量的投射,因此胰淀素能通过调控VTA到NAc投射的多巴胺影响动机和奖励。同时多巴胺在奖励以外的学习和记忆中也起到重要的作用,因此胰淀素可以通过调控大脑多巴胺水平间接调控认知功能。虽然没有直接证明胰淀素在杏仁核中作用或是胰淀素对杏仁核多巴胺投射作用的研究,但杏仁核作为处理情绪和恐惧感受的中心,在胰淀素的调控下,也可能产生情绪上的变动。在一些临床前期实验中,胰淀素受体激动剂确实也体现出了抗焦虑和抗抑郁的效果[7]。胰淀素受体可以作用在中脑边缘奖赏系统,通过调节多巴胺水平以及相关环路来调控奖赏、动机以及情绪,从而间接影响认知功能。
胰淀素受体也表达在其他儿茶酚胺能神经元上。去甲肾上腺素能神经元存在的相关脑区,包括NTS、AP以及LC,在放射性显影实验中都有大量的sCT结合[3,30]。通过靶向分子毒素DSAP特异性切除AP-NE神经元后,胰淀素引起AP核团的c-Fos表达显著降低[30],说明胰淀素在一定程度上能调控去甲肾上腺素(norepinephrine, NE)释放的水平,也可能包括NTS以及LC的NE释放。sCT也发现在5羟色胺(serotonin, 5-HT)能神经元DR核团中有大量的结合[3],而5-HT也是调控情绪和奖励系统的重要神经递质,在抑郁和精神分裂症病人中可以观察到5-HT水平的异常[31]。胰淀素受体在DR核团中的作用也值得更加深入的研究。所以,胰淀素受体可以通过调控脑内儿茶酚胺水平影响情绪奖赏相关的认知能力。
胰淀素在海马神经元的作用则较为复杂(图2)。Patrick等[32]发现人类胰淀素对培养的大鼠海马神经元存在类似β淀粉样蛋白的细胞毒性,同时外周注射胰淀素对弱记忆任务有促进作用,但对强记忆任务促进了遗忘,而中枢给予胰淀素则失去了对弱记忆任务的加强,对强记忆任务的负面影响仍然存在[33]。随后Moon等[10]发现合成人类胰淀素会下调培养的小鼠H19-7HN神经元的神经再生。这说明胰淀素对记忆可能存在负面作用。但有趣的是β淀粉样蛋白以及人类胰淀素确实可以与胰淀素受体结合并抑制海马神经元的长时程增强(long-term potentiation, LTP)[34-35],然而胰淀素的类似物——普兰林肽(pramlintide)可以拮抗这种抑制[35]。在一项针对长期居家老年人的研究中,血浆中胰淀素浓度与记忆、空间感知以及执行功能是正相关的[36],说明胰淀素对认知损伤是有保护性作用的。血浆胰淀素浓度的研究和孵育培养海马细胞研究的矛盾可能有两种原因:(1)来源于人类胰淀素更容易聚集,因此虽仍然能够与胰淀素受体结合,但无法激活下游通路,产生拮抗作用[5]。而胰淀素类似物或未聚集的胰淀素寡聚物可以与聚集的胰淀素或β淀粉样蛋白竞争与胰淀素受体结合并激活下游通路发挥正常的作用。此外,激活的通路除了可以通过Akt磷酸化促进海马神经元的生长,亦可能通过其他分子机制分离或降解聚集在海马区域的β淀粉样蛋白。动物研究也确实发现了pramlintide可以降低β淀粉样蛋白的聚集[5,31]。(2)可能是胰淀素受体需要在完整的体系统中才能正常发挥作用[5],因为人类胰淀素对海马神经元的负面作用大多集中在离体的培养细胞中[10,32]。总体来说,不少临床实验揭示了胰淀素在病理状态下对认知功能的保护作用,但具体的分子和神经机制尚需阐明。
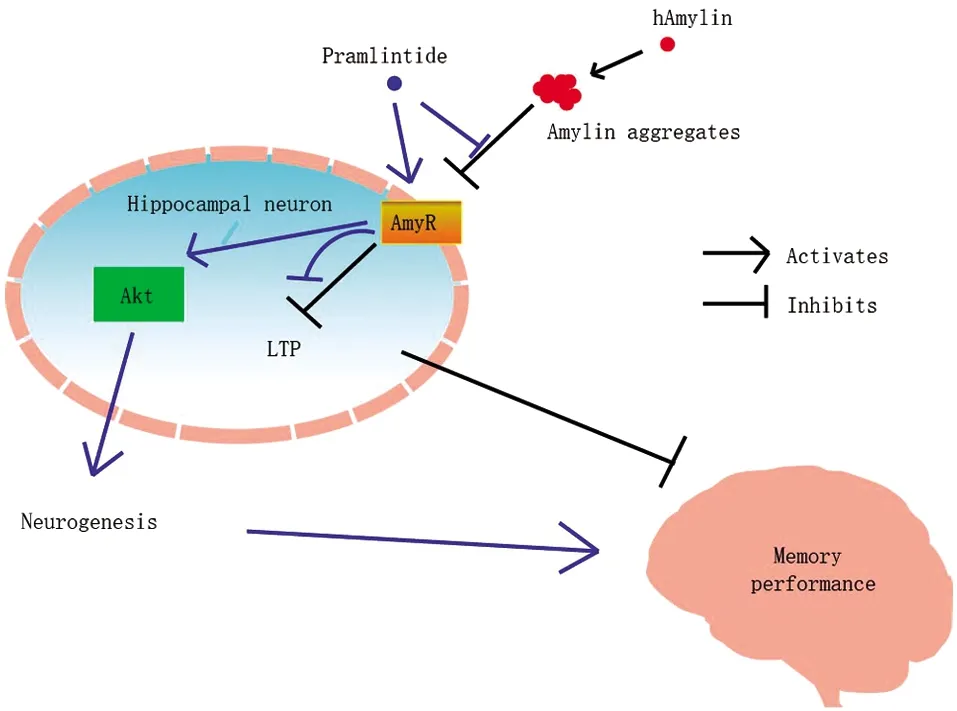
人类胰淀素有聚集的倾向,会形成胰淀素聚合物,成为胰淀素受体的拮抗剂,抑制海马神经元的LTP,削弱记忆表现。胰淀素类似物Pramlinide则可以与胰淀素聚合物竞争,激活胰淀素受体,通过Akt信号通路促进神经元的再生从而促进记忆表现。hAmylin:人类胰淀素;Amylin aggregates:胰淀素聚合物;AmyR:胰淀素受体;Hippocampal neuron:海马神经元;Akt:丝氨酸;LTP:长时程增强;Neurogenesis:神经再生;Activates:激活;Inhibits:抑制;Memory performance:记忆表现
PFC有一定量的CTR表达[12],目前尚未有研究探索胰淀素在PFC中对行为或认知功能的直接影响。但PFC作为高级皮层对执行能力的调控是不可或缺的。PFC的损伤和异常与多种认知疾病有密切关系,如注意缺陷与多动障碍(attention deficit and hyperactivity disorder, ADHD)、药物滥用与成瘾、精神分裂症等,这些疾病也常伴随执行和抑制功能的异常[37-38]。PFC作为中脑皮层边缘系统的一环,与VTA神经元存在相互支配。至少PFC能间接受到胰淀素在VTA中的影响导致多巴胺信号变化,从而调控执行和抑制能力。外周给予胰淀素受体激动剂能降低在多种酒精成瘾模型下酒精的摄入以及戒断反应[39],从侧面说明胰淀素在抑制能力上可能起到的促进作用。
4 胰淀素类似物在认知功能障碍治疗中的应用前景
临床上,胰淀素类似物pramlintide主要用于2型糖尿病、肥胖等代谢相关疾病中[4]。但在一些临床前期研究中发现胰淀素类似物可以缓解药物和酒精成瘾以及AD引起的认知功能下降[4,7,39-41]。
可卡因和酒精的急性注入都能引起自主活动的增加[42]。这种自主活动的增加可能与前额叶抑制能力的下降有关。而急性地系统性给予sCT能降低酒精和可卡因引起的NMRI小鼠自主活动的增加[39,43]。从侧面说明胰淀素类似物可以帮助恢复抑制能力。更直接的证据来源于Baisley等[44]的研究,NAc定位给予sCT能逆转急性给予甲基安非他命引起的前脉冲抑制(prepulse inhibition, PPI)能力的异常。PPI指强感觉刺激及短时间之前若存在一个弱感觉刺激,则这个强感觉刺激造成的惊愕反应会下降。PPI可以用来检测抑制功能并与注意力有密切关系[45]。结合以上研究,胰淀素类似物可以有效缓解一些药物或酒精滥用导致的急性认知功能的损伤。其作用靶点可能主要与NAc中多巴胺浓度有关[39,42-44]。PFC与抑制功能密切相关,其神经元也有大量胰淀素受体表达[11-12,37]。未来研究可以关注胰淀素对PFC神经元活动的调控以及对药物或酒精滥用引起的长期认知功能损伤的保护作用。
虽然胰淀素对海马神经元的作用和机制尚不完全明确(图2),但是Alder等[41]发现AD病人中,对比认知功能相对完好的个体,有中等程度的认知障碍的个体血清中胰淀素含量有显著的降低。该团队发现长期注射胰淀素类似物pramlintide可以恢复AD模型小鼠的新颖物体识别的认知能力。Zhu等[40]进一步探索了长期注射pramlintide或胰淀素对AD模型小鼠大脑中β淀粉样蛋白的影响,数据表明长期外周给予pramlintide将皮层、海马以及丘脑中一种与认知功能损伤相关的β淀粉样蛋白转移到脑脊液以及血清中,从而降低了大脑的β样淀粉蛋白的负担,同时提高了小鼠在Y迷宫、水迷宫中的行为表现,即恢复了AD小鼠的学习和记忆能力。此外Patrick等[6]发现pramlintide在APP/PS1转基因小鼠上能通过降低Aβ引起的氧化应激来提高小鼠的认知能力。虽然这些研究的结果与胰淀素对离体培养海马细胞的作用机制存在矛盾,但从行为学上可以看出,长期的胰淀素类似物的外周给予足以提高一部分AD模型小鼠的学习和记忆能力。这说明胰淀素类似物对AD导致的认知损伤的病情进展有可观的保护作用,也可以恢复AD导致的记忆功能上的损伤。虽然其保护作用的具体神经分子机制尚需更加深入的研究,胰淀素受体作为药物靶点,治疗包括AD在内的各种认知障碍具有非常好的应用前景。
5 结语
胰淀素在各个脑区中的作用正逐渐被揭示,先前大部分研究的重点是胰淀素对摄食和能量的调控。但这些相关的脑区核团很大程度上都参与了认知功能的调控(图3)。这些脑区中VTA、LC、AP、DR等核团涉及了3大儿茶酚胺系统,说明胰淀素可以调控大脑DA、NE以及5-HT的浓度水平,从而影响认知功能。胰淀素受体在海马中也有一定量的表达,并且对海马神经元有较为复杂的作用[6,10,34],说明胰淀素对学习和记忆存在直接的调控作用,部分临床和动物研究也发现胰淀素对记忆的影响[6,29]。PFC作为中脑皮层边缘奖赏环路的一员,受VTA的调控,同时对VTA也有传入的支配。PFC中也有一定量CTR的表达[12],但尚未有证据直接将PFC中CTR受体与行为或认知功能联系起来。但胰淀素对中脑皮层边缘奖赏系统的VTA和NAc核团都有直接的作用[28-29],说明胰淀素至少能间接地影响与PFC相关的执行和抑制能力。综上,胰淀素可能是连接摄食行为与认知功能的因素之一,同时在病理上可能与AD与2型糖尿病或肥胖的共病现象有密切关系。胰淀素对部分认知障碍或精神疾病可以起到保护作用,胰淀素受体在针对这些疾病的药物研发中是一个潜在重要靶点。
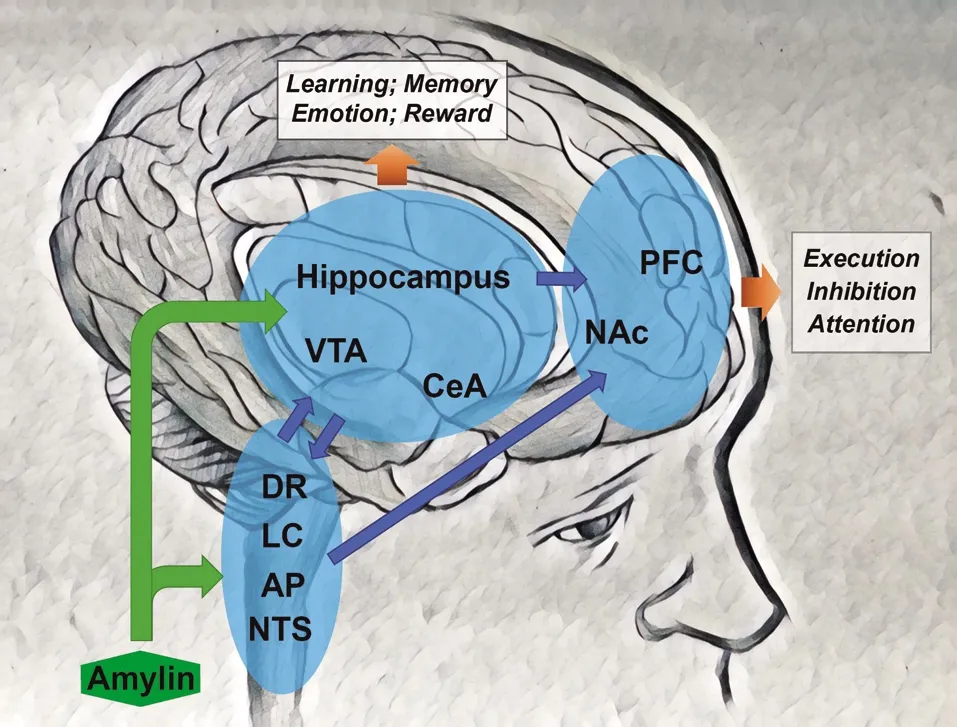
胰淀素可以作用在后脑与中脑的儿茶酚胺神经元调控儿茶酚胺浓度,从而间接作用在海马与前额叶皮层调控相应认知功能,亦可以直接激活海马与前额叶皮层的胰淀素受体直接调控这些脑区的神经元影响认知功能。Amylin:胰淀素;NTS:孤束核;AP:延髓后区;LC:蓝斑;DR:中缝背核;VTA:腹侧被盖区;Hippocampus:海马;CeA:中央杏仁核;NAc:伏隔核;PFC:前额皮层;Learning:学习;Memory:记忆;Emotion:情绪;Reward:奖赏;Execution:执行能力;Inhibition:抑制能力;Attention:注意力
致谢:感谢纽约大学-华东师范大学脑与认知科学联合研究中心(上海纽约大学)的支持。

