PD-1抑制剂联合SOX化疗方案在进展期胃食管结合部腺癌新辅助治疗中的疗效及安全性初探
尹玉平,张鹏,蔡明,陈俊华,李伟,李钢,王征,王国斌,陶凯雄
华中科技大学同济医学院附属协和医院胃肠外科,湖北 武汉 430022
近年来,我国胃食管结合部腺癌(adenocarcinoma of esophagogastric junction,AEG)的发病率逐年升高,根治性切除是传统意义上的主要治疗方案[1-2]。2006年MAGIC研究报道3周期的ECF方案新辅助化疗能够显著提高AEG的R0切除率及5年生存率,使得新辅助治疗在该部分肿瘤中的应用日益被重视,但因为东西方缺乏统一、有效且能耐受的治疗方案,其应用仍存在争议[3]。随着免疫治疗在肿瘤治疗中的快速进展,特别是在晚期胃癌及AEG治疗中取得了一定的效果,为免疫治疗联合传统化疗方案在进展期AEG新辅助治疗的应用奠定了基础[4-6]。本文报道了我院胃肠外科采用程序性死亡因子1(PD-1)抑制剂联合奥沙利铂+替吉奥化疗方案(SOX方案)在进展期AEG新辅助治疗中的疗效及安全性。
资料与方法
一、临床资料
收集2020年9月至2021年2月于华中科技大学同济医学院附属协和医院胃肠外科住院治疗的AEG病人的临床资料。病例入组标准:(1)年龄18~75岁;(2)经过胃镜及超声胃镜、组织学活检、胃三维增强CT等检查评估,确诊为进展期AEG(cT3~T4/N+M0);(3)无严重的血液系统、心肺肝肾功能异常和免疫缺陷;(4)体力状况美国东部肿瘤协作组(ECOG)评分0~1级。与病人及家属充分沟通后签署知情同意书,最终入组17例病人,本研究的开展符合《赫尔辛基宣言》中的相关伦理要求,获得我院医院伦理委员会批准,批件号:[2020]伦审字(0447)号,并在Clinicaltrial临床研究网站注册(NCT04890392)。
二、治疗流程
病人及家属签署知情同意书后行新辅助治疗,基础化疗方案为SOX方案:奥沙利铂(130 mg/m2,静脉滴注),替吉奥(口服,每天2次;体表面积<1.25 m2者40 mg/次,体表面积1.25~1.5 m2者50 mg/次,体表面积>1.5 m2者60 mg/次)。PD-1抑制剂:200 mg静脉滴注。共3~4周期新辅助治疗,在病人行第3周期新辅助治疗前,行超声胃镜及胃三维CT评估病人对该方案的反应性,若无疾病进展,病人在完成3周期的新辅助治疗后,休息3~4周,返院再次评估病情行腹腔镜下胃癌D2根治术,所有手术均由同一主刀医生完成。
三、疗效与安全性评价
(1)新辅助化疗加免疫治疗并发症:包括血液学相关并发症、免疫相关并发症、其他相关并发症等;(2)手术治疗:R0切除率,术后病理淋巴结阳性率,手术并发症(出血、吻合口漏、吻合口狭窄、胸腔及腹腔感染、血栓形成等);(3)疗效评价:主要指标为客观缓解率(ORR)、显著病理缓解(MPR:TRG1a/b,Becker标准)、病理完全缓解(pCR:TRG1a,Becker标准)[7]及新辅助化疗加免疫治疗的降期率,即比较新辅助治疗前cTNM分期和治疗后cTNM分期(AJCC第8版胃癌cTNM分期)[8]。病人治疗前后CT采用RECIST V1.1标准评估肿瘤反应。
四、统计学方法
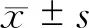
结 果
一、入组病人临床特征
入组病人总数为17例,其中男性14例(82.4%),女性3例(17.6%),平均年龄61岁(35~69岁),体质量指数(BMI)为(23.1±2.6) kg/m2。病理活检均为腺癌;术前临床分期,cT:T38例(47.1%),T49例(52.9%);cN:N110例(58.8%),N24例(23.5%),N33例(17.6%)。目前已完成手术病人8例。
二、新辅助治疗情况
1.新辅助治疗安全性评价 新辅助治疗过程中,3~4级不良反应主要为骨髓抑制及胸主动脉血栓形成。1例病人出现免疫相关性皮疹,5例病人在治疗过程中出现骨髓抑制,表现为白细胞减少及中性粒细胞减少,1例病人出现胸主动脉血栓形成。所有不良反应经过积极对症处理后均减轻或者消失,无新辅助治疗相关性死亡(表1)。
2.新辅助治疗疗效评价 17例病人中,8例病人已完成手术,其中7例病人行3周期新辅助治疗后行手术,1例病人行2周期新辅助治疗后疗效评估疾病进展,后行手术,术后病理为pCR。手术病人ORR为100%,MPR病人6例(75.0%),其中pCR病人2例(25.0%)。8例病人临床病理资料详见表1及图1。
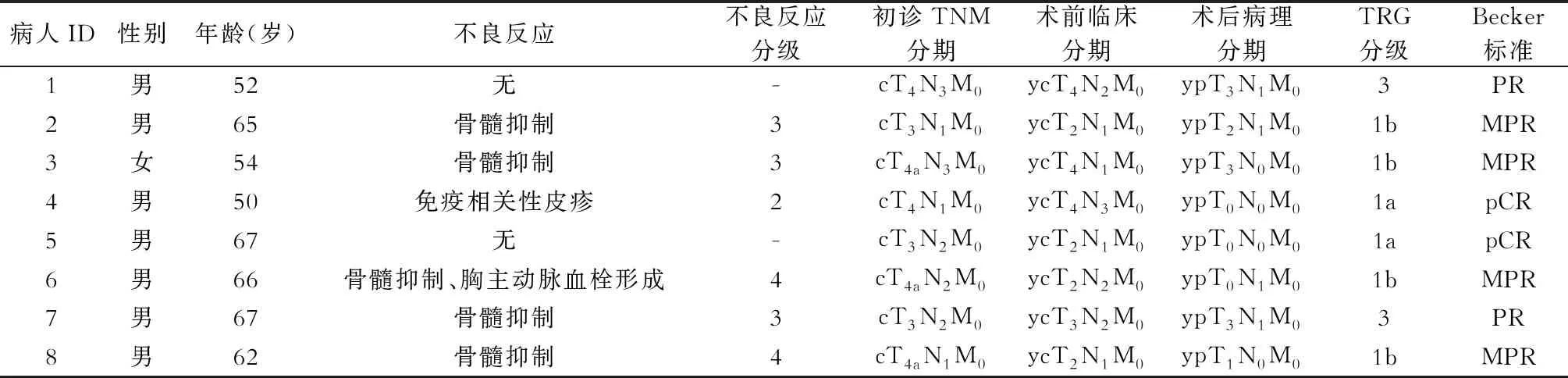
表1 已行手术8例病人临床病理资料
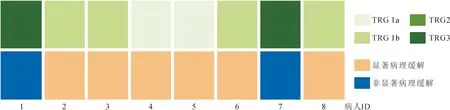
图1 手术病人新辅助治疗疗效评级
三、新辅助治疗对手术安全性的影响
8例手术病人新辅助治疗情况见前文所述。手术方式均为腹腔镜下胃癌D2根治术(全胃),手术时间为(215±14) min,术中出血量为(105±60) mL,其中1例病人术中损伤脾脏而出血,行脾脏切除术。病人术后住院时间为(9.2±2.3) d,无吻合口漏、术后出血等Clavien-Dindo分级Ⅲ级以上并发症,无围手术期死亡病例。
讨 论
研究表明在东亚及东南亚新发的AEG在全球占比高达59%,其生物学行为恶劣,术后复发率高,死亡率居高不下[9]。鉴于AEG的发病率上升,将其视为一种特殊类型肿瘤的呼声越来越大,在我国其治疗及相关研究越来越被重视。但目前单独针对AEG新辅助治疗的临床研究较少,多为与食管癌或者胃癌联合开展的相关研究。同时东西方对于AEG新辅助治疗的看法并不统一,美国国家综合癌症网络(NCCN)指南推荐局部进展期Siewert Ⅲ型的AEG应优先接受新辅助化疗后再行手术治疗及术后辅助治疗;欧洲肿瘤内科学会(ESMO)指南同样推荐了该方案,但为该推荐提供支撑的MAGIC研究及FNCLCC/FCD研究中胃癌D2根治术淋巴结清扫比例过低;日本胃癌规约对于AEG的新辅助放化疗并不做推荐[10-12]。
2013年12月份Science杂志将肿瘤免疫治疗列为十大科学突破之首,目前已有多种免疫检查点调节靶向药物被FDA批准用于黑色素瘤、非小细胞肺癌等肿瘤临床治疗,并取得了不俗的效果。KEYNOTE-012研究报道在程序性死亡因子配体1(PD-L1)阳性[联合阳性分数(CPS)评分≥1]的39例晚期胃癌及AEG病人经过PD-1抑制剂治疗后,22.2%的病人部分缓解(PR),13.9%的病人为稳定状态(SD),中位无进展生存期(PFS)与总体生存期(OS)为1.9个月和11.4个月[6]。然而,2020年KEYNOTE-062研究[13]的亚洲组分层分析数据显示:在亚洲人群中,对于PD-L1 CPS评分≥1或者≥10的晚期胃癌及AEG病人中,免疫治疗组中位OS均显著长于化疗组(XELOX)[风险比(HR): CPS≥1者为0.54;CPS≥10者为0.43],1年OS率(CPS≥1, 69%比54%;CPS≥10, 81%比68%),2年OS率(CPS≥1, 45%比23%;CPS≥10, 54%比27%)。同时2020年CheckMate 649研究报道,对比单独化疗组(XELOX或FOLFOX),PD-1抑制剂联合化疗能够显著降低PD-L1 CPS评分>5的晚期不可切除胃癌及AEG病人的死亡风险,并延长OS[13.8个月比11.6个月,HR=0.80,95%CI(0.68,0.94),P=0.000 2][14],为PD-1抑制剂在亚洲晚期胃癌及AEG的临床应用奠定了基础。但一项研究表明,在胃癌组织中PD-L1的阳性率较黑色素瘤、非小细胞肺癌等肿瘤低,同时肿瘤突变负荷(TMB)及微卫星不稳定性(MSI)这些目前认为能够预测免疫治疗疗效的指标在胃癌中同样较低,极大地限制了免疫治疗在胃癌中的应用[15]。
进一步研究发现,DNA损伤修复网络异常与免疫治疗在恶性肿瘤中的治疗效果相关,并且PD-L1的表达水平并不是预测免疫检查点调节靶向治疗的唯一疗效预测指标,靶向DNA损伤修复多个关键分子能够激活肿瘤细胞固有免疫反应,进而增强免疫检查点抑制剂的抗肿瘤效果[16-18]。同时数个临床研究表明,通过放疗或药物诱导DNA损伤继而提高免疫治疗在肺癌、食管癌等肿瘤中的抗肿瘤效果,这一系列发现为AEG放化疗联合免疫治疗提供了坚实的理论基础[19-20]。在本项研究中,我们发现PD-1抑制剂联合SOX化疗方案在AEG新辅助治疗中取得了较好的效果,6例病人术后病理为MPR,其中2例病人为pCR,8例病人均为R0切除,并且该方案的不良反应较小,病人均能耐受,是AEG潜在可行的新辅助治疗方案。
但本研究仍存在一些不足:第一,整体样本量偏少,并且其中部分病人在本文投稿时尚处于新辅助治疗阶段,缺乏完整数据;第二,虽然有文献表明MPR率与肿瘤病人的预后呈正相关,但本项目目前尚无病人相关生存数据,仍需进一步的随访追踪。同时在本临床试验进行的过程中也发现了一些值得探讨的问题:有1例病人在完成2周期的新辅助治疗后胃三维增强CT及PET-CT均提示疾病进展,行腹腔镜下腹腔探查未发现明显病灶,遂行腹腔镜下胃癌D2根治术,术后病理提示为pCR,这一病例提示在部分病人中,免疫治疗的疗效评估可能与传统化疗方案不同,需要后续进行进一步的研究讨论。总之,本研究为AEG新辅助治疗及免疫治疗提供了新的初步依据,为提高AEG病人的预后提供了新的希望。

