粉红螺旋聚孢霉高效生防菌株的筛选与评价
吴海霞 袁梦蕾 江娜 马桂珍 孙漫红 李世东

摘要 :粉红螺旋聚孢霉Clonostachys rosea是一种重要的植物病原生防真菌。本研究测定了不同地理来源的42株粉红螺旋聚孢霉菌株对核盘菌Sclerotinia sclerotiorum菌核的寄生能力,以及菌株几丁质酶和β-1,3-葡聚糖酶的活性,同时测定了不同菌株对番茄灰霉病菌Botrytis cinerea的拮抗作用以及对番茄果实灰霉病的防治效果。结果表明,不同来源的粉红螺旋聚孢霉菌株对核盘菌菌核均有一定的寄生能力,45.2%的菌株寄生能力达到4级,β-1,3-葡聚糖酶和几丁质酶活性与其寄生能力呈极显著正相关。研究发现,粉红螺旋聚孢霉菌株对番茄灰霉病菌有一定的拮抗作用,抑制率最高可达78.4%;HN-56、STG-21-1、GS6-1等菌株对离体番茄果实灰霉病的防效达到75%以上,显示出良好的生防潜力。本研究为丰富植物真菌病害生防资源和高效粉红螺旋聚孢霉生防制剂的研发奠定了基础。
关键词 :粉红螺旋聚孢霉; 菌寄生; 细胞壁降解酶; 核盘菌; 番茄灰霉病
中图分类号:
S 432.44
文献标识码: A
DOI: 10.16688/j.zwbh.2020120
Screening and evaluation of highly efficient biocontrol
strains of Clonostachys rosea
WU Haixia1,2, YUAN Menglei2, JIANG Na2, MA Guizhen1*, SUN Manhong2*, LI Shidong2
(1. School of Marine Science and Technology, Jiangsu Ocean University, Lianyungang 222005, China;
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Clonostachys rosea is an important biocontrol fungus of plant diseases. In this study, 42 C.rosea strains derived from different areas were chosen and their mycoparasitic ability against Sclerotinia sclerotiorum sclerotia, enzyme activities of chitinase and β-1,3-glucanase and control effects on tomato gray mold caused by Botrytis cinerea were investigated. The results indicated that all the isolates tested could parasitize the sclerotia, in which 45.2% reached the highest level of grade four. The enzyme activities of chitinase and β-1,3-glucanase had significant positive correlations with fungal mycoparasitic ability. The maximum of inhibition rates of C.rosea against B.cinerea was 78.4%, and the control efficacies of strain HN-56, STG-21-1 and GS6-1 against gray mold of tomato fruits in vitro achieved more than 75%. This study provides new resources of biocontrol agents against plant fungal diseases and lays a foundation for the development of biocontrol agents of C.rosea.
Key words
Clonostachys rosea; mycoparasitism; cell wall degrading enzyme; Sclerotinia sclerotiorum; Botrytis cinerea
我國是一个农业生产大国,长期以来植物病害,尤其是真菌病害严重制约了农作物的安全和可持续生产[12]。如核盘菌Sclerotinia sclerotiorum引起的菌核病,其产生的菌核可在土壤中存活多年,条件适宜时萌发侵染植物,造成农作物产量和品质的下降[36];由灰葡萄孢Botrytis cinerea引起的灰霉病是番茄生产中的毁灭性病害之一,可侵染果实、花、叶和茎等部位,严重时番茄减产60%以上,在储运过程中也会造成果实大量腐烂,带来巨大损失[78]。对植物真菌病害的防治,可采取栽种抗病品种、农业防治、化学防治和生物防治等多种手段[9],但在实际生产中仍以化学防治为主。长期大量使用化学农药带来的环境污染、农药残留、食品安全等问题日益严重,利用生防微生物及其代谢产物抑制病害的发生和传播越来越受到人们的关注[10]。
拮抗菌的应用是生物防治的一个重要方面。方翔等[11]筛选出对桑葚菌核病有明显拮抗作用的甲基营养型芽胞杆菌Bacillus methylotrophicus,邵胜楠等[12]从新疆高寒地区分离到1株高效卡那霉素链霉菌Streptomyces kanamyceticus可有效抑制番茄灰霉病菌和油菜菌核病菌,牛贞福等[13]利用绿色木霉Trichoderma viride防治番茄灰霉病,田间防效达到60%以上。尽管一些生防菌已在田间得到应用,但在实际生产中往往会受到土壤环境等多方面的影响,导致防治效果不佳或不稳定。因此,迫切需要开展各类高效生防新菌株的筛选评价,以提高生防作用效果、扩大应用范围。
粉红螺旋聚孢霉Clonostachys rosea(异名:粉红黏帚霉Gliocladium roseum)是一类重要的菌寄生菌,对多种植物病害显示出良好的生防潜力[1418]。已有的研究表明,粉红螺旋聚孢霉可以寄生病原真菌,产生几丁质酶、葡聚糖酶等细胞壁降解酶,抑制病原菌的侵染[19],还可以通过拮抗作用、对营养物质的竞争和诱导植物抗性等多种方式抑制病害的发生与扩展[2021]。粉红螺旋聚孢霉的研究起步较晚,目前对这类生防资源的挖掘还十分缺乏。本研究选取国内外不同来源的粉红螺旋聚孢霉菌株,进行了寄生能力和细胞壁降解酶活性测定,以及对番茄灰霉病防治效果评价,以期为病害防控提供新的生防资源,为粉红螺旋聚孢霉生防制剂的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
不同来源粉红螺旋聚孢霉菌株42株(表1)、核盘菌、番茄灰霉菌均由中国农业科学植物保护研究所土传病害生防实验室保存。
1.1.2 供试药剂
50%腐霉利可湿性粉剂(WP),日本住友化学株式会社生产。
1.1.3 培养基与试剂
PDA:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,水1 L。
胡萝卜培养基[22]:胡萝卜200 g切成小块,装于2 L三角瓶中。
菌核粉培养基:核盘菌菌核粉碎,过25目筛。培养基中含1%菌核粉、0.3%NaCl、0.3%K2HPO4和0.3%MgSO4,250 mL三角瓶装液量60 mL。121℃灭菌25 min,待用。
DNS溶液:称取192 g酒石酸钾钠溶于预热至70℃的500 mL蒸馏水中,依次加入6.3 g DNS、21 g NaOH和5 g无水Na2SO4,定容至1 000 mL,棕色瓶中储存。
胶体几丁质制备:称取5 g几丁质加入200 mL浓盐酸中,加热溶解,然后加入2 000 mL双蒸水,4℃过夜,5 000 r/min离心5 min,收集胶体物质。
1%胶体几丁质磷酸缓冲液:1 mL胶体几丁质溶于含37.5 mL的0.2 mol/L K2HPO4和62.5 mL 0.2 mol/L NaH2PO4溶液中。
0.2 mol/L pH 5醋酸醋酸钠缓冲液:0.2 mol/L醋酸溶液14.8 mL和0.2 mol/L醋酸钠溶液352 mL混匀。
β-1,3-葡聚糖酶促反应底物:100 mg昆布多糖溶于100 mL 0.2 mol/L pH 5醋酸醋酸钠缓冲液中。
1.1.4 试验番茄
圣女果,产地海南,购自北京生鲜超市。
1.2 方法
1.2.1 菌核培养
将实验室前期保存的核盘菌菌核用1% NaClO表面消毒30 s,无菌水冲洗4遍,超净工作台中吹干,然后放置于PDA平板中央,每皿放1个菌核,25℃培养4 d。待菌核萌发菌丝后,挑取菌丝接种到9 cm的PDA平板上,25℃培养5 d,用解剖刀切成1 cm的菌块,全部接种到胡萝卜培养基中,每皿接2瓶。26℃培养10~15 d,待长出黑色颗粒状菌核后,用自来水反复冲洗去除物料及菌丝,用75%乙醇表面消毒,阴凉干燥处储存备用。
1.2.2 寄生能力测定
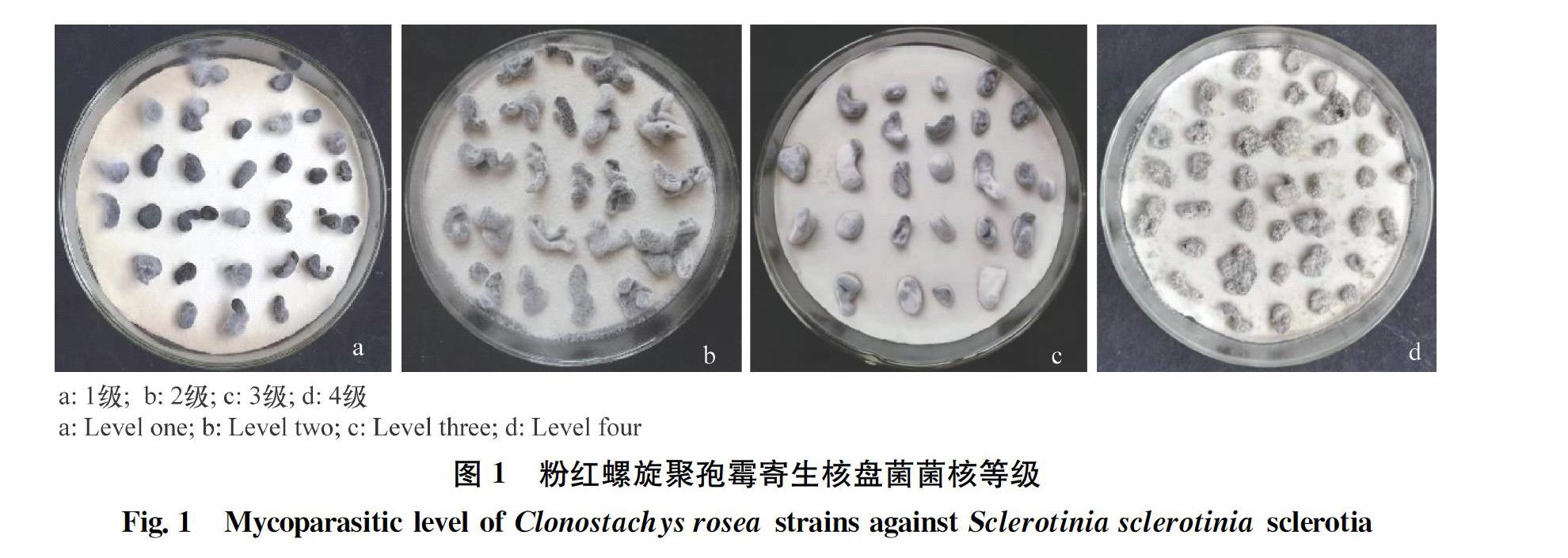
将不同来源的粉红螺旋聚孢霉菌株接种于PDA平板上,26℃培养7~10 d,加入5 mL无菌水洗脱孢子,调节菌悬液浓度至孢子含量107个/mL。菌核消毒后,浸于不同的菌悬液中,10 min后取出,灭菌滤纸上晾干,然后转入铺有湿润滤纸的培养皿(9 cm)中,每皿放置20~25粒菌核。28℃保湿培養10 d,观察菌核被寄生的情况。根据菌株生长及菌核的腐烂程度,将粉红螺旋聚孢霉寄生能力分为5个等级[22]。0级:菌核表面无寄生菌生长;1级:菌核表面长有寄生菌,菌核萌发;2级:菌核表面长有寄生菌,菌核萌发受到抑制但表皮不脱落;3级:菌核表面长有寄生菌,菌核表皮脱落,但菌核内部无软化现象;4级:菌核表面长满寄生菌,整个菌核变得软腐(图1)。每个菌株3个重复。
1.2.3 粉红螺旋聚孢霉β-1,3-葡聚糖酶活性
按4%接种量将不同菌株孢子悬液接种于菌核粉培养基中,28℃、180 r/min振荡培养3 d。取发酵液4℃下离心15 min,转速10 000 r/min,收集上清液作为粗酶液。
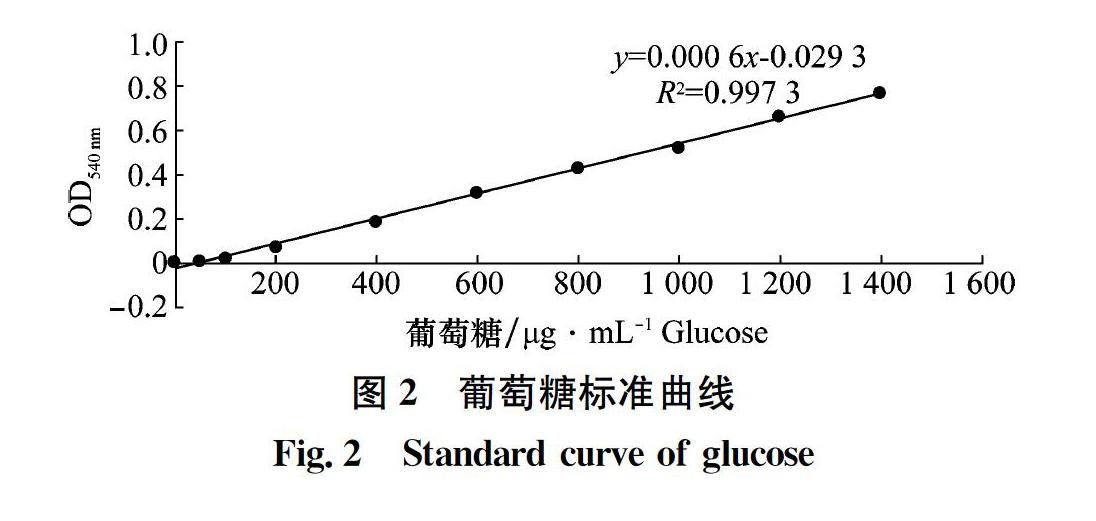
葡萄糖标准曲线的绘制:试管中分别加入0、50、100、200、400、600、800、1 000、1 200、1 400 μL葡萄糖标准溶液,加蒸馏水定容至2.0 mL。加入2.0 mL DNS溶液,100℃水浴10 min,冷却后定容至15 mL,分光光度计(UV-2550型,日本岛津)540 nm处测定吸光度,绘制标准曲线。
β-1,3-葡聚糖酶活性的测定:试管中分别加入1 mL葡聚糖底物和1 mL粗酶液,40℃恒温水浴30 min,以100℃灭活粗酶液为对照。加入2.0 mL DNS溶液100℃水浴终止反应,测定吸光度。3次重复。
1.2.4 粉红螺旋聚孢霉几丁质酶活性
N-乙酰氨基葡萄糖标准曲线的绘制:试管中分别加入0、50、100、150、200,250、300、350 μL N-乙酰氨基葡萄糖标准溶液,加水定容至0.5 mL,再加入0.5 mL DNS溶液,100℃水浴10 min,冷却后定容至5 mL,540 nm测定吸光度,绘制标准曲线。
几丁质酶活性的测定:试管中加入1 mL 1%胶体几丁质底物和1 mL粗酶液,40℃恒温水浴30 min,离心取上清液,以灭活粗酶液为对照。加入0.5 mL DNS溶液100℃终止反应,测定吸光度。3次重复。
1.2.5 對灰霉病菌的拮抗作用
对强寄生力和细胞壁降解酶活性高的菌株进行拮抗作用测定。PDA平板培养粉红螺旋聚孢霉和番茄灰霉病菌,用打孔器在菌落边缘打取直径5 mm的菌饼,在距PDA平板两侧1.5 cm处分别放置粉红螺旋聚孢霉和番茄灰霉病菌菌块,28℃对峙培养7 d,测量菌落直径,计算粉红螺旋聚孢霉对番茄灰霉病菌的抑制率。抑制率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。以只接种番茄灰霉病菌的PDA平板为对照。每个处理3次重复。
1.2.6 对离体番茄果实灰霉病的防治效果
灰霉病菌在PDA平板上,28℃培养10 d,加入无菌水洗脱孢子,3层擦镜纸过滤,血球计数板调节菌液孢子浓度为5×104个/mL。选取大小一致、外皮无损伤的新鲜圣女果,用1% NaClO消毒30 s,无菌水反复冲洗,吹干,用灭菌的1 mL Tip头在果皮赤道处刺1个1 mm深的小孔,然后浸于浓度为107个/mL的不同粉红螺旋聚孢霉菌株的孢子悬浮液中,30 min后取出,无菌滤纸吸取残留的菌液。将一直径5 mm的无菌滤纸片贴在小孔上,然后滴加10 μL灰霉病菌孢子悬浮液。以无菌水和50%腐霉利可湿性粉剂1 000倍稀释液分别代替粉红螺旋聚孢霉菌悬液作为空白对照和药剂对照。28℃保湿培养,7 d后调查番茄果实发病情况。每个处理4次重复。
根据病斑的扩展程度对番茄灰霉病进行分级[23]。0级:无病斑;1级:病斑直径≤1 cm;3级:1 cm<病斑直径 ≤ 2 cm;5级:2 cm<病斑直径 ≤ 3 cm;7级:3 cm<病斑直径≤4 cm;9级:病斑直径>4 cm。病情指数=100×∑(各级发病果实数量×相对级值)/(调查总数×最高级值);防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
2 结果与分析
2.1 粉红螺旋聚孢霉菌株对核盘菌菌核的寄生能力
供试粉红螺旋聚孢霉菌株对核盘菌菌核均具有一定的寄生作用。其中19个菌株寄生能力达到4级,菌核被寄生后变得软腐,表面布满粉红螺旋聚孢霉的菌丝;12个菌株寄生能力达到3级,可以看到菌核表皮脱落,表面布满粉红螺旋聚孢霉菌丝。但也有近30%的菌株寄生能力相对较弱,为1~2级(表1)。
2.2 粉红螺旋聚孢霉β-1,3-葡聚糖酶活性
葡萄糖标准曲线方程为y=0.000 6x-0.029 3,R2=0.997 3(图2),供试的粉红螺旋聚孢霉菌株β-1,3-葡聚糖酶活性范围在31.45~77.3 U/mL。可以看出,酶活性较高的菌株,如SHW-3-1、NHH-48-2、JLB-7-1、GS6-1和HN-56,寄生能力均为4级,而菌株NHH-42-1、ACCC37734、CBS100379和3.398 7
菌株的β-1,3-葡聚糖酶活性较低,其寄生能力也相
对较弱(图3)。
2.3 粉红螺旋聚孢霉几丁质酶活性
N-乙酰氨基葡萄糖的标准曲线方程为y =0.001 1x-0.016 5,R2=0.991 9(图4),产几丁质酶活性范围为2.69~10.39 U/mL,其中菌株GS6-1、GZH-1-1、GG-1-2、SHW-1-1和STG-21-1几丁质酶活性较ACCC58676、YES-2-14和ACCC30190高,相应地,其寄生能力也相对较强(图5)。
2.4 粉红螺旋聚孢霉寄生能力与细胞壁降解酶的相关性
对粉红螺旋聚孢霉寄生能力与几丁质酶、β-1,3-葡聚糖酶活性进行相关性分析,结果表明,菌寄生能力与几丁质酶和β-1,3-葡聚糖酶活性呈极显著正相关,其中寄生能力达到4级的菌株,其活性大多高于其他级别菌株(表2),表明粉红螺旋聚孢霉在寄生核盘菌过程中细胞壁降解酶发挥着极为重要的作用。
2.5 粉红螺旋聚孢霉菌株对灰霉病菌的拮抗作用
平板对峙试验结果表明,供试的粉红螺旋聚孢霉菌株对番茄灰霉病菌都具有较为明显的拮抗作用,但不同菌株间存在较大的差异,其中3.365 5、JXLS-1-1、HLD-1、GZH-1-1和54-1菌株作用较强,抑制率达70%以上,显示出良好的生防潜力(图6)。
2.6 粉红螺旋聚孢霉菌株对番茄果实灰霉病的防治效果
7 d后只接种病原菌孢子悬浮液的番茄表面布满灰霉菌菌丝,而采用粉红螺旋聚孢霉菌悬液浸泡处理的番茄与对照相比病害明显减轻,番茄表面病斑直径较小,60%的菌株对番茄灰霉病防效达50%以上,其中,HN-56、STG-21-1和GS6-1等菌株的防效超过75%,与化学农药50%腐霉利可湿性粉剂1 000倍稀释液的防病效果相当(图7~图8)。
3 讨论
本研究发现,不同来源的供试粉红螺旋聚孢霉菌株都能够在核盘菌菌核上寄生,其中超过70%的菌株寄生能力达到3级或4级,菌核被寄生后不能继续萌发侵染寄主植物,从而有效降低了初侵染源。
在生防菌寄生过程中,几丁质酶和β-1,3-葡聚糖酶等细胞壁降解酶发挥了重要作用。葡聚糖和几丁质是病原真菌细胞壁的主要成分,生防菌通过产生细胞壁降解酶破坏病原菌细胞壁结构,导致病原菌死亡[2426]。刘惠元[27]研究表明,绿黏帚霉Gliocladium virens和融黏帚霉G.deliquescens可以产生细胞壁降解酶,破坏核盘菌菌核。本研究也发现,粉红螺旋聚孢霉寄生能力与β-1,3-葡聚糖酶和几丁质酶活性呈正相关,寄生能力强的菌株酶活性也较高,表明细胞壁降解酶活性的高低可以作为筛选高效菌株的一个重要指标。
拮抗作用是粉红螺旋聚孢霉的一个重要生防机制。前期研究发现,粉红螺旋聚孢霉对小麦赤霉病菌Fusarium graminicola、黄瓜枯萎病菌Fusarium oxysporum、苹果腐烂病菌Valsa mali、杨树溃疡病菌Botryosphaeria dothidea等多种植物病原菌表现出强烈的抑制作用[14, 2829]。我们对筛选出的高致病性生防菌株进行对峙培养发现,这些菌株对番茄灰霉病菌都表现出较为明显的拮抗作用,其中5个菌株抑制率达到70%以上,显示出良好的生防潜力。
灰霉病是番茄生產中一种常见的真菌病害,也是番茄运输贮存过程中的一个重要危害因子。通过生防菌剂喷施、浸果等处理防治番茄果实灰霉病已取得良好的效果。袁和奇等[30]将淡紫紫孢菌Purpureocillium lilacinus接种于番茄伤口处,有效减轻了灰霉病的发生。本研究采用粉红螺旋聚孢霉孢子悬浮液浸果防治番茄果实灰霉病,结果表明,HN-56、STG-21-1等菌株防效达到75%以上,与常规化学农药腐霉利的效果相当。推测可能是生防菌通过占据生态位点,直接作用于病原菌,抑制孢子的萌发和菌丝的生长,同时,通过与病原菌竞争空间和营养,使其能够更有效地抑制病原菌的增殖,降低病害的发生和发展。本研究为防治番茄果实灰霉病及解决采摘后番茄储存问题提供了一条有效可行的途径。
本研究通过对不同来源的粉红螺旋聚孢霉菌株寄生能力和细胞壁降解酶活性测定,以及对番茄灰霉病防治效果评价,获得了GG-1-2、GZH-1-1和GS6-1等高效菌株,对这些菌株将进一步进行田间试验和作用机制的研究。
参考文献
[1] 康振生. 我国植物真菌病害的研究现状及发展策略[J]. 植物保护, 2010, 36(3): 912.
[2] 杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 1222.
[3] 孙颉, 原保忠. 基于文献计量学核盘菌研究现状及趋势分析[J]. 植物保护, 2019, 45(4): 108115.
[4] HUANG Lijie, LI Furong, LIU Ruijun, et al. Antifungal activity of an endophytic strain of Phomopsis sp. on Sclerotinia sclerotiorum, the causal agent of Sclerotinia disease [J]. Journal of Plant Pathology, 2019, 101(3): 521528.
[5] 羊国根, 程家森. 核盘菌致病机理研究进展[J]. 生物技术通报, 2018, 34(4): 915.
[6] WANG Zheng, MA Luyue, CAO Jun, et al. Recent advances in mechanisms of plant defense to Sclerotinia sclerotiorum [J/OL]. Frontiers in Plant Science, 2019, 10: 1314. DOI:10.3389/fpls.2019.01314.
[7] 王伟, 李佳, 姜军坡, 等. 番茄灰霉病拮抗菌TB-12菌株发酵条件优化及其生防效果[J]. 北方园艺, 2017(15): 3641.
[8] GUO Hongna, QIN Xiaojie, WU Yingfeng, et al. Biocontrol of gray mold of cherry tomatoes with the volatile organic monomer from Hanseniaspora uvarum, trans-cinnamaldehyde [J]. Food and Bioprocess Technology, 2019, 12(11): 18091820.
[9] 王超, 郭坚华, 席运官, 等. 拮抗细菌在植物病害生物防治中应用的研究进展[J]. 江苏农业科学, 2017, 45(18): 16.
[10]尤佳琪, 吴明德, 李国庆. 木霉在植物病害生物防治中的应用及作用机制[J]. 中国生物防治学报, 2019, 35(6): 966976.
[11]方翔, 徐伟芳, 牛娜, 等. 一株桑树内生拮抗菌的分离、鉴定及发酵条件优化[J]. 微生物学报, 2018, 58(12): 21472160.
[12]邵胜楠, 张安琪, 巴尔那·库马尔, 等. 放线菌KN37菌株代谢物对番茄灰霉病的防治[J]. 热带生物学报, 2019, 10(3): 258263.
[13]牛贞福, 国淑梅, 张鹤, 等. 防控番茄灰霉病的化学药剂和生防菌株筛选研究[J]. 东北农业科学, 2016, 41(3): 4145.
[14]刘硕, 郑金柱, 张兆霞, 等. 粉红螺旋聚孢霉对两种林果枝干病原菌的生防作用研究[J]. 山东农业大学学报(自然科学版), 2019, 50(1): 4951.
[15]杨荣华. 粘帚霉GR菌株高产β-1, 3-葡聚糖酶诱变、酶分离与性质研究及菌株鉴定[D]. 扬州: 扬州大学, 2010.
[16]张清霞, 杨荣华, 徐敬友, 等. 粘帚霉GR-6菌株种类鉴定及其β-1, 3-葡聚糖酶纯化与酶学性质[J]. 江苏农业学报, 2013, 29(4): 755759.
[17]GONG Chao, LIU Yang, LIU Siyuan, et al. Analysis of Clonostachys rosea-induced resistance to grey mould disease and identification of the key proteins induced in tomato fruit [J]. Postharvest Biology and Technology, 2017, 12: 685716.
[18]MOUEKOUBA L D O, ZHANG Lili, GUAN Xin, et al. Analysis of Clonostachys rosea-induced resistance to tomato gray mold disease in tomato leaves [J/OL]. PLoS ONE, 2014, 9(7): e102690. DOI:10.1371/journal.pone.0102690.
[19]王廷璞, 马静静, 赵菲佚. β-1, 3-葡聚糖酶和几丁质酶在农作物病虫害防治中的研究进展[J]. 安徽农业科学, 2010, 38(26): 1441714419.
[20]BORGESV, SARAIVA R M, MAFFIA L A. Biocontrol of gray mold in tomato plants by Clonostachys rosea [J]. Tropical Plant Pathology, 2015, 40(2): 7176.
[21]赵士振. 粉红粘帚霉防治果蔬灰霉病的研究[D]. 武汉: 华中农业大学, 2015.
[22]高会兰. 粘帚霉菌寄生核盘菌菌核相关酶类的活性分析及其cDNA消减文库的构建[D]. 北京: 中国农业科学院, 2008.
[23]金龙, 梁巧兰. 1.5%多抗霉素对温室番茄灰霉病防治效果试验[J]. 农业科技与信息, 2017(10): 8889.
[24]VAN LOON L C. Induced resistance in plants and the role of pathogenesis-related proteins [J]. European Journal of Plant Pathology, 1997, 103(9): 753765.
[25]SABAT D C, BRANDAN C P, PETROSELLI G, et al. Biocontrol of Sclerotinia sclerotiorum (Lib.)de bary on common bean by native lipopeptide-producer Bacillus strains [J]. Microbiological Research, 2018, 211: 2130.
[26]白羽嘉, 张培岭, 黄伟, 等. 链格孢菌侵染采后甜瓜果实组织几丁质酶和β-1,3-葡聚糖酶基因表达分析[J]. 食品科学, 2018, 39(2): 185191.
[27]刘惠元. Gliocladium deliquescens及Penicillium vermiculatum对Sclerotinia sclerotiorum之超寄生性[J]. 植物保护学会会刊, 1989, 31: 175184.
[28]马桂珍, 高会兰, 张拥华, 等. 链孢粘帚霉几丁質酶的诱导及其抗真菌活性研究[J]. 微生物学通报, 2007, 34(5): 905908.
[29]高航. 粉红粘帚霉对四种林果枝干病原菌的生防作用研究[D]. 泰安: 山东农业大学, 2016.
[30]袁和奇, 徐鹏程, 肖海艳, 等. 淡紫紫孢菌防治采后番茄果实灰霉病[J]. 中国生物防治学报, 2017, 33(4): 525530.
(责任编辑:杨明丽)

