野生蓝果忍冬多酚鉴定及其抗氧化、降血糖活性
乔锦莉,张 妍,3,刘 佩,郭良川,霍俊伟,3,
(1.东北农业大学园艺园林学院,黑龙江 哈尔滨 150030;2.寒地小浆果开发利用国家地方联合工程研究中心,黑龙江 哈尔滨 150030;3.东北农业大学 农业农村部东北地区园艺作物生物学与种质创制重点实验室,黑龙江 哈尔滨 150030)
蓝果忍冬(Lonicera caeruleaL.)是属于忍冬科(Caprifoliaceae)忍冬属的落叶灌木[1-2],起源于亚洲东北部和中亚山区,在中国主要分布在东北、华北和西北地区[3],其野生资源主要分布于大兴安岭、小兴安岭以及长白山等地[4],小兴安岭地区分布的蓝果忍冬野生资源远离工业区,植物生长过程中受到污染的可能性更小,植物资源更加原生态,更为符合人们对健康食品的追求,具有很高的食用、经济和研究价值[5]。
多酚是植物中重要的次生代谢物质和天然的强还原性物质,具有抗氧化、抗心血管疾病、抗糖尿病等生物活性[6]。蓝果忍冬果实中含有丰富的多酚类物质,已被发现在抗氧化和抗糖尿病等方面具有生物活性。在抗氧化方面,Rop等[7]对不同的蓝果忍冬栽培品种进行实验,测定其抗氧化活性,筛选出抗氧化活性较高的蓝果忍冬栽培品种。蓝果忍冬所含的多酚物质能够抑制或者减缓自由基的生成,阻止氧化反应的发生,使自由基能够维持相对平衡的状态,保护机体免受损伤;在抗糖尿病方面,多酚通过控制淀粉由α-淀粉酶水解为麦芽糊精和麦芽糖、由α-葡萄糖苷酶水解为葡萄糖的速率,即抑制α-淀粉酶和α-葡萄糖苷酶的活性[8],可以有效地调控糖尿病人餐后血糖水平(主要针对II型糖尿病)[9]。实验发现蓝果忍冬所含的生物活性物质可以降低血糖、减少肝脏损伤[10]。蓝果忍冬野生资源丰富,了解蓝果忍冬野生资源的生物活性成分,分析其抗氧化与抗糖尿病方面的生物活性,有利于填补这方面研究的空白,并为培育高药食功效的蓝果忍冬提供参考和理论基础。
1 材料与方法
1.1 材料与试剂
蓝果忍冬果实产自小兴安岭地区,随机选取3 株蓝果忍冬植株上完全成熟的果实,于-20 ℃冰箱中保存,用于后续实验。
甲醇、盐酸、乙酸乙酯、乙腈、甲酸、醋酸铵(均为色谱级) 加拿大Simark公司;氯化钾、乙酸钠 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、荧光素、2,2'-偶氮二(2-甲基丙脒)二盐酸盐、水溶性VE(Trolox)、六水合氯化铁(FeCl3·6H2O)、七水合硫酸亚铁(FeSO4·7H2O)、2,4,6-三(2-吡啶基)三嗪、没食子酸(gallic acid,GA)(纯度≥98%)、福林-酚试剂北京博奥拓达科技有限公司;α-淀粉酶(10 U/mg)、α-葡萄糖苷酶(10 U/mg)、脂肪酶(30 U/mg)、玉米淀粉、阿卡波糖 美国Sigma公司;矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)(纯度≥99%) 上海安普实验科技股份有限公司。
1.2 仪器与设备
EPOCH 2型酶标仪 美国Bio-Teck公司;ExionLC型液相色谱质谱联用仪 美国AB SCIEX公司;Luna C18分析色谱柱 美国Phenomenex公司;C18Sep-Pak固相萃取柱 美国Waters公司;LC-20 AD型高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;H1750R型冻干机 北京亚太科隆公司;TGL-16型离心机 湖南湘仪动力测试仪器有限公司;HZQ-211C型摇床 上海一恒科学仪器有限公司;AMP-12型固相萃取仪 上海安普实验科技股份有限公司。
1.3 方法
1.3.1 野生蓝果忍冬多酚的提取和分离纯化
将采集的蓝果忍冬果实真空冷冻干燥后研磨成粉末,过60 目筛后在-20 ℃冰箱中保存。取15 g果实粉末加入100 mL体积分数80%甲醇溶液,室温条件下摇床振荡24 h(200 r/min),4 ℃条件下5 000 r/min离心10 min,所得上清液为多酚粗提液。
蓝果忍冬多酚粗提液通过固相萃取技术分离纯化,参照Kim等[11]的方法将多酚粗提液分离为多糖、非花色苷多酚和花色苷多酚3 个组分。依次加入甲醇溶液(10 mL)和HCl溶液(15 mL 0.01 mol/L)平衡固相萃取柱之后,依次加入15 mL 0.01 mol/L的HCl溶液获得多糖,40 mL纯乙酸乙酯获得非花色苷多酚,60 mL酸性甲醇溶液(体积分数0.1%HCl的甲醇溶液)得到花色苷多酚。收集洗脱液,35 ℃旋转蒸发浓缩,将浓缩液过有机膜(0.22 μm),于-20 ℃冰箱中保存备用。取10 μL浓缩液于EP管中,40 ℃烘干12 h,按公式(1)分别计算浓缩液中3 个组分的质量浓度/(mg/mL)。

式中:m为EP管与烘干后的样品质量/mg;m’为EP管的质量/mg;V为加入的样品体积(10 μL)。
1.3.2 野生蓝果忍冬总酚含量测定
总酚含量测定参照Waterhouse[12]的方法,利用酶标仪在765 nm波长处测定多酚粗提液的吸光度,以没食子酸标准溶液在765 nm波长处的吸光度绘制标准曲线,标准曲线方程为y=5.381 5x+0.000 3,R2=0.992 7,y表示多酚粗提液的吸光度,x表示总酚含量/(mg/100 g),总酚含量以每100 g干质量样品所含没食子酸的质量表示,单位mg/100 g。
1.3.3 野生蓝果忍冬多酚成分鉴定
将1.3.1节获得的蓝果忍冬多酚粗提液稀释为质量浓度1 mg/mL的溶液,过0.22 μm有机膜,去除杂质。利用HPLC-三重四极杆-离子阱串联质谱法对多酚成分进行鉴定[13],对于花色苷多酚和非花色苷多酚检测,HPLC仪检测器均为二极管阵列检测器,色谱柱均为Luna C18柱(250 mm×46 mm,5 μm)。
花色苷多酚检测HPLC条件:二元流动相:A相为5%(体积分数,下同)乙腈-1%甲酸,B相为乙腈;梯度洗脱程序:0~20 min,100% A;20~25 min,80% A;25~20 min,60% A;30~35 min,100% B。流速0.6 mL/min、柱温25 ℃、检测波长520 nm、进样量10 μL。
非花色苷多酚检测HPLC条件:三元流动相:A相为5 mmol/L醋酸铵溶液,B相为20% A(溶剂为纯乙腈),C相为60 mmol/L甲酸溶液;梯度洗脱程序:0~12.5 min,14% B和86% C;12.5~17.5 min,16.5% B和83.5% C;17.5~40 min,25% B和75% C;40~60 min,100% A。流速0.6 mL/min、柱温25 ℃、检测波长280 nm、进样量10 μL。
花色苷和非花色苷多酚检测的质谱条件:电喷雾离子源;花色苷多酚采用正离子模式检测,非花色苷多酚采用负离子模式检测;全离子扫描,扫描范围100~1 000m/z;毛细管电压4 500 V;碰撞气体N2;干燥气体温度550 ℃;流速0.6 mL/min;雾化气压3.0 Bar。
1.3.4 野生蓝果忍冬总花色苷含量测定
蓝果忍冬果实总花色苷含量测定参照Petrova等[14]的方法,将花色苷多酚浓缩液与氯化钾缓冲液(pH 1.0)、乙酸钠缓冲液(pH 4.5)混合,利用酶标仪分别在520 nm和700 nm波长处测定吸光度。以每100 g样品所含C3G质量表示总花色苷含量。按照公式(2)、(3)分别计算蓝果忍冬总花色苷吸光度、总花色苷含量。

式中:Mω为C3G的摩尔质量(449.2 g/mol);DF为稀释倍数;V为提取液总体积/mL;ε为摩尔吸光系数(26 900 L/(mol·cm));m为样品质量/g;L为光程(1 cm)。
1.3.5 抗氧化活性测定
DPPH自由基清除率的测定参照Brand-Williams等[15]的方法并适当修改,DPPH溶液与样品混合处理后,利用酶标仪在517 nm波长处测定其吸光度,以不加样品的体积分数80%甲醇溶液为对照。按照公式(4)计算DPPH自由基清除率,并以DPPH自由基清除率为纵坐标,以Trolox的浓度(100~800 μmol/L)为横坐标绘制标准曲线:y=0.160 8x-10.928 0,R2=0.996 9。

式中:A1为样品吸光度;A0为对照吸光度。
ABTS阳离子自由基清除率的测定参照Fellegrini等[16]的方法并适当修改,将ABTS工作液与样品混合后在734 nm波长处测定其吸光度,以不加样品的体积分数80%甲醇溶液为对照。按照公式(5)计算ABTS阳离子自由基清除率,并以ABTS阳离子自由基清除率为纵坐标,以Trolox的浓度(50~500 μmol/L)为横坐标绘制标准曲线:y=0.718 0x+0.667 6,R2=0.999 4。

式中:A1为样品吸光度;A0为对照吸光度。
铁离子还原能力(ferric reducing antioxidant power,FRAP)的测定参照Benzie等[17]的方法,将样品与FRAP工作液混合后,在30 min时于593 nm波长处测定其吸光度,以不加样品的体积分数80%甲醇溶液为对照。按照公式(6)计算FRAP,并以FRAP为纵坐标,以FeSO4·7H2O的浓度(100~1 000 μmol/L)为横坐标绘制标准曲线:y=0.000 3x+0.018 6,R2=0.992 2。
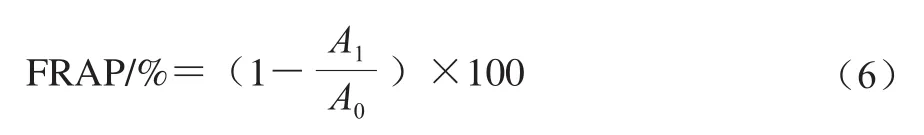
式中:A1为样品吸光度;A0为对照吸光度。
氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)的测定参照Huang Dejian等[18]的方法、在激发波长465~505 nm、发射波长505~555 nm、温度37 ℃、时间2 h条件下测定其荧光值。按照公式(7)计算荧光衰退曲线下面积(area under curve,AUC),按照公式(8)计算ORAC,并以ORAC为纵坐标,以Trolox的浓度(10~200 μmol/L)为横坐标绘制标准曲线:y=0.024 9x+24.717 0,R2=0.994 6。

式中:f1、f2…fn为两小时内第n分钟时的荧光值;AUC0为空白荧光衰退曲线下面积;AUC1为样品荧光衰退曲线下面积;AUC2为Trolox荧光衰退曲线下面积;ρ0为样品的质量浓度/(g/L);c1为Trolox的浓度/(μmol/L)。
1.3.6 抗淀粉酶、抗脂肪酶活性测定
参照Zhang Yan等[19]的方法测定蓝果忍冬果实多酚粗提液(浓缩后粗提物在粗提液中的质量浓度为8.13 mg/mL,后续实验需对其进行稀释)对淀粉酶(α-淀粉酶和α-葡萄糖苷酶)的抑制活性,以阿卡波糖为对照(不添加多酚粗提液),在660 nm波长处测定样品的吸光度,每2 min读取一次,持续2 h,获得多酚粗提液对α-淀粉酶和α-葡萄糖苷酶的抑制活性的动力学曲线,抑制活性结果以半抑制质量浓度(half-inhibitory concentration,IC50)表示。按照公式(9)计算AUC,按照公式(10)计算抑制率,并以抑制率为纵坐标,样品质量浓度为横坐标绘制曲线,计算IC50值。
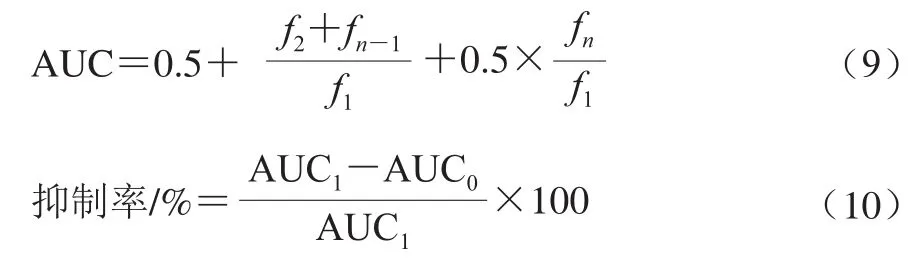
式中:f1、f2…fn为测定的各时间点的吸光度;AUC1为样品的抑制曲线下面积;AUC0为对照的抑制曲线下面积。
对脂肪酶的抑制活性测定:参照Zhang Yan等[20]的方法,在410 nm波长处测定样品的吸光度,每1 min读取一次,持续1 h,获得多酚粗提液对脂肪酶的抑制活性的动力学曲线,计算同公式(9)、(10)。
1.4 数据处理与分析
通过Peak View 2.0软件对高效液相色谱质谱联用的检测结果进行鉴定分析,利用SPSS 20.0软件以及Microsoft Excel软件进行数据计算和分析,Origin 2019软件作图。
2 结果与分析
2.1 野生蓝果忍冬果实中多酚成分
野生蓝果忍冬果实中花色苷HPLC图如图1所示,蓝果忍冬果实提取物中花色苷种类丰富,共检测到8 种。根据图2的花色苷一级和二级质谱图、表1的保留时间和质谱数据并结合前人的研究结果分析,这些化合物为矢车菊素、天竺葵素、芍药素和飞燕草素4 种花色素苷元,相连的糖残基主要包括葡萄糖苷和芸香糖苷2 种。根据文献[21-23]和出峰顺序进行推断,蓝果忍冬A1、A2、A3号峰具有相同的二级碎片离子(287m/z),即矢车菊素花色苷的特征离子,A1号峰碎片离子为m/z287、449,失去两分子葡萄糖苷(162m/z),因此推断A1号峰为矢车菊素-3,5-二葡萄糖苷。A2号峰分子离子为m/z595,碎片离子m/z287是分子离子失去一分子芸香糖苷(308m/z)所得,因此A2号峰为矢车菊素-3-芸香糖苷。同理,A3号峰碎片离子为失去一分子葡萄糖苷所得,A3号峰为C3G。根据文献[21]进行推断,m/z271是天竺葵素花色苷的特征离子,鉴定A4号峰为天竺葵素-3-葡萄糖苷。根据峰图和文献[21-23]进行推测,A5和A6号峰的碎片离子为m/z301,A5号峰为失去一分子芸香糖苷,A6号峰为失去一分子葡萄糖苷,因此A5号峰为芍药素-3-芸香糖苷,A6号峰为芍药素-3-葡萄糖苷。A7号峰分子离子为m/z466,碎片离子为m/z303是飞燕草色素花色苷的特征离子,推断A7号峰为飞燕草素-3-葡萄糖苷,A8与A7号峰特征离子相同,是m/z611失去一分子芸香糖苷所得,推断A8号峰为飞燕草素-3-芸香糖苷。其中保留时间为24.018 min的花色苷(A3号峰)含量最高,表明蓝果忍冬果实中C3G的含量最高(占总花色苷含量的91.1%)。Chaovanalikit等[21]在蓝果忍冬果实中检测到了6 种花色苷,同样发现在这些花色苷中,C3G的含量最高。

表1 野生蓝果忍冬果实中花色苷多酚高效液相色谱-三重四极杆-离子阱串联质谱鉴定结果Table 1 Liquid chromatography coupled to triple quadrupole ion trap mass spectrometric data and tentative identification of anthocyanins polyphenols from wild blue honeysuckle fruit

图1 野生蓝果忍冬果实中花色苷多酚高效液相色谱图(520 nm)Fig.1 High performance liquid chromatogram of the anthocyanin polyphenols extracts from wild blue honeysuckle fruit detected at 520 nm
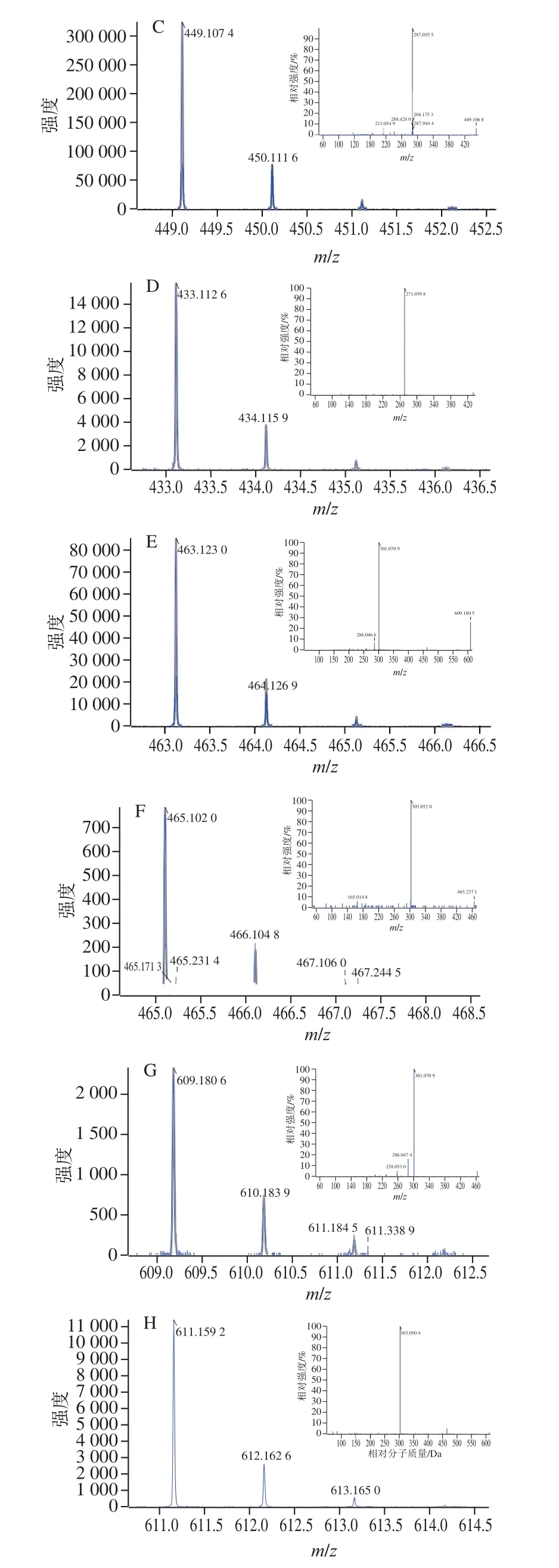
图2 野生蓝果忍冬果实中花色苷一级、二级质谱图Fig.2 Primary and secondary mass spectra of anthocyanins in wild blue honeysuckle fruit

野生蓝果忍冬果实中共检测到20 种非花色苷多酚(图3),根据表2的保留时间和质谱数据,对比非花色苷的一级和二级质谱图、参考文献[21,24-26]和出峰顺序进行推断,和花色苷的推测方法一致,P11、P13、P16号峰具有相同的碎片离子,m/z611是槲皮素的特征离子,芸香糖苷、葡萄糖苷、鼠李糖苷的相对分子质量分别是308、162和146,因此推断P11、P13和P16号峰分别是槲皮素-3-芸香糖苷、槲皮素-3-葡萄糖-7-鼠李糖苷和槲皮素-3-葡萄糖苷。P10号峰是由两个原花青素单体聚合而成(m/z289),推断P10号峰所代表物质为原花青素二聚体。P12和P15号峰具有相同的特征离子(m/z285),P12号峰为失去一分子的芸香糖苷,P15号峰为失去一分子半乳糖苷,因此P12和P15号峰所代表的物质分别为山柰酚-3-芸香糖苷和山柰酚-3-半乳糖苷。根据一级、二级质谱和出峰时间,P1、P3、P6、P8号峰分别为奎宁酸(m/z191)、柠檬酸(m/z191)、龙胆酸(m/z153)和表儿茶素(m/z289)。其中,P2和P19号峰所代表的物质未知,但推测P2号峰属于奎宁酸类多酚,P19号峰属于山柰酚类多酚。在野生蓝果忍冬果实中发现含有较多种类的槲皮素、奎宁酸和山柰酚等物质,P7、P12号峰的峰面积最大,即5-咖啡酰奎宁酸、山柰酚-3-芸香糖苷的含量较高,其中山柰酚-3-芸香糖苷在非花色苷化合物中占比最大,表明蓝果忍冬果实中非花色苷的主要组成成分是绿原酸和黄酮醇类物质,这一结果与Ochmian等[27]的研究结果一致。

表2 野生蓝果忍冬果实中非花色苷多酚高效液相色谱-三重四极杆-离子阱串联质谱鉴定结果Table 2 Liquid chromatography coupled to triple quadrupole ion trap mass spectrometric data and tentative identification of non-anthocyanin polyphenols from wild blue honeysuckle fruit

图3 野生蓝果忍冬果实中非花色苷多酚高效液相色谱图(280 nm)Fig.3 High performance liquid chromatogram of the non-anthocyanin polyphenols from wild blue honeysuckle fruit detected at 280 nm
2.2 野生蓝果忍冬果实中总酚与花色苷含量
本实验中,野生蓝果忍冬果实中总酚含量为82.7 mg/100 g,总花色苷含量为49.8 mg/100 g,谢佳璇[13]对蓝果忍冬‘蓓蕾'进行测定,总花色苷含量为37.85 mg/100 g,总酚含量为29.13 mg/100 g,Oszmiański等[26]发现蓝果忍冬果实中总酚含量为24.37 mg/100 g,表明野生蓝果忍冬在总花色苷和总酚含量方面存在优势。野生蓝果忍冬与其他果实相比也存在优势,Méndez-Lagunas等[28]测定了草莓中的总酚和总花色苷含量,比较发现蓝果忍冬果实中总酚和总花色苷含量是草莓中的10 倍。
2.3 野生蓝果忍冬果实多酚粗提液的抗氧化活性
抗氧化活性的测定常用DPPH自由基清除能力法、ABTS阳离子自由基清除能力法、FRAP法和ORAC法,在这些方法中,最关键的是测定样品消除自由基的能力,过量的自由基会对生命大分子和各种细胞器进行攻击,从而对机体造成一定的损伤,加速机体的衰老,诱导高血压、糖尿病等相关疾病的产生[29]。抗氧化剂能够有效地清除机体内过量的氧自由基,减轻其对机体的损伤,因此常将抗氧化剂的抗氧化活性作为衡量植物抗氧化性的关键指标。抗氧化剂常分为阻止型抗氧化剂和断链型抗氧化剂,植物体内存在的多酚类物质一般属于断链型抗氧化剂,通过使自由基与氢离子或电子结合,转化为稳定的非自由基产物[30]。蓝果忍冬果实中含有大量的多酚类物质,有研究表明,果实的抗氧化性与花色苷的含量和种类存在显著相关性[31]。Kahkonen等[32]对C3G的研究中发现,C3G的含量与抗氧化性存在正相关关系。从图4可知,野生蓝果忍冬果实的DPPH自由基清除能力为985 μmol/g,Kusznierewicz等[33]对波兰的蓝果忍冬栽培品种进行抗氧化性测定,不同的蓝果忍冬栽培品种DPPH自由基清除能力为93~166 μmol/g,ABTS阳离子自由基清除能力为170~417 μmol/g,本实验中野生蓝果忍冬果实对ABTS阳离子自由基清除能力为512 μmol/g,波兰的蓝果忍冬抗氧化活性低于小兴安岭地区的野生蓝果忍冬栽培品种。本实验中蓝果忍冬果实的FRAP为9.6 μmol/g,ORAC为372 μmol/g,Thompson等[34]测定美国栽培的蓝果忍冬果实的FRAP为37~113 μmol/g,ORAC为18~104 μmol/g,与本实验的研究结果接近。

图4 野生蓝果忍冬果实多酚粗提液抗氧化活性Fig.4 Antioxidant activity of polyphenols extracted from wild blue honeysuckle fruit
2.4 野生蓝果忍冬果实多酚粗提液对α-淀粉酶活性的抑制作用
2型糖尿病的关键表现是餐后高血糖[35],α-淀粉酶是小肠肠道细胞膜上用于消化碳水化合物的关键酶,能够催化淀粉、糖原和低聚糖α-1,4糖苷键的水解[36]。图5为蓝果忍冬果实中的多酚物质对α-淀粉酶的活性抑制作用,以阿卡波糖为对照,当其质量浓度为0.26 mg/mL时表现出对α-淀粉酶的抑制活性(抑制率50%),蓝果忍冬果实也对α-淀粉酶表现出抑制活性(IC50为0.39 mg/mL),抑制活性略低于阿卡波糖,但高于沙果提取物(IC50为10.31 mg/mL)[37]、乳苣(IC50为6.904 mg/mL)[38]、蔓越莓(IC50为5.015 mg/mL)、草原樱桃(IC50为7.555 mg/mL)、软枣猕猴桃(IC50为14.641 mg/mL)[39],表明蓝果忍冬具有较强的抗α-淀粉酶活性。Phan等[40]研究了多酚对α-淀粉酶活性的抑制效果,证明了多酚具有较强的α-淀粉酶抑制活性,Worsztynowicz等[37]的结果进一步证明了多酚中的花色苷和酚酸类物质是抑制α-淀粉酶活性的主要物质,这些研究表明,多酚化合物作为α-淀粉酶活性抑制剂,可有效降低餐后血糖浓度,并在预防糖尿病及糖尿病的前期治疗中发挥重要作用。
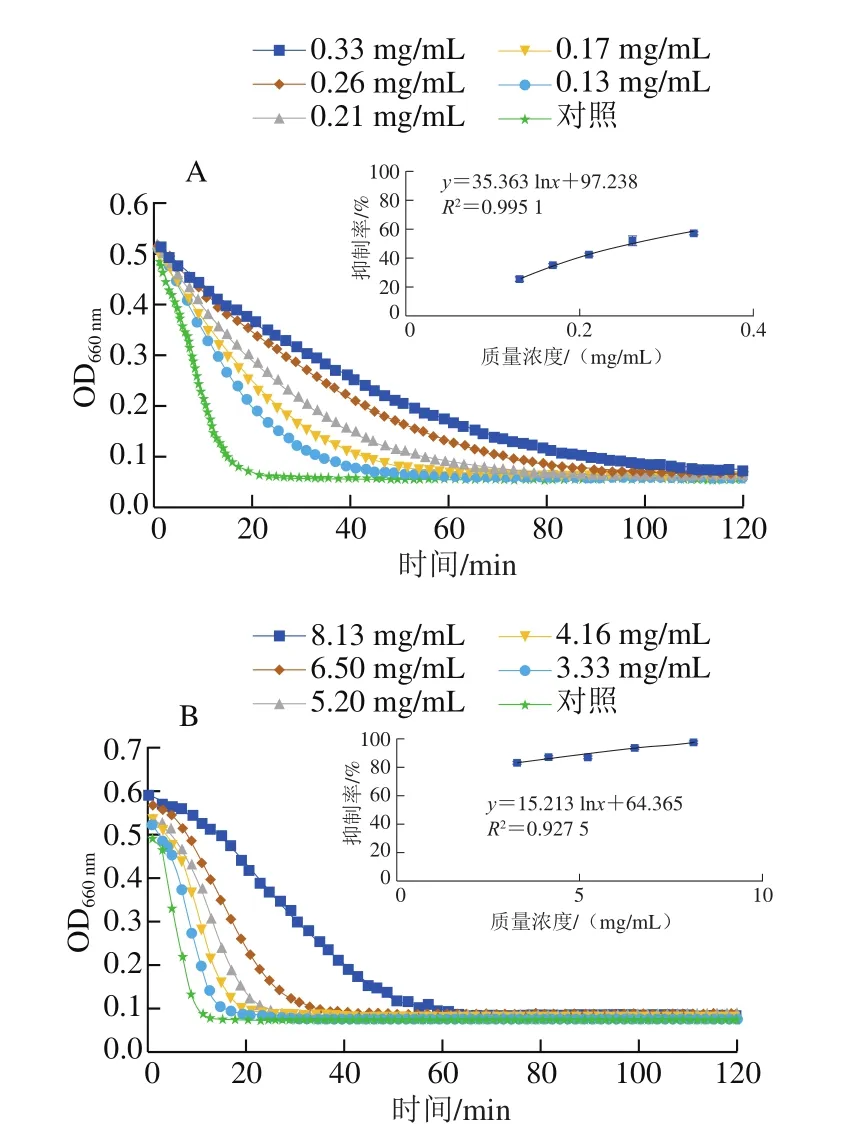
图5 阿卡波糖和野生蓝果忍冬果实多酚粗提液对α-淀粉酶活性的抑制作用Fig.5 Inhibitory activity of α-amylase by acarbose and polyphenols extracted from wild blue honeysuckle fruit
2.5 野生蓝果忍冬果实多酚粗提液对α-葡萄糖苷酶活性的抑制作用
α-葡萄糖苷酶是小肠肠道细胞膜上用于消化碳水化合物的关键酶,能够将二糖转化成被小肠吸收的单糖,导致餐后血糖水平急剧升高[41]。食用对α-葡萄糖苷酶活性具有抑制作用的食物能够有效缓解餐后血糖浓度升高,有利于糖尿病的预防和控制[36]。图6表示蓝果忍冬果实中的多酚物质对α-葡萄糖苷酶的活性抑制作用,以阿卡波糖为对照,根据图中曲线方程计算出其对α-葡萄糖苷酶的IC50为0.02 mg/mL,蓝果忍冬果实对α-葡萄糖苷酶的IC50为0.933 mg/mL,与杨梅(IC50为1.562 mg/mL)[42]和芒果苷(IC50为1.642 mg/mL)[43]相比,具有较强的抗α-葡萄糖苷酶活性。研究表明,5-咖啡酰基奎宁酸[44]、二咖啡酰基奎宁酸[45]均能够抑制α-葡萄糖苷酶的活性,这些物质在野生蓝果忍冬果实中含量较高,尤其是较高含量的5-咖啡酰基奎宁酸可能是蓝果忍冬具有较高α-葡萄糖苷酶活性抑制作用的原因。

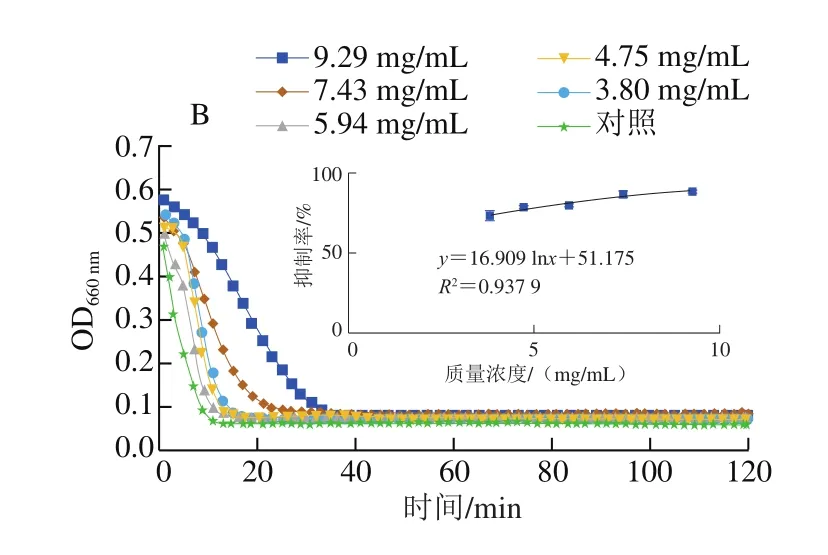
图6 阿卡波糖和野生蓝果忍冬果实多酚粗提液对α-葡萄糖苷酶活性的抑制作用Fig.6 Inhibitory activity of α-glucosidase by acarbose and polyphenols extracted from wild blue honeysuckle fruit
2.6 野生蓝果忍冬果实多酚粗提液对脂肪酶活性的抑制作用
近年来研究发现,肥胖和超重人群糖尿病患病率逐年上升[46],且肥胖和中心性肥胖程度与糖尿病严重程度呈正相关关系[47]。脂肪酶对于甘油三酯的消化起关键作用,能将甘油三酯水解成脂肪酸和单甘脂[48]。日常人们摄入的90%的膳食脂肪都是由混合型的甘油三脂组成,在消化过程中,脂肪酶可以水解50%~70%的脂肪[49]。抑制脂肪酶的活性可以减少人体对于脂肪的吸收,从而达到预防糖尿病的作用。植物多酚提取液能与酶聚合从而使酶失去活性,对脂肪酶表现出抑制活性[50]。本实验中,野生蓝果忍冬的多酚粗提液对于脂肪酶具有一定的抑制活性,IC50为12.31 mg/mL。此外,槲皮素在脂肪酶活性抑制方面具有显著的效果[9],蓝果忍冬果实中检测到了槲皮素-3-芸香糖苷和槲皮素-3-葡萄糖苷,这可能是蓝果忍冬具有较强抗脂肪酶活性的原因。在关于植物对脂肪酶的活性抑制方面,Slanc等[51]共筛选了106 种食用和药用植物以抑制胰脂肪酶活性,发现熊果、豌豆、挪威云杉和大叶椴树具有较强的抑制脂肪酶活性的作用。但目前蓝果忍冬对脂肪酶的抑制活性相关的研究较少,尤其是针对野生资源方面,未来可以利用其果实进行抗肥胖食品的开发。
3 结 论
野生蓝果忍冬果实中的多酚成分含量丰富,果实中共检测到8 种花色苷、20 种非花色苷,其中C3G和山柰酚-3-芸香糖苷含量很高。蓝果忍冬具有较强的抗氧化活性,总酚含量达到82.7 mg/100 g,总花色苷含量为49.8 mg/100 g;对α-淀粉酶、α-葡萄糖苷酶、脂肪酶的IC50分别为0.39、0.933 mg/mL和12.31 mg/mL,具有降血糖的作用。

