冬季项目优秀运动员运动诱发性支气管痉挛
——风险、诊断与治疗
曹 志,刘 猛,2,高炳宏*
(1.上海体育学院 体育教育训练学院,上海 200438;2.重庆市体育科学研究所,重庆 400010)
运动诱发性支气管痉挛(exercise-induced bronchoconstriction,EIB)是指在运动过程中或运动结束后出现的暂时性气道狭窄症状(石月等,2018)。它会对运动员的心理健康、运动表现以及生命安全产生不利影响。研究报道,相比健康运动员,EIB运动员更容易产生挫败、抑郁的消极情绪(Bhumika et al.,2018);EIB运动员的情绪、幸福感、心理健康指数也显著低于前者(Hallstrand et al.,2003)。EIB引起的气道狭窄或气流受限会降低最大摄氧量、增加呼吸肌做功负荷、加速主观疲劳感产生,进而削弱运动表现(Bussotti et al.,2014;Dempsey et al.,2006;Price et al.,2016);同时,EIB严重时还会引发非心源性猝死,1993—2000年,美国共有263名运动员猝死案例,其中的61例与EIB直接或间接有关(Becker et al.,2004)。因此,运动员EIB问题应引起高度重视。
冬季项目运动员是公认的EIB高发人群(Bonini et al.,2015;Price et al.,2014;Rundell et al.,2013;Vakali et al.,2017)。相关研究报道,美国花样滑冰运动员的EIB发病率为34.7%(Mannix et al.,1996);芬兰和瑞典精英越野滑雪运动员的EIB发病率均超过40%(Pohjantähti et al.,2005;Sue-Chu et al.,1996);48% 的法国高山滑雪运动员被诊断或推断为EIB阳性(Durand et al.,2005)。另外,当前世界范围内冬季项目运动员的EIB发病率正呈快速上升趋势,美国女子冰球国家队的EIB率已由15%增长到21%(Rundell et al.,2004b;Wilber et al.,2000);加拿大冬季项目运动员的EIB率从28%提高到37.5%(Bougault et al.,2009;Kennedy et al.,2019);挪威越野滑雪运动员的EIB率由12%上升至44%(Stang et al.,2016;Sue-Chu et al.,1996)。可以预见,若继续忽视EIB的潜在威胁,将会有越来越多的运动员受其影响。
随着冬季项目在全球范围内的推广以及冬季项目运动员EIB发病率的迅速攀升,运动员EIB已成为全球医疗领域研究的重要议题。而目前鲜有我国冬季项目运动员的EIB研究报道。随着2022年北京冬奥会的召开在即,中国冬季项目正蓬勃发展,EIB作为冬季运动的常见症状,其造成的现实影响将日益凸显。而我国现有研究成果仍无法满足未来潜在的理论需求,因此收集和阐述全球范围内已发表的EIB理论成果就尤为必要。本研究对国际冬季项目运动员EIB发病情况进行整理、归纳、分析,探讨EIB发生率的项目、性别差异及高风险诱因,并汇总国际奥委会推荐的EIB检测方法,以及常见的治疗措施,为国内冬季项目运动员的EIB诊断、预防及治疗提供选择和参考。
1 国际冬季项目运动员EIB发病率
本研究通过分析与归纳相关文献,对冬季项目运动员EIB发病风险进行了梳理(表1)。

表1 冬季运动项目EIB发病风险(Bo nini et al.,2018;Charlotte et al.,2016)Table 1 Risk of EIB in Winter Sports
1.1 运动项目差异
研究证实,EIB发病率与运动项目通气特征之间存在因果联系,而通气特征的差异最终导致了运动项目EIB发病率的差别:Charlotte等(2016)对比了德国冬奥运动员的EIB发病率后发现,高通气类项目发病率较高,而低通气类项目则显著下降;Bonini等(2018)根据项目通气时长将EIB发病风险等级定义为低(总运动时长<5~8 min)、中(持续运动时长<5~8 min)、高(持续运动时长>5~8 min),同样表明运动通气与EIB发病之间关系紧密;而Khan(2012)报告的数据显示,北欧两项、越野滑雪、短道速滑的EIB平均发病率高达60.7%,高山滑雪、速度滑冰、花样滑冰、单板滑雪、冰壶的平均发病率较低(24%),自由式滑雪、冰球的平均发病率更低(14%),无舵雪橇、有舵雪橇、跳台滑雪的平均发病率仅2.8%,亦验证了上述规律。本研究在比较国际冬季项目运动员数据(表2)后还发现,除高通气外,通气持续性也在一定程度上影响EIB发病:高通气且持续运动类项目(速度滑冰、越野滑雪等)发病率较高,整体超过40%;高通气但间歇运动类项目发病率出现下降。例如,冰球项目,虽然比赛中的通气需求较高,但运动中断的情况也较多,故EIB发病率低于速度滑冰等项目,Rundell等(2004b)和Lumme等(2003)对冰球运动员的研究数据(EIB发病率21%~21.6%)同样佐证了这一论点。又如花样滑冰项目,2组动作间有供运动员调整恢复的过渡时间,并且基于Mannix等(1996)和Wilber等(2000)的检测结果(21%~34.7%),该项目EIB发病率同样低于速度滑冰等项目。
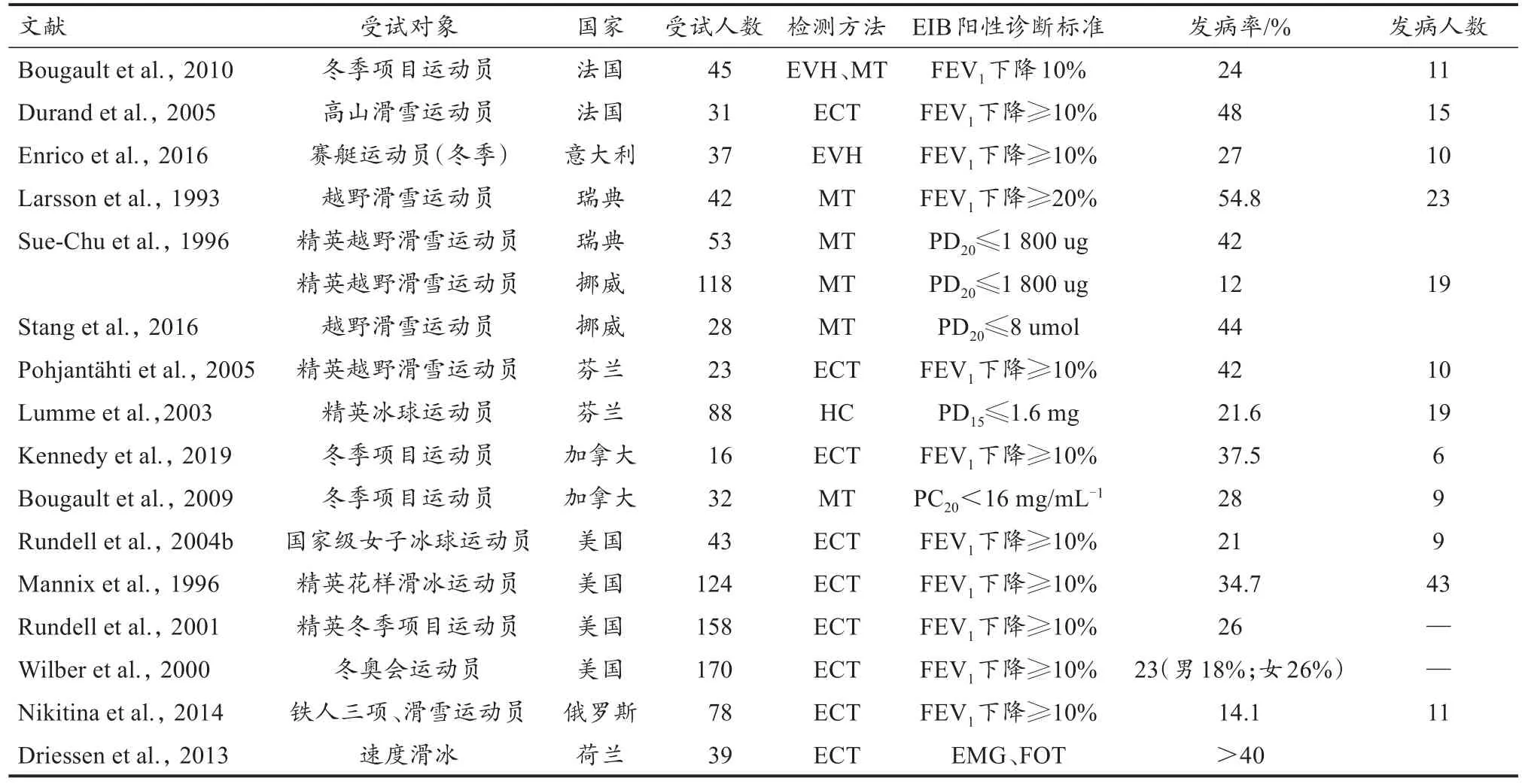
表2 冬季项目运动员EIB情况Table 2 Summary of EIB Prevalence in Winter Sports Athletes
1.2 运动场地差异
按照场地类型,冬季项目又可分为冰上(冰场)、雪上(雪场)2类。研究发现,雪场温度远低于冰场,标准室内冰场的温度约为10℃~12℃(Ewa et al.,2020),而雪场平均气温约为-20℃~-10.6℃(Deng et al.,2019;Kennedy et al.,2019),2种场地的温度差超过20℃。对比冰上、雪上项目运动员EIB发病率数据(表2)发现,雪上项目EIB整体发病率(34.3±19.4%)高于冰上项目(25.7±12.2%),这表明EIB在雪上项目运动员中更为高发。此外,数据显示,通气特征相似项目的EIB发病率也会因场地差异而产生区别:以高通气且持续运动类项目为例,越野滑雪项目EIB发病率(54.8%)高于速度滑冰(43%)(Larsson et al.,1993;Wilber et al.,2000)。由此推断,雪场的低温是造成雪上项目EIB发病风险更高的主要原因之一。
1.3 性别差异
女性运动员EIB发病率普遍高于男性运动员,Langdeau等(2009)表明,女性运动员的气道高反应性(AHR)与运动呼吸症状均高于男性运动员,Couillard等(2014)对130名精英运动员(男女各65名)的EIB/AHR诊断结果表明,女性运动员发病率(66.15%)远超男性运动员(35.38%)。冬季项目运动员亦符合上述规律,根据Wilber等(2000)调查结果,美国7个冬奥项目运动员中,女性运动员EIB整体发病率(26%)高于男性运动员(18%)。究其原因,现有研究主要指向2点:气道结构与生理激素。在气道结构方面,Martin等(1987)在声学反射实验中发现,女性气道横截面积约比男性小40%。细小气道的空气流量更低,只需轻微收缩,就能使气流堵塞堆积,空气流经气道时对抗的气道壁阻力更大,更易导致呼吸不畅等症状。在生理激素方面,女性性激素(黄体酮、雌激素等)可能增加了EIB发病风险,Baldaçara等(2017)研究指出,青春期前、闭经后的女性与同期男性之间EIB发病率差别不大,但青春期和成年女性EIB发病率远高于同期男性。
相关生理研究在人体气道肥大细胞内发现黄体酮受体和雌激素受体(Zhao et al.,2001)。多数研究表明,黄体酮与气道炎症之间存在关联:Tan等(1997)发现,女性哮喘患者在黄体期内的β-2肾上腺素能受体调节水平失准,这不利于EIB的稳定控制;Stanford等(2006)则认为,黄体酮促进了Th淋巴细胞向Th2的分化,并提高Th-2型细胞因子(白介素IL-4、IL-5)的生成;而根据Baldaçara等(2017)研究报道,黄体期女性血浆的肿瘤坏死因子(TNFα)含量更高。动物实验方面,Hellings等(2003)发现,注射黄体酮的雌性小鼠,嗜酸粒细胞生长分化因子(白介素-5)分泌增加、气道炎症随之加重。人体实验方面,Stanford等(2006)对比女性运动员经期内的通气变化,发现在唾液黄体酮浓度最高时段(第21日,黄体中期)的运动后1 s用力肺活量(forcedexpiratory volume of one second,FEV1)的最大降幅显著高于黄体酮浓度最低时段(第5日,卵泡中期)。此外,Craig等(2006)还指出,黄体酮影响呼吸功能,黄体酮浓度的提高会增加EIB症状(过度通气)。
目前,雌激素与气道炎症的关系尚存争议,一种观点认为雌激素会促进内皮NO合成酶的分离,激活NO通路,增加炎症风险(Sathish et al.,2015);另一种观点则认为雌激素能抑制TNFα生成、降低干扰素γ(IFN-γ)表达以及自然杀伤细胞的活性,降低炎症风险(Baldaçara et al.,2017)。不过,由于女性体内雌激素量会随经期呈现周期性波动,因此无论雌激素促进或抑制炎症,都将在经期的某一时段内因激素量上调或下调而增强炎症风险。除去炎症影响,Craig等(2006)研究还表明雌激素水平的升高可能通过体液潴留增加影响肺内气体交换。上述因素是女性运动员EIB发病风险更高的主要原因。
2 冬季项目EIB诱发因素
干冷环境与场地污染物是导致冬季项目运动员EIB高发的主要诱因。本研究通过文献梳理、归纳、分析,将冬季项目运动员的EIB发病机制进行了系统阐述(图1)。

图1 冬季项目运动员的EIB发病机制图Figure 1.Diagram of EIB Pathogenesis in Winter Sports Athletes
2.1 干冷环境
干冷空气环境是公认的EIB主要诱因。根据Carlsen(2012)对EIB发病机制的阐释,外部空气在进入呼吸道后会被加温、湿化至人体标准(37℃,99 RH),人体气道在运动中一直处于水分、热量流失状态。当通气量/强度过高,就会使气道表面水分完全蒸发,导致支气管粘膜细胞外液渗透压增加,诱导细胞内水分外流,进而使胞内离子浓度上升、细胞皱缩,皱缩细胞脱颗粒,释放炎症介质引发支气管收缩。此时,空气湿度较低(干燥)会进一步加速气道表面失水,加剧后续反应程度;另一方面,人体气道加温空气的过程与气道表面水分蒸发的过程均需消耗气道热量,造成气道温度下降。这不仅使副交感神经因寒冷刺激释放支气管收缩信号,导致气道口径减小;还会使支气管小静脉血管因储存热量而反射性收缩。当运动结束后,气道温度逐渐回升,收缩的血管会反弹性舒张,使支气管出现充血性水肿,也会造成气道口径减小。此时,寒冷空气将加深气道冷却情况,并扩大运动后温度差,增强气道复温引起的连锁反应。雪场空气温湿度(<-10℃,20~40 RH)远低于人体呼吸道内空气标准(Kennedy et al.,2019)。Stensrud等(2007)分别在20.2℃和-18℃下对20名EIB患者进行了筛查实验后发现,低温环境下的FEV1下降更剧烈(24%:31%)。Kennedy等(2019)分别在寒冷(-15℃)和室温环境(约22℃~25℃)下对16名冬季项目运动员进行了EIB筛查实验,得出相同结论,即寒冷环境下的EIB阳性率更高(37.5%:31.25%)。
2.2 场地污染物
场地污染物是导致冬季项目运动员EIB高发的又一重要诱因,场地污染物因运动项目差异又分为户外(雪场)、室内(冰场)污染物。户外污染主要为NO2、O3、SO2和颗粒物等排放废气(Sacha et al.,2011)。研究发现,这些污染物不仅损害肺功能,还会增加气道炎症风险。Pierson等(1986)指出,少量SO2和O3就能降低运动员的FEV1,该研究还指出,吸入体内的SO2几乎完全被鼻粘膜吸收,并通过呼吸被输送到下气道区域,使污染物在整个呼吸系统中传播和弥散。此外,Riedl等(2005)发现,柴油机尾气颗粒(DEPs)进入气道区域后会上调炎症细胞因子水平,增加炎症细胞数量与气道阻力。室内污染主要包括覆、制冰机燃料废气沉淀和高浓度的超细颗粒物(ultrafine particles,UPM),根据研究报导,不仅室内冰场的UPM含量非常高,约为户外的30倍(Sacha et al.,2011),且UPM容易在封闭的室内冰场大量堆积(Rundell et al.,2013)。另有研究证实,UPM的沉积效率高于大颗粒物(Chalupa et al.,2004;Christopher et al.,2003)。同时,研究还表明,UPM具有高度氧化的特性(Li et al.,2003),容易诱发肺部炎症(Frampton et al.,2004)。此外,Rundell等(2013)研究认为,运动中的高换气频率会进一步提高UPM的沉积效率。因此在室内冰场运动势必增加UPM在呼吸系统内的沉积,降低肺功能,增加EIB风险。
综上所述,冬季项目运动员的EIB高发是外部因素(项目特征、空气温湿度、污染物含量种类等)和内部因素(气道敏感性等)长期相互作用的结果,而不同的诱发因素、项目特征及自身因素差异,又是导致不同项目、性别、年龄及竞技水平运动员之间发病特征(症状)差别巨大的原因。
3 EIB诊断
国际奥委会医学委员会(IOC-MC)和世界反兴奋剂机构(WADA)认定的EIB诊断方法包括直接、间接支气管激发测试2类(共6种测试方法)(Mountjoy et al 2015;Rundell et al 2004a;Vakali et al 2017)。表2数据表明,目前冬季项目运动员EIB诊断的常用方法是乙酰甲胆碱试验(methacholine provocative test,MT)(直接激发)和运动激发试验(exercise challenge test,ECT)(间接激发)。通过文献梳理,本研究分析了6种EIB诊断方法对冬季项目运动员的适用性(表3),建议优先考虑普及度较高的ECT或诊断精度较高的CO2自主过度通气试验(eucapnic voluntary hyperpnea,EVH)。

表3 IOC-MC推荐的不同支气管激发测试方法对冬季项目运动员EIB诊断的适用性(Hayden et al.,2019;Vakali et al.,2017)Table 3 Applicability of IOC-MC Recommended Bronchial Provocation Test Methods in EIB Diagnosis in Winter Sports Athletes
3.1 运动激发试验
ECT是目前应用最广泛、运动员接受度最高的EIB诊断方法。参照美国胸科协会(American Thoracic Society,ATS)标准(Parsons et al.,2013),ECT后30 min内测试者的FEV1下降率≥10%,则判定为EIB阳性。根据测试场地差异,ECT又分为实验室运动激发测试(laboratory test,LT)与场地运动激发测试(field test,FT)2种。
场地激发测试是冬季项目运动员EIB诊断应用最多的方法。其测试时一般选择在运动场地(如冰场、雪场等)进行,运动方式则为跑步或专项运动(滑冰、滑雪等),在2~4 min内运动强度须≥85%HRmax,并持续运动至少6 min(Weiler et al.,2016)。场地激发测试与实际训练比赛环境高度一致,非常利于冬季项目运动员的EIB诊断。不过,实际使用时,受气温、湿度、空气污染、运动员主观意愿等影响,可能存在2次测试结果相差较大的情况。而实验室激发测试是场地激发测试的重要替代手段,当受客观因素影响(夜晚、大风、雾霾等),不宜进行场地试验时,可选择实验室激发测试。实验室激发测试通常在室内跑台或功率自行车上进行,实验环境型对稳定且可以严格控制负荷,容易实现既定运动方案。只是限于对运动仪器的硬性要求,该测试不如场地激发试验便利。
3.2 CO2自主过度通气试验
EVH的检测精度较高,被IOC-MC视为运动员EIB诊断的“金标准”(Hull et al.,2016)。EVH标准流程如下:先测定运动员静息肺功能,然后在85%最大自主通气(maximum voluntary ventilation,MVV)水平下(也可按照FEV1基线值的30~35倍/min设置)持续吸入混合干燥气体6 min(比例:5% CO2、21% O2、74% N2),再进行肺功能测量。在吸入气体后20 min内FEV1最大下降超过10%,即判定为EIB阳性。对患有严重气道疾病的运动员,还可采用EVH的阶梯法(3个阶段,30%、60%、90% MVV)进行测定,FEV1最大下降在吸入气体20 min内超过10%,即判定为EIB阳性。EVH诊断敏感度高、测试过程严谨。而其不足之处在于检测的成本过高、设备专业性强,难以进行大范围诊断。
3.3 其他方法
乙酰甲胆碱测试不仅可以用于EIB诊断,还可用于呼吸道敏感性测试,具体操作流程为:测试前调查运动员的在用药物情况,通过测试中的累积吸入浓度(PC20)、参照表3标准评判运动员气道是否存在AHR(Donald et al.,2019)。此外,高渗盐溶液激发测试(hypertonic saline challenge test,HST)的痰液诱导效果较好,适合在运动员痰液收集与分析等特殊场合下应用,但易产生咳嗽,因此较少应用于常规的EIB诊断。甘露醇激发测试(dry powder mannitol challenge test,DMT)和组胺测试(histamine challenge,HC)的诊断精度一般,且测试中均容易产生不适症状,在一线运动队进行普及的效益较低,故对这2种方法的推荐度较弱。
4 EIB治疗
冬季项目运动员EIB的主要治疗手段包括非药物治疗和药物治疗(Parsons et al.,2013),其中非药物治疗因具有天然健康、无违禁物质等优点,适合作为EIB治疗的首选。而当EIB病情严重时,可先申请治疗豁免许可,在审批通过后进行药物治疗(Hayden et al.,2019)。参照相关研究报道,本研究分析梳理了冬季项目运动员EIB治疗的作用机制(图2)。

图2 EIB治疗的作用机制(Bonini et al.,2015;Driessen et al.,2013;Stensrud et al.,2006)Figure 2.Mechanism of EIB Therapy
4.1 非药物性治疗
4.1.1 佩戴热交换面罩
研究报道,使用热交换面罩(heat and moisture exchanger,HME)能显著降低EIB的发病风险(Parsons et al.,2013),尤其是在干冷或污染环境下。HME能过滤空气中的污染物或过敏原,并缓解干冷空气对呼吸道的刺激。Beuther等(2006)报道,在-25℃~-15℃环境中运动时,同为EIB患者,HME组和对照组的FEV1下降率分别为4.3±1.6%和19±4.9%;也有研究指出,HME设备已在2018年平昌冬奥会中得到较大范围的使用,且表现出极佳的使用效果(Clemens et al.,2020)。Clemens等(2020)发现,冬季项目运动员在佩戴HME比赛后,其赛后的呼吸不适症状明显减少和FEV1下降率明显降低;同时,佩戴HME未对其运动表现产生不利影响。Eiken等(1989)也报道,佩戴HME不会对精英运动员的运动力竭时间和氧摄入总量产生不利影响,建议EIB运动员在比赛时佩戴HME。
4.1.2 热身活动
研究表明,剧烈运动前进行中等强度的热身(15 min、60%V˙O2max),会显著降低 EIB 的发病风险(Weiler et al.,2016;Parsons et al.,2013)。Stickland等(2012)推测,中等强度运动消耗支气管的收缩介质,并诱导保护介质(前列腺素、儿茶酚胺等)分泌,进而促使平滑肌对支气管收缩介质脱敏,产生EIB发病“不应期”(1~4 h);该研究还指出,高强度间歇运动(26~30 s,100%V˙O2max以上强度)会使运动后FEV1下降率减少4.8%~16.1%;低强度运动(30 min,60%V˙O2max)会使FEV1下降率减少20.6%;持续性高强度(心率达到180次/min)会使FEV1下降率减少17.6%。然而,热身负荷过高则会降低肌肉兴奋-收缩耦合效率,削弱后续运动表现(Hostrup et al.,2017)。基于此,呼吸预热的概念被提出。Philipp等(2016)研究指出,不同强度的呼吸预热均对EIB患者有效,其中持续10 min、70%V˙O2max强度的呼吸预热效果最佳,且对后续运动表现的负面影响最小。
4.1.3 营养干预
营养干预也是EIB防治的有效手段之一,且其便于携带和服用,故运动员更易接受。目前EIB营养干预物质或方法主要包括:鱼油(ω-3多元不饱和脂肪酸,n-3 PUFA)、维生素(维生素C、维生素D等)以及控制盐摄入等(Parsons et al., 2013; Spector et al., 2012;Weiler et al.,2016)。研究指出,n-3 PUFA中的二十碳五烯酸和二十二碳六烯酸会与花生四烯酸形成的炎症底物(白三烯、前列腺素等)相对抗,从而产生抗炎效果,降低EIB发病风险(Helenius et al.,2005)。Tecklenburg等(2007)报道,通过2周维生素C(1 500 mg/日)干预,哮喘患者的体内各类炎症因子(NO、尿白三烯C4-E4、尿前列腺素)水平显著下降,其肺功能亦有明显改善;Szymczak等(2016)研究发现,维D会与T细胞上的维D受体结合,抑制Th17细胞分化与增殖,降低促炎因子IL-17水平,进而减轻嗜酸性、中性粒细胞气道炎症,对缓解急性哮喘风险起到较好的效果(Mayor et al.,2016)。Mickleborough等(2005)指出,限制盐摄入能有效减少降低EIB患者的炎症细胞和炎症介质的数量。Weiler等(2016)和Gotshall等(2000)的研究也进一步证实Mickleborough等(2005)的观点。
4.2 药物治疗
β-2受体激动剂是EIB治疗的首选药物(Backer et al.,2007;Bonini et al.,2015;Parsons et al.,2013),其主要通过刺激支气管平滑肌表面的β-2受体,阻断肥大细胞脱颗粒,提升细胞内环磷酸腺苷浓度,使支气管扩张。根据WADA 2021年度《禁用清单》,β-2受体激动剂包括短效(沙丁胺醇等)和长效(福莫特罗、沙美特罗等)2类可用于赛内限量使用,其药效早已被多项研究证实,美国胸科协会(American Thoracic Society,ATS)数据显示,使用沙丁胺醇后EIB患者运动后的FEV1下降率降低26.03%;Ferrari等(2000)也报道,服用福莫特罗和安慰剂受试者的FEV1下降率分别为5.9±7.2%、29.3±14.3%。因短效β-2受体激动剂(Short-acting β-2 agonists,SABA)起效时间短,建议运动前15~20 min内使用(建议剂量0.2~0.4 mg,药效时长 2~4 h)(Backer et al.,2018)。长效 β-2受体激动剂(Long-acting β-2 agonists,LABA)药效时长更持久,约 12 h(Weiler et al.,2016)。但是,长期反复使用 β-2受体激动剂会使呼吸道内肥大细胞和平滑肌细胞的β-2受体脱敏,进而产生耐药性(Bonini et al.,2014)。这不仅会严重降低药效(Inman et al.,1996;Parsons et al.,2013),还会进一步促进炎症因子形成(Anne-Marie et al.,2004),增加EIB发病风险。
皮质类固醇(inhaled corticosteroids,ICS)也是 EIB治疗的常见药物,主要用于慢性气道炎症控制,是哮喘运动员EIB治疗的推荐药物(Bonini et al.,2015)。ICS无即时效果,需长期服用,Koh等(2007)报道,经过4周ICS治疗EIB患者运动后的FEV1下降率显著降低;ATS指南显示,ICS的最佳效果通常在第2~4周时出现(Parsons et al.,2013)。也有研究指出,ICS与其他抗哮喘药物合用的适配性较好(Bhumika et al.,2018),故长期ICS搭配短期β-2受体激动剂,可能产生积极的互补治疗特效。除此之外,白三烯受体拮抗剂、肥大细胞稳定剂等也是EIB治疗的重要补充药物,但其药效、稳定性等均不及β-2受体激动剂和 ICS(Bonini et al.,2015)。
5 总结与展望
冬季项目运动员属于EIB高发人群,尤其是女性运动员,受激素代谢等因素影响,其面临的EIB发病风险比男性运动员更高。目前,国内关于冬季项目运动员EIB问题的关注较少,而对于冬季项目运动员EIB的风险评估、筛查诊断及治疗预防更是鲜见报道。因此,加大对冬季项目运动员EIB问题的关注,开启我国运动员(尤其是冬季项目运动员)的EIB风险评估与筛查诊断,创新EIB治疗与预防手段,总体降低我国运动员EIB患病风险,对于维护运动员身心健康,科技助力奥运,具有重要意义。

