黄芪甲苷对幽门螺杆菌定植相关因子的影响*
王平,赵澄,吴涛,张香港,卢芳国,吴碧清,吴贤倩,陈丽玄,鲍杰
1.湖南中医药大学,湖南 长沙 410208;2.贵州中医药大学,贵州 贵阳 550025
幽门螺杆菌(Helicobacter pylori,H.pylori)已被证实是慢性胃炎和消化性溃疡的病因之一,且与胃癌的发生密切相关[1]。成功定植于胃黏膜是H.pylori感染的首要条件,而黏附又是定植的关键[2]。鞭毛动力、尿素酶活性和黏附素是H.pylori在胃内得以生存和定植的重要原因,与H.pylori致病性密切相关,成为根治H.pylori感染的重要靶点[3-4]。中医药治疗在改善症状、提高幽门螺杆菌根除率、降低幽门螺杆菌复发率等方面有较大优势[5]。临床研究发现,中药黄芪(Astragali Radix)对H.Pylori相关性胃炎和消化性溃疡的治疗效果显著,但具体机制不清[6]。黄芪甲苷(Astragaloside IV,ASIV)是一种四环三萜类皂苷,为黄芪的主要活性成分,本实验通过观察ASIV对H.pylori尿素酶活性、鞭毛运动功能及定植相关基因表达的影响,初步探讨ASIV抗H.Pylori定植的可能机制,为黄芪及其活性成分的进一步开发利用提供理论和实验支持。
1 材料
1.1 菌株H.Pylori ATCC26695菌株由贵州医科大学微生物学教研室惠赠,由课题组保管于贵州中医药大学形态实验室。
1.2 药物及试剂ASIV(大连美仑生物技术有限公司,批号:MB1955,纯度>98%);H.Pylori固体培养基、布氏肉汤干粉、脑心浸液肉汤干粉、H.Pylori添加剂(青岛海博生物技术有限公司,批号:HB8646、HB0241、HB8297-1、HB8646a);DMSO(北京索莱宝科技有限公司,批号:D8370);无菌脱纤维羊血(常德比克曼生物科技有限公司);过氧化氢酶试剂、氧化酶试纸片(青岛海博生物技术有限公司,批号:HB8650、HB2100);尿素酶试纸(珠海市克迪科学技术开发公司,批号:121102);无菌PBS缓冲液(美国HyClone公司,批号:SH30256.01);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:PC0020);细菌总蛋白提取试剂盒(上海贝博生物科技有限公司,批号:BB3123-2);细菌尿素酶比色法定量检测试剂盒(美国GENMED公司,批号:GMS15022.2);细菌总RNA提取试剂盒(离心柱型)(北京天根生化科技有限公司,批号:DP430);cDNA合成试剂盒、NovoStart®SYBR qPCR SuperMix Plus试剂盒(上海近岸蛋白质科技有限公司,批号:E047、E096);目的基因PCR引物由生工生物工程(上海)股份有限公司合成;内参基因(16S rRNA基因)引物参照文献[7]由长沙维尔生物有限公司合成。
1.3 仪器BSC-1300ⅡA2生物安全柜、SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);TP-200D电子分析天平(湘仪天平仪器设备有限公司);TGL 20M高速冷冻离心机(长沙湘智离心机仪器有限公司);多功能酶标仪(美国Bio-tek公司);LightCycler荧光定量PCR仪(瑞士罗氏公司);NanoDrop 2000分光光度计(美国Thermo Fisher Scientific公司);Scientz-650E超声波细胞破碎仪(宁波新芝生物科技有限公司);麦氏比浊仪(法国Biomerieux SA公司)。
2 方法
2.1 培养基的制备培养基的制备严格参照说明书要求进行。固体培养基:取H.Pylori固体培养基5.2 g,加入93 mL纯水,121℃高压灭菌20 min,冷却至56℃左右,加入无菌脱纤维羊血7 mL及H.pylori添加剂1支,混匀,倾倒于90 mm无菌平皿中,培养基厚度约为3~4 mm,4℃备用。含药培养基:根据计算出的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)的1/2、1/4、1/8分别加入ASIV,与上述成分充分混匀后分装至直径90 mm的无菌平皿中,4℃备用。半固体培养基:取布氏肉汤干粉2.81 g,加入100 mL纯水,0.3 g琼脂,121℃高压灭菌20 min,冷却至56℃左右,加入无菌脱纤维羊血7 mL及H.pylori添加剂1支,含药培养基按上述浓度加入ASIV充分混匀后,分装至直径为90 mm的无菌平皿中,培养基厚度约为3~4 mm。液体培养基:脑心浸液肉汤干粉3.85 g,加无菌纯水90 mL,高压灭菌,冷却后加10 mL胎牛血清,分装,4℃备用。
2.2 幽门螺杆菌鉴定在微需氧环境中(培养罐中放置微需氧袋)培养H.pylori 48~72 h,连续培养3代,通过观察其菌落形态、生化试验(触酶试验、氧化酶试验、快速尿素酶试验)及革兰染色对H.pylori进行鉴定[8]。触酶试验:根据说明书操作,接种环挑取细菌菌落涂布于洁净玻片上,在菌落上滴加3%过氧化氢1滴,观察有无气泡产生,如有气泡产生,判断为阳性。氧化酶和快速尿素酶试验:接种环灭菌后刮取平板中疑似菌落放于氧化酶试纸片或快速尿素酶试纸条上,30 s至2 min内观察结果。氧化酶试纸在30 s内变为蓝色或蓝紫色为强阳性,2 min不变色为阴性;快速尿素酶试纸在1~2 min内变红,则尿素酶试验为阳性,如果试纸条颜色不变,则尿素酶试验为阴性。
2.3 琼脂稀释法测定最小抑菌浓度采用琼脂稀释法测定ASIV的MIC,具体如下:刮取培养48~72 h H.pylori接种于液体培养基中,用无菌生理盐水将其稀释至1.5×108CFU·mL-1。滴加200μL菌液于培养基表面,用涂布棒均匀接种于不同终浓度ASIV(10 g·L-1、5 g·L-1、2.5 g·L-1、1.25 g·L-1)的含药平板上,37℃微需氧培养72h后观察,以未出现H.pylori生长的最低药物浓度为MIC。
2.4 尿素酶蛋白活性检测将1.5×108CFU·mL-1H.pylori菌液200μL分别涂布于空白平皿及含1/2、1/4、1/8 MIC 3个不同浓度ASIV的平皿中,微需氧传代培养3代,用无菌PBS将平板菌株洗脱并收集到无菌离心管中,4℃、5 000 r·min-1离心5 min,去上清,收集菌体,用细菌细胞漂洗液将细胞悬浮起后,4℃、12 000 r·min-1离心2 min,去除漂洗液,重复2次,加入细菌细胞蛋白裂解液、磷酸酶抑制剂和蛋白酶抑制剂,混悬细菌细胞样品,37℃摇床温育20 min,置冰上放入超声破碎仪,300 w、10 s超声/10 s间隔超声20 min,至菌液变清后,4℃、10 000 r·min-1离心15 min,上清即含蛋白质粗提物。取上清,BCA法测定蛋白质含量。根据GENMED细菌尿素酶活性比色法定量检测试剂盒说明书制备标准曲线,并进行样品尿素酶活性检测。
尿素酶活性抑制率=(对照组尿素酶活性-实验组尿素酶活性)/对照组尿素酶活性×100%
2.5 细菌鞭毛动力定量检测参照文献[7]方法,收集培养48 h且生长状态良好的H.pylori悬于脑心浸液,比浊仪调整菌液浓度至3×108CFU·mL-1,4℃备用。用接种针取菌液穿刺接种于含不同浓度(1/2MIC、1/4MIC、1/8MIC)ASIV的布氏肉汤半固体培养基平皿中,相同浓度各接种3个,以不含药培养基作为阴性对照。置于37℃培养箱中培养5 d,测量各组H.pylori菌膜晕圈直径。
2.6 实时荧光定量PCR检测幽门螺杆菌黏附定植相关基因的表达水平H.pylori在3个浓度含药平板上培养48 h后,设为实验组(ASIV大剂量组、ASIV中剂量组、ASIV小剂量组),同批未经ASIV处理的H.pylori设为对照组。用脑心浸液将H.pylori制成1~9×108CFU·mL-1细菌悬液,采用离心柱法提取各组样品的总RNA。利用多功能酶标仪检测样品在波长260 nm与280 nm处的吸光度值A260与A280。选择A260/A280值在1.8~2.0之间的样品,用RNase Freed H2O将样品浓度调整至500~600 mg·L-1,逆转录成cDNA,以cDNA做模板,按NovoStart®SYBR qPCR SuperMix Plus试剂盒说明,分别加入16S rRNA、ureA、ureB、flaA、flaB、babA、sabA、alpA、alpB引物进行扩增。PCR反应体系为:cDNA 2μL,UltraSYBR Mixture(Low ROX)25μL,10μM上下游引物各1μL,以dd H2O补足至50μL。反应条件:95℃10 min,95℃10 s,60℃1 min,40个循环,采用2-ΔΔCT法计算目的基因相对表达量。引物序列见表1。

表1 PCR引物序列
2.7 统计学分析采用SPSS 21.0软件进行统计分析,实验数据以平均值±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。方差齐时,用LSD进行多重比较,方差不齐时用Games-Howell进行多重比较,以P<0.05为差异有统计学意义。
3 结果
3.1H.pylori在固体培养基上生长现象观察及革兰氏染色结果在固体培养基上H.pylori菌落为直径1~2 mm的透明针尖样菌落,均匀散在分布。经涂片、固定、革兰染色后油镜下观察,呈红色弯曲状或短杆状。触酶试验、氧化酶试验和快速尿素酶试验均为阳性。结果见图1、图2。

图1 幽门螺杆菌固体培养基生长现象
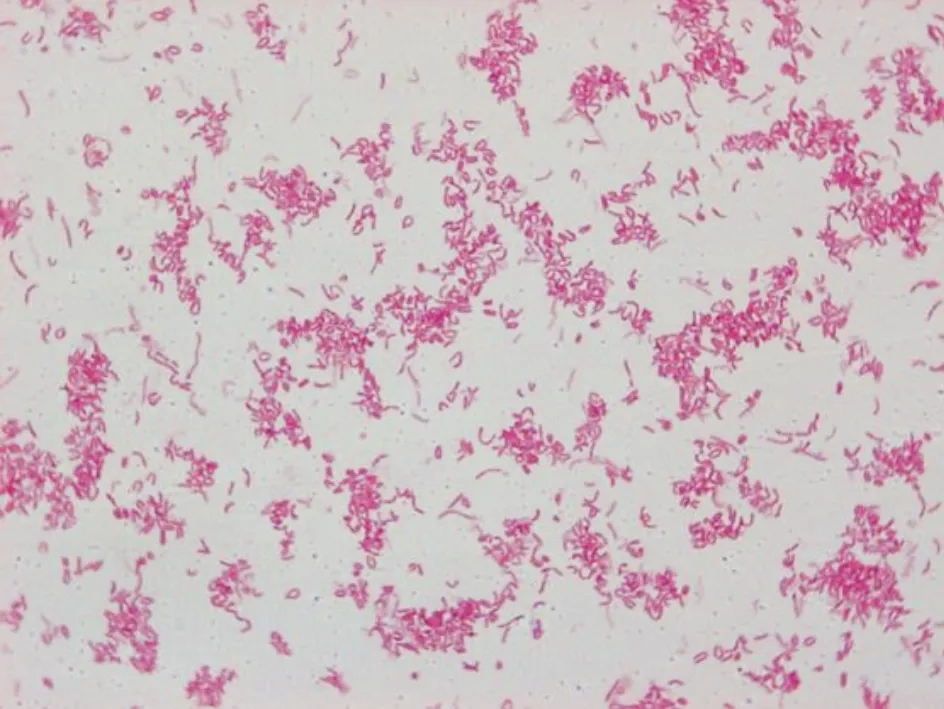
图2 幽门螺杆菌镜下形态(×1 000)
3.2 最小抑菌浓度测定琼脂稀释法测定最小抑菌浓度发现,在10 g·L-1、5 g·L-1ASIV含药平板中未培养出H.pylori,即5 g·L-1为MIC值。根据结果制备1/2MIC、1/4MIC、1/8MIC 3个药物浓度的含药平板,即2.5 g·L-1、1.25 g·L-1、0.625 g·L-1,分别为ASIV的小、中、大剂量。
3.3 ASIV对H.pylori尿素酶活性的影响与对照组比较,ASIV大剂量组和中剂量组尿素酶活性显著降低(P<0.05)。提示ASIV对H.pylori尿素酶活性具有抑制作用。结果见表2,图3。
表2 ASIV对H.pylori尿素酶活性的影响 (±s)

表2 ASIV对H.pylori尿素酶活性的影响 (±s)
注:与对照组比较,*P<0.05;**P<0.01
组别 尿素酶活性/mU·min-1 抑制率/%对照组322.14±26.42 -ASIV小剂量组 301.30±26.22 6.47±2.89 ASIV中剂量组 262.77±36.17* 18.01±11.82 ASIV大剂量组 234.99±32.56**27.05±10.10

图3 ASIV对幽门螺杆菌尿素酶活性的影响
3.4 ASIV对H.pylori鞭毛动力的影响与对照组比较,ASIV大、中、小剂量组H.pylori菌膜晕圈直径减小,但差异无统计学意义(P>0.05)。提示ASIV对幽门螺杆菌鞭毛动力无明显影响。结果见表3。
表3 ASIV对H.pylori菌膜晕圈直径的影响 (±s)

表3 ASIV对H.pylori菌膜晕圈直径的影响 (±s)
组别 菌膜晕圈直径(l/mm)17.80±2.58 ASIV小剂量组 17.20±1.87 ASIV中剂量组 15.80±1.48 ASIV大剂量组对照组15.00±3.53
3.5 ASIV对H.pylori定植相关基因表达水平的影响以16S rRNA基因作为内参,采用2-ΔΔCT对ASIV作用后H.pylori定植相关基因表达差异进行分析。与对照组比较,ASIV大剂量组尿素酶基因ureA和ureB的表达显著降低(P<0.05),而其他定植相关基因表达未见明显差异(P>0.05)。提示ASIV可通过抑制尿素酶基因表达影响幽门螺杆菌的定植。见图4。

图4 黄芪甲苷对幽门螺杆菌定植相关基因mRNA表达的影响
4 讨论
H.pylori是一种螺旋状革兰氏阴性微需氧菌,主要定植于胃黏膜上皮细胞表面,全球有超过50%的人群感染,大多数感染者没有症状,但少数感染者可发展为慢性胃炎和消化性溃疡,极少数感染者可发生胃癌和胃黏膜相关淋巴组织淋巴瘤[9]。尿素酶活性、鞭毛动力及黏附素的表达是幽门螺杆菌在胃内得以生存,并实现黏附定植的前提,与H.pylori致病性密切相关[10]。H.pylori尿素酶可以水解尿素生成氨和二氧化碳,氨溶于水生成氢氧化铵,调节胃内pH值,缓解酸性环境,使H.pylori可以安全通过胃液。H.pylori尿素酶由尿素酶基因簇ureA/B、ureI、ureE-H等基因编码,其中ureA/B具有高度保守性,是PCR检测常选择的目的基因[11]。同时,尿素酶还可以诱导中性粒细胞和单核细胞聚集,促进IL-6、TNF-α等炎症细胞因子的产生[12]。因此,尿素酶在细菌定植及诱导炎症反应中发挥重要作用。鞭毛运动是H.pylori定植的关键因素,由鞭毛和菌体组成的特殊螺旋结构,为H.pylori提供了省力的形态学结构并为其穿梭胃黏液层定植于胃黏膜提供了便利条件。在鞭毛的作用下,H.pylori可通过胃黏膜上皮层向pH值接近7.0的基底层移动[13]。H.pylori一端有4~7条鞭毛,主要由基体、鞭毛钩及鞭毛丝组成。鞭毛丝又由FlaA和FlaB两种鞭毛蛋白组成,分别由flaA和flaB两种基因编码产生。若同时缺乏FlaA和FlaB,鞭毛和动力均消失,H.pylori失去致病性[14]。胃内定植是H.pylori致病的前提,而黏附是定植的关键[15],H.pylori的黏附作用主要是通过特异性黏附素介导[16]。目前已发现20多种黏附素,包括血型抗原结合黏附素(blood-group antigen-binding adhesion,BabA)、唾液酸结合黏附素(sialic acid-binding adhesion,SabA)、黏附相关脂蛋白A和B(The adherence-associated lipoprotein A and B,AlpA/B)等,分别由黏附素基因babA、sabA、alpA、alpB编码。其中,BabA是研究比较明确的黏附素,能与胃黏膜上皮细胞表达的血型抗原Lewis b相结合[17]。SabA是一种细菌表面蛋白,主要与H.pylori感染后的炎症反应和持续黏附有关[18]。AlpA、AlpB是两种具有特异性黏附功能的外膜蛋白,主要与宿主的黏连蛋白结合介导细菌对胃黏膜上皮的黏附[19]。在黏附素基因突变情况下,幽门螺杆菌黏附能力明显降低,失去致病性。
近年来,H.pylori对抗生素的耐药性增强成为H.pylori根除治疗失败的主要原因[20]。中西医结合治疗可提高H.pylori根除率或改善患者症状,提高消化性溃疡愈合质量[21]。目前已发现多种中药或其有效成分可通过干预H.pylori致病的多个生理病理环节发挥抗H.pylori作用[22]。
黄芪(Astragali Radix)为一类临床上应用较为广泛的补益类中药材,性微温,味甘,归脾、肺经,具有补气升阳、益气固表、托毒生肌、利水退肿的功效。现代药理研究表明,黄芪具有增强和调节免疫功能、广谱抗病毒、抗衰老、清除过剩氧自由基等作用。临床研究发现,黄芪与桂枝、白芍、甘草、生姜等配伍的黄芪建中汤加减方有很好的抗H.pylori疗效[6]。陈昶洲等[23]通过临床观察发现四联疗法(铋剂+PPI+两种抗菌药物)联合黄芪颗粒能有效提高慢性胃炎伴消化不良患者的H.pylori根除率,且具有良好的安全性。王成喜等[24]发现,黄芪具有杀灭H.pylori、抗溃疡、抑制胃酸分泌等作用。ASIV为黄芪的主要活性成分,具有抗病毒、抗氧化、调节机体免疫等功能。越来越多的实验研究发现,ASIV有较好的抗菌作用,对大肠埃希菌、沙门菌、金黄色葡萄球菌,甚至结核分枝杆菌的抑菌作用均有报道[25]。在本实验中,我们通过考察ASIV对H.pylori定植相关因子(尿素酶活性、鞭毛动力、ureA、ureB、flaA、flaB、babA、sabA、alpA、alpB等定植相关基因)的影响,发现ASIV能消弱H.pylori的定植能力,且主要是通过抑制尿素酶的活性和下调尿素酶相关基因(ureA、ureB)mRNA水平来实现的。

