党参多糖调控NF-κB信号通路对慢性阻塞性肺疾病大鼠T细胞免疫紊乱和气道炎症的影响*
林小玲,方草,柯维强
(海南医学院第二附属医院药学部,海口 570311)
慢性阻塞性肺疾病简称慢阻肺,是一种常见呼吸系统疾病,主要表现为持续的气流受阻、炎症反应、免疫功能异常。慢阻肺发病率和病死率近年来逐渐上升,已成为人类第四大死亡原因,严重威胁人类生命健康[1]。由于慢阻肺病程久,易反复发作,长期使用西药治疗,不仅费用较高而且药物毒副作用大,导致患者依从性低[2]。党参味甘,平,归脾肺经,可健脾益肺,补血生津,用于治疗肺脾气虚。党参多糖是党参主要活性成分之一,有研究表明党参多糖可调节机体免疫力,抑制炎症反应[3]。T细胞免疫紊乱和气道炎症与慢阻肺发病过程密切相关。党参多糖对慢阻肺“肺脾气虚证”T细胞免疫紊乱和气道炎症是否有治疗效果目前尚未可知。党参多糖是否通过调节核转录因子κB(NF-κB)信号通路发挥药效尚未见报道。因此本研究探索党参多糖对慢阻肺肺脾气虚证大鼠T细胞免疫紊乱和气道炎症的治疗效果,为党参多糖在临床治疗慢阻肺肺脾气虚证的应用,提供理论依据。
1 实验材料与方法
1.1 材料 6周龄60只SPF级SD大鼠,雌雄各半,体质量180~220 g购自上海灵畅生物科技有限公司[生产许可 SCXK(沪)2018-0003];云烟购自云南云烟红河烟草(集团)有限责任公司,焦油量10 mg,烟气烟碱量1.1 mg,烟气一氧化碳量12 mg;番泻叶购自张仲景大药房;党参多糖购自陕西慈缘生物技术有限公司,纯度≥98%;地塞米松片购自江西汇仁药业有限公司;瑞氏-吉姆萨(Giemsa)染色液和苏木素-伊红(HE)染色液购自北京Solarbio公司;Trizol、细胞核蛋白与胞浆蛋白抽提试剂盒均购自购自美国赛默飞公司;反转录试剂盒购自美国罗氏公司;免疫沉淀试剂盒购自美国Thermo Fisher公司;CD3+、CD4+、CD8+、NF-κB、核因子 κB 抑制蛋白 α(IκBα)、磷酸化核因子 κB 抑制蛋白 α(p-IκBα)单克隆抗体及辣根过氧化物酶(HRP)标记二抗均购自美国Abcam公司;化学发光法(ECL)试剂盒购自美国Invitrogen公司;EMSA探针-OCT购自南京碧云天公司;引物合成委托苏州GENEWIZ公司。
CoulterEpics XL流式细胞仪美国Beckman公司;BX60光学显微镜日本Olympus公司;TGL-16M高速冷冻离心机山东Biobase公司;RM2125RTS石蜡切片机德国Leica公司;VOSHIN07-II紫外交联仪无锡沃信仪器有限公司;DYCZ-24DN迷你垂直电泳仪购自北京六一仪器厂。
1.2 方法
1.2.1 分组与干预 随机选取50只大鼠建立慢阻肺肺脾气虚证模型,余下10只记作对照组。共建模49 d,分别在建模第1天和第15天向大鼠气管内滴注 1 μg/μL 的脂多糖 200 μL。建模第 2~13 天和第15~40天将大鼠置于烟熏箱中被动吸烟0.5 h,每日2次,每次间隔4 h。自建模第20天起,取番泻叶3 g,用300 mL的沸水浸泡15 min后,置于4℃预冷制备大鼠肺脾气虚泻下模型,大鼠每日给予预冷的1 g/mL番泻叶浸液,按大鼠体质量1 mL/kg灌胃,每日1次,持续30 d。观察大鼠出现食欲减退,持续泄泻,随机挑出3只大鼠,通过HE染色发现大鼠气道壁增厚等病变,表明慢阻肺肺脾气虚证大鼠建模成功[4],对照组大鼠正常环境下饲养。将成功建模的大鼠随机分为5组:地塞米松组,党参多糖高、中、低剂量组,模型组。地塞米松组给予1.95 mg/kg的地塞米松,党参多糖高、中、低剂量组分别给予200、100、50mg/kg的党参多糖,按模型组和对照组均按照大鼠体质量1 mL/kg灌胃生理盐水。每日1次,连续治疗30 d。
1.2.2 大鼠外周血 CD3+、CD4+、CD4+/CD8+水平检测 取大鼠尾静脉血,加入肝素抗凝,取100 μL抗凝血,加入 5 μL CD3+、CD4+、CD8+单克隆抗体,4 ℃避光孵育30min,加入1mL溶血素,避光孵育10min后,使用磷酸盐缓冲液(PBS)清洗细胞2次,离心弃上清液,加入500 μL PBS重悬浮后,使用流式细胞仪进行检测分析。
1.2.3 大鼠支气管肺泡灌洗液炎性细胞计数 打开大鼠胸腔,结扎一侧肺门,分离气管并切口,气管插管,向气管内注入无菌生理盐水,反复抽注3次后,收集灌洗液至离心管中。离心半径8 cm,1 500 r/min 4℃离心5 min,弃上清液,用1 mL生理盐水将细胞重悬浮,取20 μL细胞悬液低于细胞计数板中,风干后,使用10%福尔马林溶液固定5 min。按照试剂盒说明书对样品进行Giemsa染色后,进行细胞分类计数。
1.2.4 大鼠肺组织病理学观察 取大鼠肺组织,经过10%福尔马林溶液室温浸泡固定过夜,进行石蜡包埋,将石蜡块切成厚度5 μm切片,按照HE染色试剂盒说明书对切片进行HE染色。使用中性树脂封片后在光镜下观察肺组织病变。
1.2.5 大鼠肺组织 NF-κB、IκBα 信使核糖核酸(mRNA)相对表达量检测 取大鼠肺组织,加入少量液氮,研磨匀浆。向组织匀浆加入Trizol,按照提取细胞中总核糖核酸(RNA),并立即反转录为互补脱氧核糖核酸(cDNA),从美国国家生物信息中心(NCBI)上查找出 NF-κB、IκBα mRNA 序列,设计出NF-κB、IκBα 上下游引物,NF-κB 上游引物:5’-TACCGTAGCCTAGACCGTAGA-3’,下游引物:5’-GTCAGCTTGACGGATATACG-3’;IκBα 上游引物:5’-CGTTAGACGTAGCAGCTGAT-3’,下游引物:5’-CTAGCGATCGTGGAACTACG-3’;β-actin 上游引物:5’-TAGTCGCTAGGGATCGGATAC-3’,下游引物:5’-CTCGGATACGGATACACTGA-3’。以 β-actin 为内参基因,根据 2-△△Ct计算出 NF-κB、IκBα mRNA 相对表达量。
1.2.6 大鼠肺组织 NF-κB和 IκBα 结合情况检测 取大鼠肺组织研磨成浆后,使用免疫共沉淀试剂盒,按照说明书操作,检测NF-κB结合IκBα蛋白表达水平。
1.2.7 大鼠肺组织中NF-κB与DNA结合情况检测 取大鼠肺组织,研磨匀浆提取细胞核蛋白。设计NF-κB生物素标记探针:上游:5’-TAGGCTCT-GATGCTAGCAAGGGTAG-3’,下游:5’-TAGGCTCTGATGCTAGCAAGGGTAG-3’将生物素标记的κB寡聚核苷酸探针与核蛋白室温避光孵育20 min,使用4%非变形丙烯酰胺凝胶进行电泳。转膜,使用紫外交联仪交联1 min。使用ECL试剂盒显色,设置Oct-1为内参,分析条带灰度值。
1.2.8 大鼠肺组织核 NF-κB、胞浆 NF-κB、IκBα 蛋白表达水平及p-IκBα水平检测 取大鼠肺组织,研磨匀浆,使用细胞核蛋白与胞浆蛋白抽提试剂盒分别抽提细胞核蛋白和浆蛋白。取20 μL蛋白样品进行凝胶电泳。转膜,使用5%牛血清白蛋白(BSA)封闭液室温置于摇床上封闭2 h。加入一抗,4℃孵育过夜,使用含吐温-20的磷酸盐缓冲液(PBST)清洗膜3遍后,加二抗,室温孵育2 h,ECL显色。以β-actin为内参,根据条带灰度值,计算出目的蛋白相对表达量。
1.3 统计学分析 使用SPSS 23.0对结果进行统计学分析,计量资料使用均数±标准差(±s)表示,多组间比较使用单因素方差分析,组间两两比较使用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠外周血 CD3+、CD4+、CD4+/CD8+水平检测 共有48只大鼠建模成功,余下2只由于番泻叶浸液灌胃操作不当出现死亡。
大鼠外周血 CD3+、CD4+、CD4+/CD8+水平检测结果显示:治疗后,模型组均低于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均高于模型组(P<0.05),与地塞米松组比较,党参多糖高剂量组均升高(P<0.05),低剂量组均降低(P<0.05),见表 1。
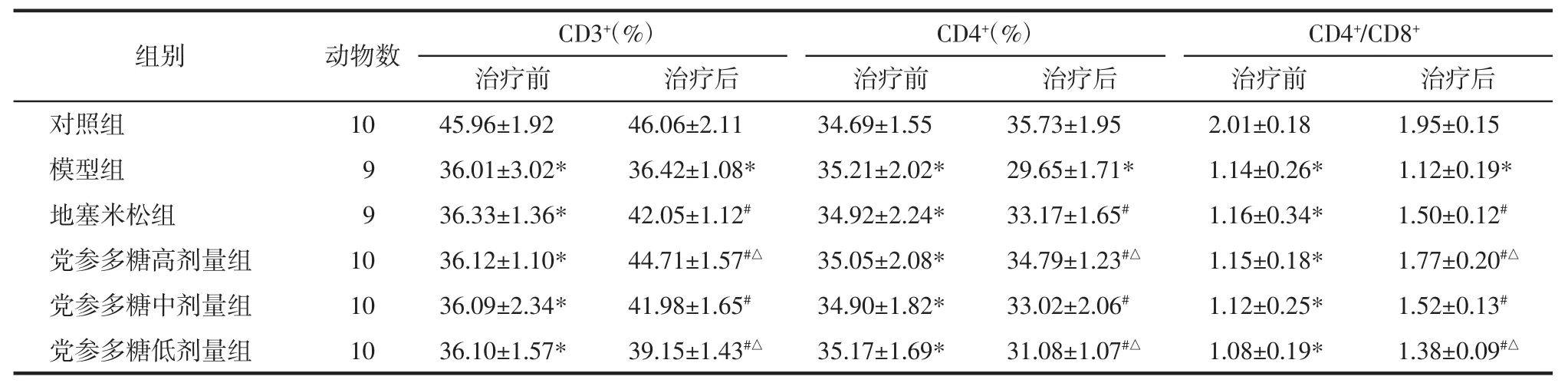
表1 治疗前后大鼠T淋巴细胞亚群表达结果Tab.1 Expression results of rats’T lymphocyte subsets before and after treatment
2.2 支气管肺泡灌洗液炎性细胞计数 模型组均高于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均低于模型组(P<0.05),与地塞米松组比较,党参多糖高剂量组均降低(P<0.05),低剂量组均升高(P<0.05)。见表 2。
表2 大鼠支气管肺泡灌洗液中炎性细胞计数结果(±s)Tab.2 Results of inflammatory cell count in rats’bronchoalveolar lavage fluid(±s)

表2 大鼠支气管肺泡灌洗液中炎性细胞计数结果(±s)Tab.2 Results of inflammatory cell count in rats’bronchoalveolar lavage fluid(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05。
巨噬细胞 淋巴细胞 中性粒细胞对照组 10 289.36± 61.25 18.52± 3.27 41.15± 8.33模型组 9 1 148.23±219.06*108.66±27.51*376.59±77.41*地塞米松组 9 582.56±108.38# 59.73±10.36#152.32±28.04#党参多糖高剂量组 10 322.15± 79.91#△ 34.62± 5.48#△ 88.36±12.39#△党参多糖中剂量组 10 527.92±84.77# 55.49±8.62#162.48±22.34#党参多糖低剂量组 10 862.79±121.50#△ 83.48±11.69#△ 239.68±37.80#△组别 动物数
2.3 大鼠肺组织病理学观察 与对照组相比,模型组大鼠肺组织出现严重炎性细胞浸润,小支气管平滑肌明显增厚,有肺小泡形成并且肺泡间隔破坏;地塞米松组和党参多糖高、中、低剂量组支气管平滑肌厚度轻度增加,炎性浸润程度均减轻,肺泡间隔破坏减轻。见图1。

图1 大鼠肺组织病理学观察(HE,×200)Fig.1 Pathological observation of rats’lung tissue(HE,×200)
2.4 肺组织NF-κB、IκBα mRNA相对表达量 模型组均高于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均低于模型组(P<0.05),与地塞米松组相比,党参多糖高剂量组均降低(P<0.05)、低剂量组均升高(P<0.05),IκBα mRNA 相对表达量模型组均低于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均高于模型组(P<0.05),与地塞米松组比较,党参多糖高剂量组均升高(P<0.05),低剂量组均降低(P<0.05)。见表3。
表3 大鼠肺组织 NF-κB、IκBα mRNA 相对表达量(±s)Tab.3 Relative expression of NF-κB and IκBα mRNA in rats’lung tissue(±s)
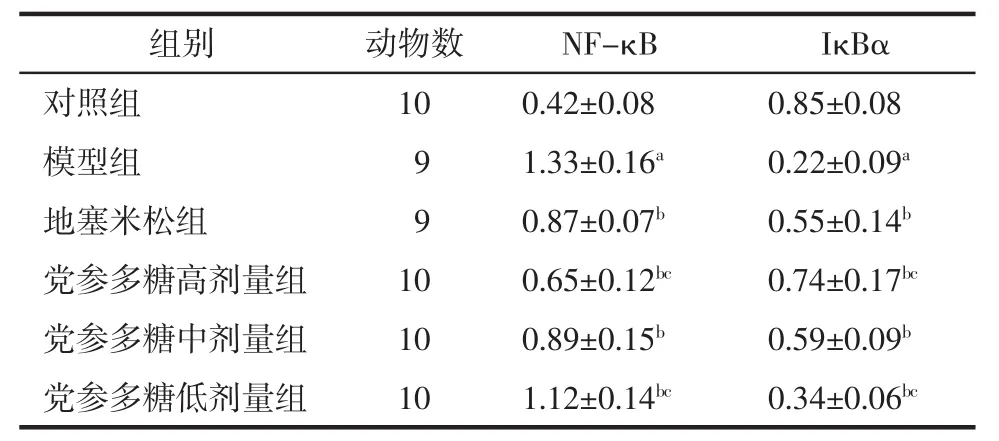
表3 大鼠肺组织 NF-κB、IκBα mRNA 相对表达量(±s)Tab.3 Relative expression of NF-κB and IκBα mRNA in rats’lung tissue(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与地塞米松组比较,cP<0.05。
组别 动物数 NF-κB IκBα对照组 10 0.42±0.08 0.85±0.08模型组 9 1.33±0.16a 0.22±0.09a地塞米松组 9 0.87±0.07b 0.55±0.14b党参多糖高剂量组 10 0.65±0.12bc 0.74±0.17bc党参多糖中剂量组 10 0.89±0.15b 0.59±0.09b党参多糖低剂量组 10 1.12±0.14bc 0.34±0.06bc
2.5 大鼠肺组织NF-κB和IκBα结合情况检测 免疫共沉淀结果显示,IκBα与NF-κB可结合,且模型组IκBα和NF-κB结合最少,党参多糖低剂量组稍多,地塞米松组和中剂量组较多,党参多糖高剂量组更多,对照组最多。见图2。

图2 免疫共沉淀检测大鼠肺组织NF-κB和IκBα结合情况Fig.2 Co-immunoprecipitation to detect the binding of NF-κB and IκBα in rats’lung tissues
2.6 大鼠肺组织中NF-κB与DNA结合情况检测 EMSA结果显示,NF-κB灰度值模型组均高于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均低于模型组(P<0.05),与地塞米松组相比,党参多糖高剂量组均降低(P<0.05)、低剂量组均升高(P<0.05)。见图 3,表 4。
2.7 大鼠肺组织核 NF-κB、胞浆 NF-κB、IκBα 蛋白表达水平及p-IκBα水平 结果显示模型组均高于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均低于模型组(P<0.05),与地塞米松组比较,党参多糖高剂量组均降低(P<0.05),低剂量组均升高(P<0.05);胞浆NF-κB 和 IκBα 蛋白表达水平:模型组均低于对照组(P<0.05),地塞米松组和党参多糖高、中、低剂量组均高于模型组(P<0.05),与地塞米松组比较,党参多糖高剂量组均升高(P<0.05),低剂量组均降低(P<0.05)。见表4,图4。

图4 大鼠肺组织核NF-κB、胞浆NF-κB、IκBα蛋白表达水平及 p-IκBα水平(WB)Fig.4 Rats’lung tissue nuclear NF-κB,cytoplasmic NF-κB,IκBα protein expression levels and p-IκBα levels(WB)
表4 各组大鼠肺组织NF-κB相对灰度值(±s)Tab.4 Relative gray value of NF-κB in lung tissue of rats in each group(±s)

表4 各组大鼠肺组织NF-κB相对灰度值(±s)Tab.4 Relative gray value of NF-κB in lung tissue of rats in each group(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与地塞米松组比较,cP<0.05。
组别 动物数 NF-κB对照组 10 0.33±0.04模型组 9 12.76±1.35a地塞米松组 9 4.33±0.77b党参多糖高剂量组 10 1.02±0.14bc党参多糖中剂量组 10 3.79±0.23b党参多糖低剂量组 10 7.37±1.14bc
表4 大鼠大鼠肺组织核NF-κB、胞浆NF-κB、IκBα蛋白相对表达水平及 p-IκBα 水平(±s)Tab.4 The relative expression levels of nuclear NF-κB,cytoplasmic NF-κB,and IκBα protein in rat’lung tissue and the level of p-IκBα(±s)

表4 大鼠大鼠肺组织核NF-κB、胞浆NF-κB、IκBα蛋白相对表达水平及 p-IκBα 水平(±s)Tab.4 The relative expression levels of nuclear NF-κB,cytoplasmic NF-κB,and IκBα protein in rat’lung tissue and the level of p-IκBα(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与地塞米松组比较,△P<0.05。
组别 动物数 核NF-κB 胞浆NF-κB IκBα p-IκBα对照组 10 0.26±0.04 0.56±0.12 0.85±0.06 0.13±0.03模型组 9 1.42±0.18*0.12±0.02*0.35±0.10*0.85±0.12*地塞米松组 9 0.65±0.12#0.36±0.05#0.52±0.10#0.54±0.10#党参多糖高剂量组 10 0.39±0.06#△ 0.44±0.08#△ 0.71±0.19#△ 0.32±0.06#△党参多糖中剂量组 10 0.60±0.11#0.35±0.07#0.51±0.08#0.57±0.04#党参多糖低剂量组 10 0.91±0.18#△ 0.17±0.06#△ 0.44±0.05#△ 0.69±0.14#△
3 讨论
慢阻肺在中医归属于“咳嗽”“喘证”“肺胀”“痰饮”,是由于外邪侵袭犯肺,致内生痰浊,导致肺气阻滞,引起本虚标实。脾虚引起气血乏源,进一步加重肺虚,循环反复,导致肺脾两虚[5]。中药党参为草本植物党参的根部,是补益类传统药材,具有补中益气、健脾益肺的功效,用于治疗脾胃虚弱、肺虚咳喘、气微两亏等[6]。有研究表明,党参多糖可抑制慢阻肺小鼠肺泡巨噬细胞功能障碍[7]。因此本研究使用探索党参多糖对慢阻肺大鼠T细胞免疫胞免疫和气道炎症的作用具有可行性。
有研究表明T淋巴细胞亚群失衡是引起慢阻肺发病的机制之一[8]。CD3+由成熟的T淋巴细胞表达,是成熟T淋巴细胞表面标志物,CD3+表达降低,表示外周血中成熟的T淋巴细胞数量下降[9]。CD4+是辅助淋巴细胞表面标志物,可调控或协助其他类型免疫细胞的激活,对体液免疫和细胞免疫均具有促进作用[10]。CD8+是细胞毒T淋巴细胞表面标志物,可特异性杀伤受感染细胞,免疫学上使用CD4+/CD8+表示机体免疫防御状态,CD4+/CD8+比值降低表示机体免疫功能降低[11]。本研究结果显示,慢阻肺模型大鼠肺组织灌洗液中巨噬细胞、淋巴细胞和中性粒含量显著高于对照组,而经过党参多糖治疗后,巨噬细胞、淋巴细胞和中性粒含量均出现降低,表明党参多糖可抑制慢阻肺大鼠气道炎症反应。
NF-κB是机体重要转录因子,可调节免疫反应、炎症反应过程中的众多信号通路[12]。NF-κB在正常生理状态下与IκB结合,存在细胞浆中,导致NF-κB失活。当机体受到外界刺激后,NF-κB信号被激活,IκB 磷酸化导致 NF-κB 与 IκB 分离,游离的 NF-κB进入细胞核与多种下游靶基因结合,诱导多种促炎因子释放,引起炎症反应[13]。本研究结果显示,慢阻肺大鼠肺组织NF-κB与IκBα结合水平较低,而NF-κB 与 DNA 结合水平较高,NF-κB mRNA、核NF-κB 蛋白及 p-IκBα 水平均升高,IκBα mRNA 和蛋白水平、胞浆NF-κB蛋白水平均降低,而经过党参多糖治疗后,NF-κB 与 IκBα 结合水平升高,NF-κB与 DNA 结合水平降低,NF-κB mRNA、核 NF-κB 蛋白及 p-IκBα 水平均降低,IκBα mRNA 和蛋白水平、胞浆NF-κB蛋白水平均升高,由此可推测,党参多糖可减轻慢阻肺“肺脾气虚证”大鼠T细胞免疫紊乱和气道炎症与抑制NF-κB信号通路激活,抑制NF-κB核位移有关。
综上所述,党参多糖可抑制慢阻肺“肺脾气虚证”大鼠T细胞免疫紊乱,减轻气道炎症反应和肺组织病变,推测可能与抑制NF-κB信号传导,下调NF-κBmRNA、抑制NF-κB 核位移及抑制 p-IκBα 水平,上调 IκBα mRNA、蛋白表达水平及胞浆 NF-κB蛋白表达水平有关。本研究仅从动物实验的层面研究党参多糖对慢阻肺肺脾气虚患者T细胞免疫紊乱和气道炎症的治疗作用,党参多糖治疗慢阻肺肺脾气虚患者的临床疗效尚未可知,仍需进一步研究。

