利用流式细胞术鉴定茉莉花基因组大小和染色体倍性
李春牛 李先民 黄展文 卢家仕 李琴 黄昌艳 卜朝阳

摘 要:以收集的16份茉莉花资源及50份实生种质为材料,以玉米B73为内参,采用流式细胞术估测茉莉花基因组大小,并以二倍体品种为对照,计算茉莉花染色体倍性。结果表明:内参与待测样品峰值能完全分开,无重叠峰,峰型清晰集中,可对茉莉花基因组大小进行有效估测;供试材料中有56份二倍体,基因组大小为0.54~0.63 Gb,有7份三倍体,基因组大小为0.79~0.96 Gb,有3份四倍体,基因组大小为1.04~1.12 Gb;从收集的资源中鉴定出二倍体和三倍体,未见四倍体,而从实生种质中鉴定出3个四倍体、2个三倍体,表明实生选种是茉莉花种质創新的一条有效途径;在已明确花冠类型的材料中,三倍体及四倍体均为单瓣型茉莉。该研究结果为茉莉花倍性育种及实生选种提供科学依据。
关键词:茉莉花;流式细胞术;基因组大小;染色体倍性;实生选种
中图分类号:S961.6 文献标识码:A
Abstract: Using Zea mays ‘B73 as the internal reference, the genome size of 66 Jasminum sambac germplasm (16 col-lected germplasms and 50 seedings) were estimated by the flow cytometry, and the ploidy was calculated using diploid as the control. Using Zea mays ‘B73 as the internal parameter could effectively estimate the genome size of J. sambac, the peaks of the samples under test could be separated completely, and no overlapping peaks and peaks could be clearly concentrated. 56 germplasms were diploid with genome size between 0.54 Gb and 0.63 Gb, Seven germplasms were triploid with genome size between 0.79 Gb and 0.96 Gb, Three germplasms were tetraploid with genome size range from 1.04 Gb to 1.12 Gb. Three tetraploid and two triploid were found in the seedings, which showing that seed selec-tion is an effective way of germplasm innovation for J. sambac. All the tetraploid and triploid blossomed were simple flower. The results of the study wouldl provide important reference basis for the ploidy breeding and seed selection of J. sambac.
Keywords: Jasminum sambac; flow cytometry; genome size; ploidy; seedling selection
DOI: 10.3969/j.issn.1000-2561.2021.05.005
茉莉花Jasminum sambac (L.) Ait.系木犀科(Oleaceae)素馨属(Jasminum)植物,原产于印度,现在我国南方和世界各地均有广泛栽培,可用于花茶加工、香精提取、观赏及药用等[1]。我国规模化种植茉莉花主要用于花茶加工,全国种植面积为12 300 hm2,年产鲜花为120 600 t,年产茉莉花茶为110 800 t[2]。根据花冠层数,茉莉花一般分为单瓣茉莉、双瓣茉莉及多瓣茉莉。单瓣茉莉花香型较好,多瓣茉莉花花冠大、花瓣多,观赏性更好。长期以来,我国茉莉花规模化种植品种单一,长期无性繁殖,品性退化、产量和质量不断下滑[3],茉莉花育种迫在眉睫。
茉莉花自然结实低[4-6]。Thompson等[5]研究认为素馨属多个种自交不亲和,生产上大规模种植单一品种,导致不结实。张泽岑[7]认为茉莉花花粉活力差、胚败育导致生殖障碍十分严重。Nair等[8]研究不同产地的20份茉莉花粉粒形状、萌发孔数目和外壁纹饰等特征,发现茉莉花粉的形态在进化上相对保守。邓衍明等[9]研究认为,通过花粉萌发率计算和花粉管长度测量,可最大限度地反映茉莉花粉的育性水平和生理状况。阮玉娟[10]采用秋水仙素诱导双瓣茉莉获得四倍体突变体。李春牛等[3]开展茉莉花60Co-γ射线辐照诱变育种研究,并获得诱变材料。随着茉莉花育性研究及育种工作的开展,茉莉花染色体倍性准确鉴定显得尤为重要。王湘平等[11]研究表明,双瓣茉莉花为二倍体,染色体核型公式2n=2x=26=8 m+16 sm+ 2 sm(SAT)。Datta[4]通过染色体观察发现2个二倍体(2n=26),1个三倍体(2n=39)。George等[12]对2份茉莉花材料进行染色体观察,发现1个二倍体和1个三倍体茉莉花,未发现其他多倍体。目前,我国多数茉莉花品种资源染色体的倍性尚不明确,不仅影响茉莉花育性研究、倍性育种和杂交育种工作的开展,也影响育种策略的选择。传统的染色体倍性鉴定主要是染色体观察法[13-14]和形态观察法[15],前者准确性高,但操作复杂、技术难度大、工作量大,后者主要根据多倍体的巨大型特点,准确性较差。近年来,流式细胞术(flow cytometry,FCM)已成为植物倍性鉴定、基因组大小测定等研究的重要工具[16]。流式细胞术是应用流式细胞仪进行分析、分选的技术,对处于液流中各种荧光标记的微粒进行多参数快速准确地定性、定量测量[17]。因其快速、灵敏及可同时进行倍性鉴定和基因组大小估测等特点而得到广泛应用[18-19],已经成功用于莲瓣兰和墨兰[20]、文心兰[21]、香蕉[22]、杏[23]、桑树[24]、柑橘[15]等植物染色体倍性鉴定。
本研究采用流式细胞术鉴定16份茉莉花资源及50份实生种质的基因组大小和染色体倍性,并探讨染色体倍性与茉莉花花冠类型的关系,为茉莉花种质创新和倍性育种研究提供参考依据。
1 材料与方法
1.1 材料
供试材料包括16份收集的茉莉花种质资源、50株自然结实种子苗。供试材料种植于广西农业科学院花卉研究所茉莉花资源圃,管理和栽培环境基本一致。对照品种为二倍体‘横县双瓣茉莉花。内参为玉米B73(Zea mays ‘B73),基因组大小为2.3 Gb,以种子萌发后1个月的嫩叶为试验材料,其种子取自中国科学院昆明植物研究所。流式细胞仪由美国Becton Dickinson公司生产,型号为BD FACScalibur。
1.2 方法
1.2.1 细胞悬浮液制备 采集供试种质的嫩叶为试验样品。参考田新民等[17]的方法配制MGb解离液。将样品置于0.8 mL预冷的MGb解离液中,用锋利的刀片将组织迅速垂直切碎,使其在解离液中冰上静置10 min,然后用400目滤网过滤得到细胞核悬浮液。在细胞核悬液加适当体积的预冷的碘化丙啶(PI)(母液浓度1 mg/mL)和适当体积的RNAase溶液(母液浓度1 mg/mL),置于冰上避光染色0.5~1.0 h。PI染液和RNAase溶液的工作浓度均为50 μg/mL。
1.2.2 流式细胞仪检测 将待测样品的悬液和内参样品的悬液按适当比例混合。利用流式细胞仪对染色后的细胞核悬浮液样品上机检测,采用488 nm蓝光激发,检测碘化丙啶的发射光荧光强度,每次检测至少收集10 000个细胞颗粒,变异系数(CV)控制在5%以内。
1.2.3 基因组大小及倍性计算 待测样品DNA含量=内参DNA含量(待测样品的荧光强度/内参样品的荧光强度)。待测样品的倍性=已知品种的倍性(待测样品的DNA含量/已知品种的DNA含量)。
1.3 数据处理
试验数据采用Modifit 3.0软件分析和制图。
2 结果与分析
2.1 流式细胞倍性鉴定
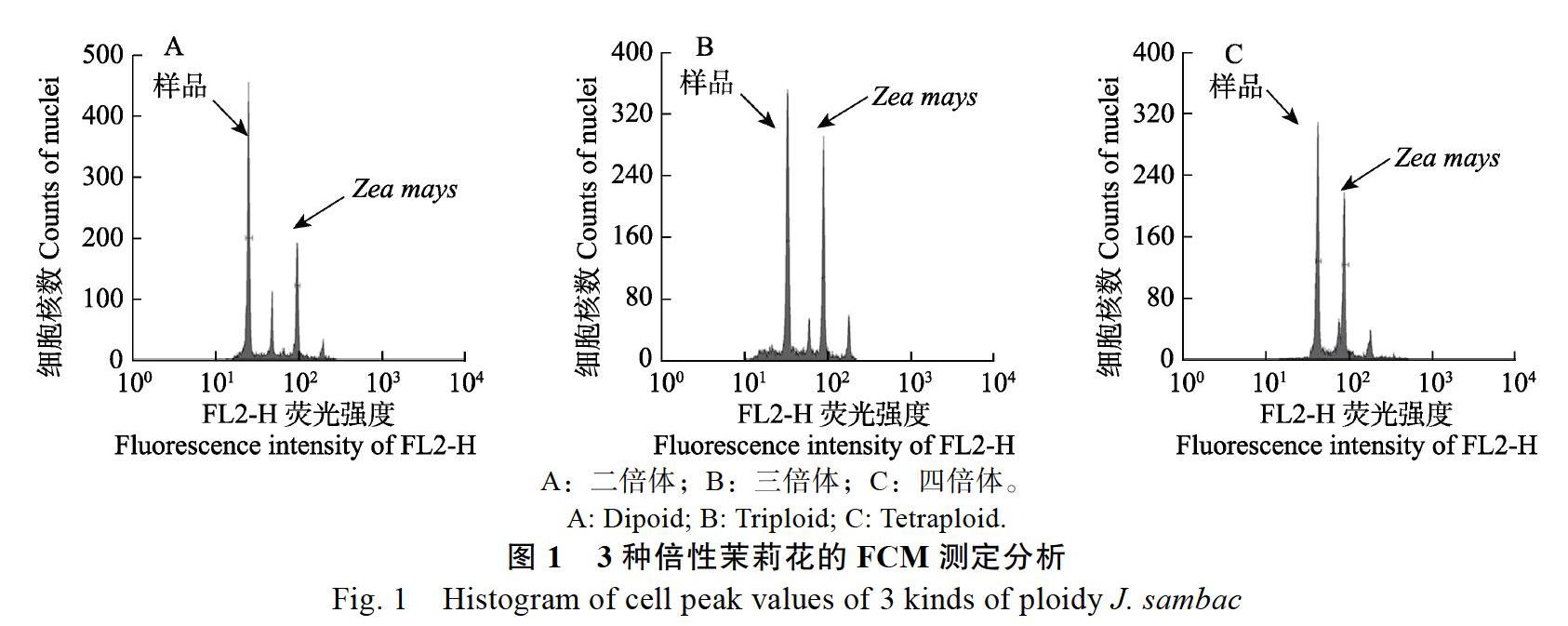
以玉米B73为内参,采用内参法对茉莉花DNA含量进行测定,待测样品与内参样品同时进行检测。图1展示部分样品DNA含量测定的直方图,分别为二倍体‘横县双瓣茉莉、三倍体‘越南单瓣茉莉、四倍体(F15001)。内参与待测样品峰值能完全分开,无重叠峰,峰型清晰集中。表明以玉米B73为内参测定茉莉花DNA含量具有可行性。
2.2 收集资源的倍性分析
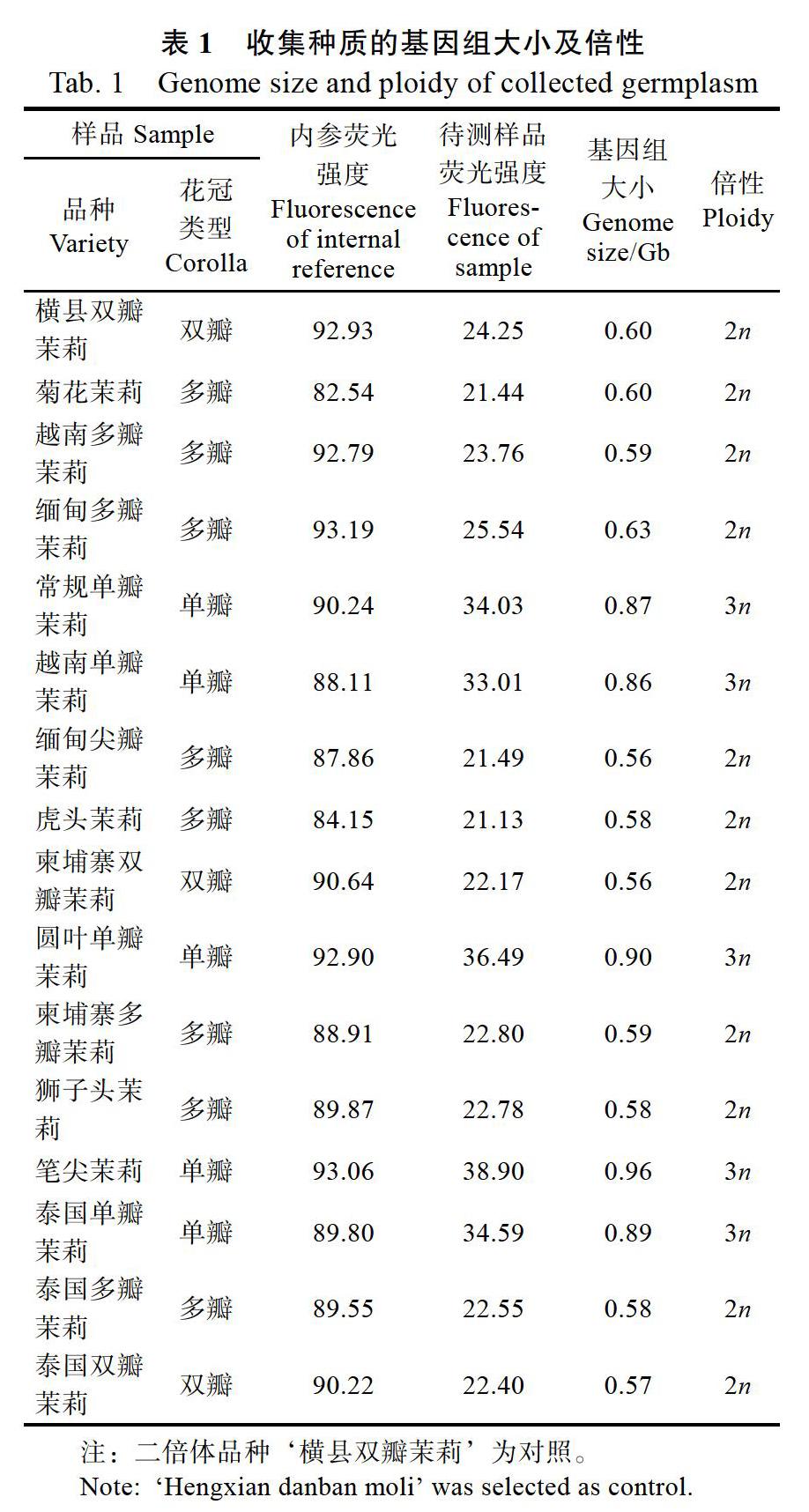
对收集的16份茉莉花资源DNA含量进行测定,根据内参及待测样品的荧光强度(表1),计算出待测樣品的基因组大小为0.56~0.96 Gb,其中对照品种二倍体‘横县双瓣茉莉基因组大小为0.6 Gb。根据待测资源的基因组大小与对照基因组大小的关系,计算出待测茉莉花染色体倍性。结果表明,所收集的16份资源中有11份为二倍体,基因组大小为0.56~0.63 Gb;‘常规单瓣茉莉‘越南单瓣茉莉‘圆叶单瓣茉莉‘笔尖茉莉及‘泰国单瓣茉莉等5份茉莉花种质资源为三倍体,基因组大小为0.86~0.96 Gb(表1)。收集的茉莉花种质有二倍体和三倍体,未见四倍体。
2.3 实生种质的倍性分析
对50份实生种质DNA含量进行测定(表2),计算出待测样品的基因组大小为0.54~1.12 Gb。以二倍体‘泰国双瓣茉莉为对照,计算出实生种质的染色体倍性。共鉴定出二倍体45份、三倍体2份、四倍体3份。其中,从三倍体‘越南单瓣茉莉的3份实生种质中鉴定出四倍体2份,三倍体1份。三倍体‘圆叶单瓣茉莉的1株实生苗鉴定为三倍体。从二倍体‘横县双瓣茉莉的30份实生种质中鉴定出二倍体29份,四倍体1份。二倍体‘泰国双瓣茉莉的11株实生苗鉴定为二倍体。二倍体‘柬埔寨双瓣茉莉的4株实生苗鉴定为二倍体。二倍体品种‘缅甸尖瓣茉莉的1株实生苗鉴定为二倍体。
从茉莉花实生种质中获得二倍体、三倍体和四倍体,丰富了茉莉花种质的染色体倍性,表明实生选种是一种有效的茉莉花育种途径。
2.4 染色体倍性与花冠的关系分析
已观测到46份材料的花冠类型,单瓣茉莉10份,双瓣茉莉28份,多瓣茉莉8份(表1、表2)。二倍体中有单瓣茉莉、双瓣茉莉及多瓣茉莉,而5份三倍体及1份四倍体均为单瓣茉莉。染色体倍性增加,茉莉花花冠轮数并未增加,反而呈减少趋势,出现了多倍体的花冠轮数比二倍体少的现象。
3 讨论
流式细胞术可通过内参和外参法进行细胞核DNA含量测定。内参法可避免因样品的差异、机器的不稳定等因素造成的误差。通过内参法测定细胞核DNA含量时,内参细胞核DNA含量须已知且稳定,最好与待测样本细胞核DNA含量相近[17],内参样本峰不能与待测样本峰重叠,最好与待测样本的G2或M期峰值不重叠[25]。目前较常用的植物内参有鸡红细胞核[20, 26](参考基因组大小1.20 Gb)、玉米B73[27](参考基因组大小2.30 Gb)、番茄[28](参考基因组大小0.94 Gb)、豌豆[17](参考基因组大小4.64 Gb)等。本研究在预实验中发现待测茉莉花材料存在多种倍性,最大的基因组在1 Gb左右,玉米B73能与所有的待测样品完全分开,与内参样品的G2和M期峰值不重叠,玉米B73为内参测定茉莉花DNA含量是可行的。
植物基因组大小能为其进一步的基因组学研究和进化生物学研究提供理论基础[29]。茉莉花分子生物学方面的研究起步较晚,研究报道主要集中于分子标记开发、遗传多样性分析、香气物质合成相关酶基因的克隆等方面[30-33]。随着基因组学的发展,基因组大小成为基因组和转录组学研究的本底资料[20]。Suda等[34]鉴定了素馨属的Jasminum odoratissimum的C值为1.41 Gb,未见茉莉花DNA含量的相关研究报道。本研究估算出茉莉花基因组大小在0.54~1.12 Gb,为后续茉莉花基因组学和进化生物学研究提供参考。
对茉莉花染色体倍性进行测定,是研究茉莉花生殖发育、开展杂交育种或倍性育种工作的基础。本研究对66份茉莉花材料进行染色体倍性鉴定,发现56份二倍体、7份三倍体、3份四倍体。基于染色体倍性水平茉莉花种质资源具有丰富的遗传多样性。但值得注意的是,3份四倍体均来自实生种质。收集的种质资源只发现二倍体及三倍体,未发现其他多倍体,这与Datta[4]、George等[12]的研究结果一样。茉莉花生殖障碍十分严重,杂交育种进展缓慢。虽然茉莉花自然结实率低,但广西茉莉花种植面积近7 000 hm2,每年仍然能获得相当数量的种子[35]。本研究中,从5个品种的50份实生种质中鉴定获得三倍体2个,四倍体3个。因此,实生选种是茉莉花育种的一种有效途径。
多倍体是植物进化的一种方式,其外观形态、生理生化指标等一般发生巨大的改变[36],花、果通常均比二倍体大。阮玉娟[10]利用秋水仙素诱变二倍体茉莉花获得四倍体突变体,发现突变体花瓣加厚且数目增加。本研究中,有5份三倍体、1份四倍体共计6份多倍体茉莉花已确定花冠类型,均表现为单瓣型茉莉花,而二倍体中有双瓣茉莉、多瓣茉莉型,出现多倍体花冠轮数和花冠裂片数目比二倍体少的现象。这可能是不同种或不同基因型对染色体倍性变异的反应不同,表型变异不同[37-38]。茉莉花染色体倍性增加不一定能获得花冠层数多、花径大的多瓣型茉莉花,这为选择茉莉花育种策略提供参考。茉莉花多倍体外观形态、生理生化指标的变化有待进一步研究。
致谢 流式细胞仪检测及数据分析得到了中国科学院昆明植物研究所贾艳霞高级工程师的指导和帮助,特此致谢。
参考文献
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1992: 218.
[2] 梅 宇, 梁 晓. 2019中国茉莉花茶产销形势分析报告[J]. 茶世界, 2019(9): 10-19.
[3] 李春牛, 李先民, 黄展文, 等. 60Co-γ射线对茉莉花插穗的辐照效应研究[J]. 河南农业科学, 2020, 49(1): 118-122.
[4] Datta M. Cytogenetical studies on some ornamental jas-mines[J]. Caryologia, 2014, 13(3): 713-748.
[5] Thompson J D, Dommee B. Morph-specific patterns of variation in stigma height in natural populations of distylous Jasminum fruticans[J]. New Phytologist, 2008, 148(2): 303-314.
[6] 賴明志, 连长伟, 杨如兴. 茉莉育性的研究[J]. 福建农业大学学报, 1996(4): 57-60.
[7] 张泽岑. 茉莉花不实机理研究[J]. 西南农业大学学报, 1993(6): 105-107.
[8] Nair S S, Devipriya V, Regy Y. Pollen morphological studies in twenty accessions of Jasminum sambac (L.) Ait. from Kerala[J]. International Journal of Advanced Research, 2017, 5(9): 1726-1733.
[9] 邓衍明, 叶晓青, 梁丽建, 等. 茉莉花粉离体培养萌发及花粉管生长特性研究[J]. 华北农学报, 2014, 29(5): 107-113.
[10] 阮玉娟. 秋水仙素诱导茉莉多倍体的研究[D]. 重庆: 西南大学, 2014.
[11] 王湘平, 赖明志, 苏金为. 茉莉染色体核型研究[J]. 福建农学院学报, 1992(1): 63-66.
[12] George K, Geethamma S. Cytology and Evolution of Jas-mines[J]. Cytologia, 1992, 57(1): 27-32.
[13] 吴改娥, 刘 平, 刘孟军, 等. 二倍体和同源四倍体‘辣椒枣减数分裂的比较[J]. 园艺学报, 2011, 38(5): 867-874.
[14] 张 迪, 朱根发, 叶庆生, 等. 50份蝴蝶兰种质的染色体数目与倍性分析[J]. 热带作物学报, 2013, 34(10): 1871-1876.
[15] 梁武军, 解凯东, 郭大勇, 等. 柑橘10个品种实生后代多倍体的发掘及SSR鉴定[J]. 园艺学报, 2014, 41(3): 409-416.
[16] 金 亮, 徐伟韦, 李小白, 等. DNA流式细胞术在植物遗传及育种中的应用[J]. 中国细胞生物学学报, 2016, 38(2): 225-234.
[17] 田新民, 周香艳, 弓 娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.
[18] Lai H G, Chen X, Chen Z, et al. Induction of female 2n gametes and creation of tetraploids through sexual hybridization in cassava (Manihot esculenta)[J]. Euphytica, 2015, 201(2): 265-273.
[19] Bagheri M, Mansouri H. Effect of induced polyploidy on some biochemical parameters in Cannabis sativa L.[J]. Ap-plied Biochemistry and Biotechnology, 2015, 175(5): 2366-2375.
[20] 林 瀚, 韩晓文, 兰思仁, 等. 基于流式细胞技术两种兰属植物基因组大小的测定[J]. 森林与环境学报, 2019, 39(6): 616-620.
[21] 田韦韦, 王彩霞, 田 敏, 等. 文心兰体细胞无性系变异的倍性检测和CE-AFLP分析[J]. 核农学报, 2017, 31(2): 241-247.
[22] 吕 顺, 任 毅, 王 芳, 等. 利用流式细胞术快速鉴定169份香蕉种质资源的染色体倍性[J]. 果树学报, 2018, 35(6): 668-684.
[23] 李雯雯, 刘立强, 帕米尔·艾尼, 等. 利用流式细胞术鉴定新疆野杏染色体倍性和DNA含量[J]. 农业生物技术学报, 2019, 27(3): 542-550.
[24] 杨 静, 宋勤霞, 宁军权, 等. 利用流式细胞术鉴定桑树染色体倍性的方法[J]. 蚕业科学, 2017, 43(1): 8-17.
[25] 汪 艳, 肖 媛, 刘 伟, 等. 流式细胞仪检测高等植物细胞核DNA含量的方法[J]. 植物科學学报, 2015, 33(1): 126-131.
[26] Jones W E, Kuehnle A R, Arumuganathan K. Nuclear DNA content of 26 orchid (Orchidaceae) genera with emphasis on Dendrobium[J]. Annals of Botany, 1998, 82(2): 189-194.
[27] 杨慧娴, 饶培瑜, 胡晶晶, 等.应用流式细胞术测定绢毛苣属4种8居群基因组大小[J]. 植物科学学报, 2019, 37(6): 775-780.
[28] 杨转英, 吴传龙, 丰 锋, 等. 不同株系菠萝蜜染色体倍性及基因组大小分析[J]. 果树学报, 2015, 32(4): 567-571.
[29] Kang M, Tao J, Wang J, et al. Adaptive and nonadaptive genome size evolution in Karst endemic flora of China[J]. New Phytologist, 2014, 202(4): 1371-1381.
[30] 邱长玉, 高国庆, 丁锦平, 等. 茉莉花基因组DNA的提取[J]. 江西农业学报, 2007(4): 40-41.
[31] Ghasemi G M, Salehi H, Khosh-Khui M, et al. Application of ISSR markers to analyze molecular relationships in Ira-nian jasmine (Jasminum spp.) accessions[J]. Molecular Biotechnology, 2015, 57(1): 65-74.
[32] 陈梅春, 朱育菁, 刘晓港, 等. 茉莉鲜花[Jasminum sambac (L.) Aiton]香气成分研究[J]. 热带作物学报, 2017, 38(4): 747-751.
[33] 孙 君, 陈桂信, 叶乃兴, 等. 茉莉花香气相关基因JsDXS及其启动子的克隆与表达分析[J]. 园艺学报, 2014, 41(6): 1236-1244.
[34] Suda J, Kyncl T, Jarolimova V. Genome size variation in Macaronesian angiosperms: forty percent of the Canarian endemic flora completed[J]. Plant Systematics and Evolution, 2005, 252(3-4): 215-238.
[35] 韦昌联, 陈伯伦, 黄诚梅, 等. 茉莉种子发芽率及实生苗大田生长试验研究[J]. 广东农业科学, 2008, 35(10): 33-36.
[36] 陈金水. 园林植物遗传育种学[M]. 北京: 中国林业出版社, 2000.
[37] 王利虎, 吕 晔, 罗 智, 等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报, 2018, 26(3): 511-520.
[38] Riddle N C, Kato A, Birchler J A. Genetic variation for the response to ploidy change in Zea mays L.[J]. Theoretical and Applied Genetics, 2006, 114(1): 101-111.
责任编辑:黄东杰

