核纤层蛋白Lamin A/C负性调控ASCs增殖促进应力诱导脂肪再生的实验研究
任婧,万玲玲,2,鲁峰,陈曦航
1.南方医科大学南方医院整形美容外科,广州 510515;2.宜春学院化学与生物工程学院,江西 宜春 336000
如何重建因创伤、肿瘤切除、先天性缺陷等导致的软组织缺损是整形外科领域所面临的巨大挑战[1]。传统的组织工程技术以外源性种子细胞、支架材料和微环境为基础所构建出的脂肪组织,由于存在外源性感染风险、体积小及长期转归不理想等因素,仍然达不到临床所需大体积脂肪组织的构建标准,这极大限制了其应用范围。
“组织工程室技术”利用在体脂肪组织本身丰富的脂肪来源间充质干细胞(adipose-derived stromal cells,ASCs)、细胞外基质支架及微环境所构建的工程室化脂肪组织,为大体软组织缺损修复提供了新的解决方案[2,3]。课题组前期通过微创手术游离小体积带蒂脂肪瓣,结合外负压吸引装置(external volume expansion,EVE),成功地构建了预扩张工程化脂肪瓣(expanded prefabricated adipose tissue,EPAT),实现了全内源性大体积脂肪再生[4]。这在大体积工程化脂肪组织的构建中展现出了良好的应用前景。然而应力参与构建工程化脂肪组织的分子机制尚不明确。
ASCs作为参与脂肪再生的关键种子细胞,可以直接分化为脂肪细胞,并在宏观上体现为脂肪组织体积的增大[5],探索其增殖机制是明确应力诱导脂肪再生的关键环节。我们前期发现力学刺激作用于细胞外基质(extracellular matrix,ECM),而ASCs可通过其细胞膜表面特异性力学感受器Integrinβ1感应并转导力学信号并传导至细胞质骨架(fibrous actin,Factin),继而产生增殖效应[4]。然而这仅是我们对ASCs内力学转导信号的初步探索,其下游机制值得进一步深入研究。
近年来,细胞核不仅作为细胞内硬度最高和基因转录发生的亚细胞结构,而且作为新型力学感受器,成为细胞生物力学领域的研究热点之一[6]。其中,位于细胞核内膜与染色质之间的核纤层蛋白(Lamins),是胞核骨架的重要组成部分[6]。Lamins通过LINC复合体(linker of nucleoskeleton and cytoskeleton complex)与细胞质骨架直接结合,同时可直接与染色质上DNA片段结合,这为细胞内力学信号的传导提供了良好路径[7]。Lamins分为A型和B型,A型主要包括异构体Lamin A和Lamin C,B型主要包括Lamin B1和Lamin B2[8]。研究表明,Lamins在细胞力学信号传导中发挥着重要作用,其异常表达或突变可减弱细胞对机械刺激的敏感性及反应性[9]。因此,本课题将探索核纤层蛋白Lamins对ASCs机械敏感性及增殖的调控作用,探讨外负压吸引促进脂肪瓣再生的分子机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 8~10周清洁级SD雄性大鼠42只,平均体重为(370±20)g,购买后饲养于南方医科学大学实验中心。每日常规饮食。
1.1.2 主要试剂及仪器 多聚甲醛、I型胶原酶等购自Sigma公司;Lamin A/C、Lamin B1、Lamin B2抗体购自美国abcam 公司;Western blot试剂盒购自德国Rebstock公司;Integrinβ1敲低慢病毒的制备、Lamin A/C过表达慢病毒的制备这部分实验委托中国上海吉凯基因化学技术有限公司完成;大鼠ASCs专用培养基购买自中国赛业生物科技有限公司;Flexcell细胞培养板购买自美国Flexcellint国际公司。
1.2 实验方法
1.2.1 EPAT构建 将3%戊巴比妥按30 mg/kg注射入大鼠腹腔,静待其深入麻醉后,将大鼠腹部剃毛并固定于小动物固定台。术前于大鼠下腹部用医用碘伏及酒精消毒3遍,随后铺单并暴露手术区域。
行腹股沟转瓣手术:用11号尖刀于一侧腹股沟区域做长约1.5 cm,平行于髂前上棘的斜行切口。沿腹股沟脂肪瓣分离脂肪组织,暴露轴型血管并给予仔细保护,随后于腹股沟背处结扎血管远端并离断脂肪瓣,修剪脂肪瓣使其大小约2.5 cm×1 cm。于大鼠下腹部分离皮下隧道,随后将带蒂脂肪瓣转移至下腹部中线处,并用5-0可吸收线将脂肪瓣远端固定于腹部筋膜上。生理盐水冲洗检查有无出血点,用6-0尼龙线间断缝合皮肤,术毕。此步骤是为了将大鼠的腹股沟脂肪瓣转移至腹部中线处,方便随后的负压外扩张器的使用。
放置组织外扩张负压装置(EVE):术后1星期可见大鼠腹股沟伤口愈合良好,便开始给予负压吸引。将大鼠固定于体外定制的小动物固定器内,标记脂肪瓣在皮肤表面的投影,随后将负压吸引装置固定于大鼠腹部,调节参数,负压罩直径为2 cm,负压值为-2 kPa,每次持续负压吸引6~8 h。对照组同样固定于体外定制的小动物固定器内6~8 h,不给于负压吸引处理(图1)。

图1 预扩张脂肪组织(EPAT)大鼠动物模型示意图Fig.1 The animal model of expanded prefabricated adipose tissue(EPAT)
1.2.2 SD大鼠ASCs培养与分组 在超净台内用将SD大鼠腹股沟脂肪瓣剪碎,用0.2%的I型胶原酶恒温摇床中37℃消化60 min,终止消化,1000 r/min离心5 min取细胞沉淀,用生长培养基重悬后接种于培养皿中培养,48 h后第1次换液,以后隔2d换1次液体,细胞生长融合达90%时按1:2比例传代。
通过慢病毒构建Integrinβ1 ASCs表达抑制模型;运用3D打印技术构建体外静态细胞拉伸装置,同时给予对照组组和Lamin A/C过表达组12%、6%、0%的静态形变作用,通过细胞免疫荧光、Western Blot检测Lamin A/C表达情况。
通过慢病毒构建Lamin A/CASCs过表达模型;运用3D打印技术构建体外静态细胞拉伸装置,同时给予对照组组和Lamin A/C过表达组12%、6%、0%的静态形变作用,通过细胞免疫荧光、Western Blot检测ASCs增殖情况。
1.2.3 细胞加力装置及细胞加力 我们使用3D打印定制的静态细胞拉伸装置(Flexcell Device)[4]对细胞进行拉伸作用。Flexcell Device由聚四氟乙烯材料构建的底座,和带有弹性膜的Flexcell Bioflex平板(标准6孔板)构成的上板组成。通过设置底座上聚四氟乙烯圆柱的高度即可调节施加在弹性膜上的形变水平。我们采用了12%、6%和0%的形变参数,分别由高14.36 mm、12.07 mm和6.8 mm的圆柱产生。当底板与Bioflex弹性六孔板叠加合并时,圆柱将作用于Bioflex弹性六孔板的弹性膜,并将弹性膜向上部顶起,制造出膜中心与膜外周的高度差,继而使弹性膜产生稳定的形变,与此同时种植于弹性膜表面的细胞也将通过粘附作用产生相应的形变(图2)。
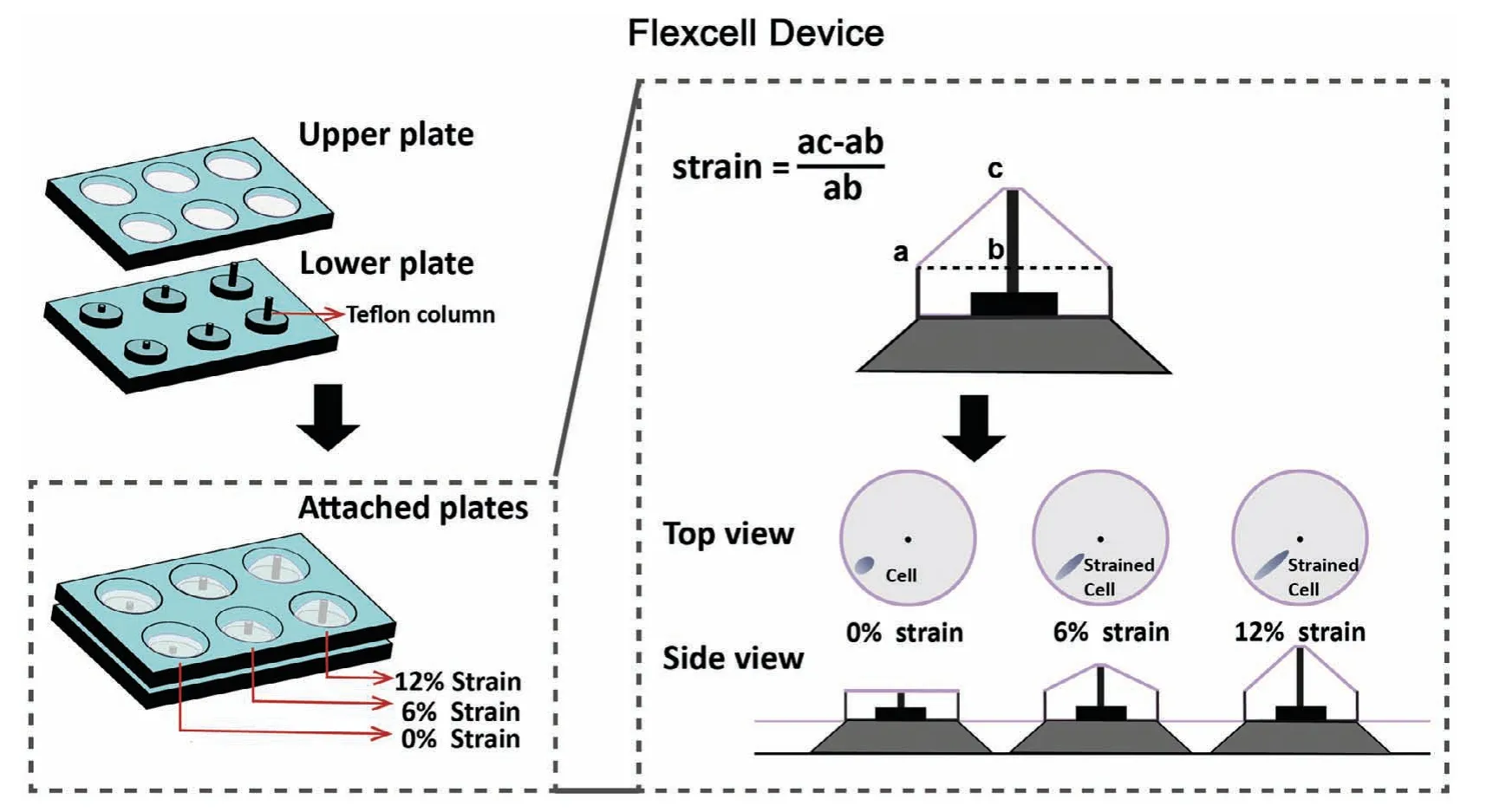
图2 静态拉伸系统装置示意图Fig.2 Illustration of Flexcell devicein vitro
1.2.4 免疫印迹检测 提取组织/细胞裂解物。Bradford法测定蛋白浓度。将蛋白样品与Loading buffer混合,100℃水浴中加热5 min,离心后取上清,配制12%分离胶、5%浓缩胶,SDS-PAGE电泳,随后将蛋白转至PVDF膜,用含5%脱脂奶粉封闭液室温封闭1 h,加一抗:Lamin A/C、Lamin B1、Lamin B2和内参GAPDH,4℃孵育过夜,TBS洗膜后分别加二抗,37℃孵育1 h,洗膜后进行ECL化学发光、曝光、显影,以Lamin A/C、Lamin B1、Lamin B2与GAPDH灰度值之比作为蛋白的相对表达量。
1.2.5 组织染色切片 4%多聚甲醛固定脂肪瓣;行脱水、石蜡包 埋等处理;行组织石蜡切片Lamin A/C免疫化学染色,并在光学显微镜下拍照,最后通过图像分析评估Lamin A/C表达情况。
1.2.6 细胞免疫荧光检测 4%多聚甲醛固定细胞15 min;洗涤后0.3%TritonX-100通透10 min,洗涤后山羊血清封闭液封闭60 min;加入一抗4孵育过夜。次日洗涤后加入荧光染料标记的二抗避光孵育90 min;洗涤后DAPI核染色剂避光孵育10 min,洗涤后加入防荧光淬灭剂。荧光显微镜下观察拍照。
1.3 统计分析
数据呈现平均值与正负误差值,使用Graph Pad Prism Software version 6.0软件对数据进行统计分析。每次测试3次独立的实验结果进行统计。统计分析方法使用独立样本t检验,单因素方差分析或双因素方差分析进行检测,P<0.05具有统计学意义。
2 结果
2.1 EVE作用早期EPAT内ASCs增殖显著增多
EVE作用下,可见Ki67阳性的细胞(图3)散在分布于脂肪组织的间质中,并且脂肪瓣中细胞Ki67阳性的细胞的数目于第1周明显增多,后随时间逐渐减少,但在对照组中,于脂肪间质中只发现了零星散在的Ki67阳性的细胞,并于各时间点未见明显数量级变化。统计结果(图3)提示,在不同时间点,实验组Ki67阳性的细胞的数目明显高于对照组(P<0.05)。并且在实验组中Ki67阳性的细胞的数目在第1周达到峰值,但从第4周第8周逐渐下降(P<0.01)。反之对照组中细胞Ki67阳性的细胞的数目随时间没有显着变化,未有统计学差异。

图3 脂肪瓣中细胞增殖情况检测Ki67的免疫组化染色图及Ki67阳性细胞数的统计分析图(#和##代表不同时间点实验组与对照组比较,P<0.05,P<0.01;**表示不同时间点实验组组间比较,P<0.01);标尺=100 mm)Fig.3 The changes of cell proliferation during adipose tissue regeneration at different time pointsImmunohistochemical staining of Ki67 and quantification analysis of Ki67-positive cells in both groups at indicated times(#,##indicated P<0.05 and P<0.01 experimental group compared with control group at different times,respectively;**indicated P<0.01,comparison of experimental group at different times;Scalebars=100 mm)
2.2 EVE作用早期EPAT内Lamin A/C的表达量显著下降
我们首先检测了Lamin B1、Lamin B2、Lamin A/C的表达情况,结果显示(图4 A),与未施力组相比,EVE作用早期EPAT内Lamin A/C的表达量显著下降(P<0.05),Lamin B1、Lamin B2的表达则无明显差异。进一步通过免疫化学检测脂肪瓣切片中Lamin A/C的表达,结果可见(图4 B),未施力组脂肪瓣内可见散在分布于脂肪组织的间质中的Lamin A/C阳性细胞,但EVE作用下脂肪瓣内Lamin A/C阳性细胞数量下显著下降(P<0.01)。
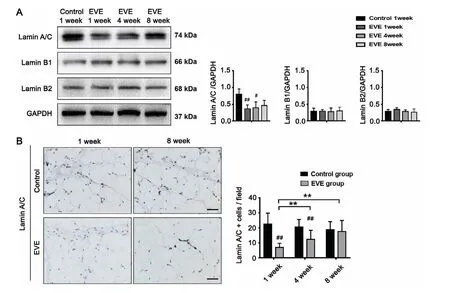
图4 脂肪瓣内差异表达的Lamins的筛选A:EVE组与对照组脂肪瓣内差异性Lamins的筛选 B:EVE组脂肪瓣内Lamin A/C的免疫组化染色图及Lamin A/C阳性细胞数的统计分析图(#和##代表不同时间点实验组与对照组比较,P<0.05,P<0.01;**表示不同时间点实验组组间比较,P<0.01;标尺=100 mm)Fig.4 The changes of Lamins expression during adipose tissue regeneration at different time pointsA:The changes of Lamins expression in both groups at indicated times;B:Immunohistochemical staining of Lamin A/C and quantification analysis of Lamin A/C-positive cells in both groups at indicated times(#,##indicated P<0.05 and P<0.01 experimental group compared with control group at different times,respectively;**indicated P<0.01,comparison of experimental group at different times;Scalebars=100 mm)
2.3 静态应力通过激活Integrinβ1-Lamin A/C信号通路
通过“静态拉伸系统装置”将12%、6%、0%的形变分别作用于对照组和Integrinβ1敲低组ASCs,8 h后,通过免疫印迹检测Lamin A/C在对照组和Integrinβ 1敲低组中ASCs内的表达程度。结果显示(图5),在不同细胞形变程度的刺激下,Integrinβ1敲低组ASCs细胞内Lamin A/C的表达量均高于对照组(P<0.05)。

图5 Lamin A/C作为整联蛋白β1下游蛋白负响应应力刺激对照组和整联蛋白β1慢病毒敲低组,Lamin A/C的免疫印迹图及免疫印迹灰度值统计分析图(#和##表示不同时间点对照组与整联蛋白β1慢病毒敲低组比较,P<0.05,P<0.01;*和**分别表示不同时间点的组间比较P<0.05,P<0.01)Fig.5 Inhibition of the Integrin β1 expression o in ASCs reversed the down-regulation of Lamin A/C expression by mechanical stressWestern blot analysis and quantification of Lamin A/C expression in ASCs in wild group and Sh-RNA integrinβ1 group(#,##indicated P<0.05 and P<0.01 control group compared with ShRNA-integrin β1 group,respectively;*,**indicated P<0.05 and P<0.01,comparison of control group at different times,respectively)
2.4 过表达Lamin A/C可逆转静态应力对ASCs的促增殖作用
通过“静态拉伸系统装置”将12%、6%、0%的形变分别作用于对照组和Lamin A/C过表达组ASCs,8 h后,通过细胞免疫检荧光检测Ki67在对照组和Lamin A/C过表达组中ASCs内的表达程度。结果显示,在不同细胞形变程度的刺激下,Lamin A/C过表达组Ki67阳性ASCs细胞数低于对照组(P<0.05,图6)。
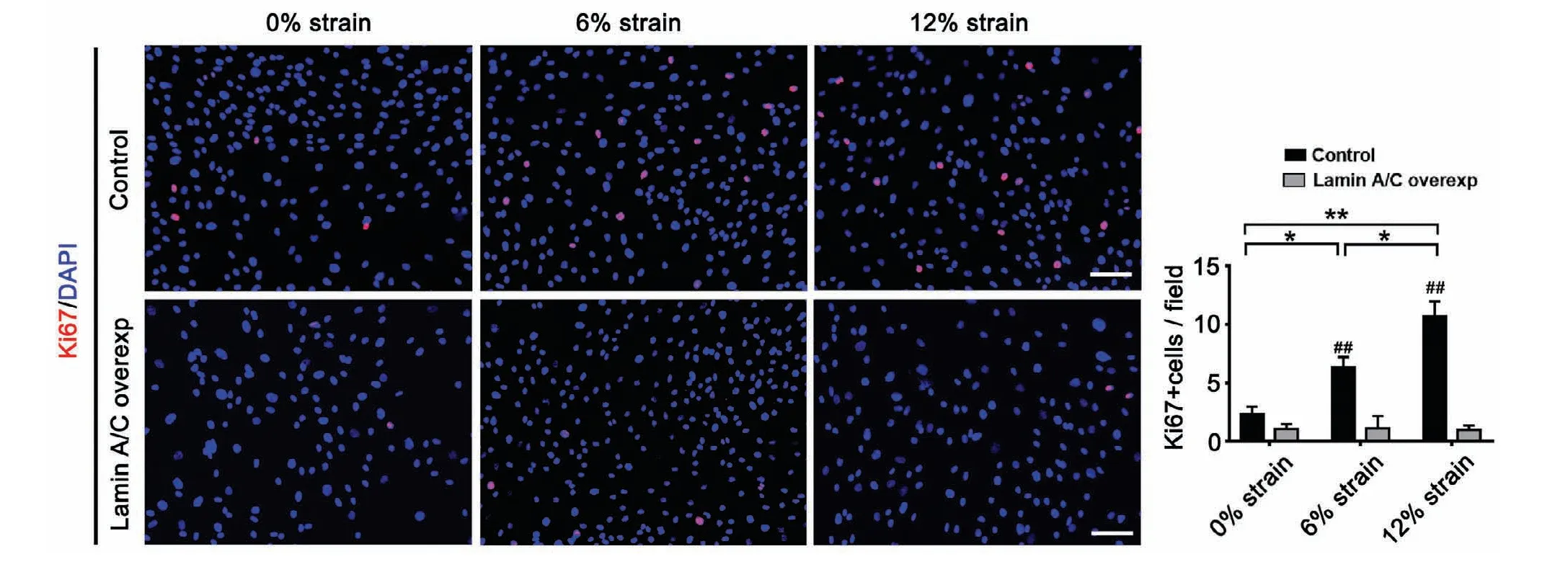
图6 Lamin A/C负性响应应力刺激调控ASCs增殖对照组和Lamin A/C慢病毒过表达组Ki67的免疫荧光染色图及Ki67阳性细胞数的统计分析图(#和##表示不同时间点对照组与Lamin A/C慢病毒过表达组比较,P<0.05,P<0.01;*和**分别表示不同时间点的组间比较P<0.05,P<0.01;标尺=100 mm)Fig.6 Over-expression of the Lamin A/Creversed the proliferation of ASCs by mechanical stress.Immunofluorescence staining of Ki67 and quantification analysis of the number of Ki67 positive cells in control group and Lamin A/C lentivirus over expression group(#,##indicated P<0.05 and P<0.01,control group compared with Lamin A/Cover-expression group,respectively;*,**indicated P<0.05 and P<0.01,comparison of the control group at different times,respectively;Scalebars=100 mm)
3 讨论
脂肪组织工程室技术是修复大体软组织缺损的新方案,其中力学诱导ASCs增殖是关键环节。本实验证实,新型力学感受器核纤层蛋白Lamin A/C作为Integrinβ1下游分子,可响应力学刺激,并通过减低表达量负性调控ASCs增殖,继而参与力学诱导的工程室化组织再生。
近年来,细胞核不仅作为细胞内硬度最高和基因转录发生的亚细胞结构,而且作为新型力学感受器/反应器,成为细胞生物力学领域的研究热点之一。Lamin A/C不仅可以起到维持核内稳态和保护染色质的作用,同时也可以作为机械刺激细胞核内的反应器,将力学信号传导至核内,可直接或间接参与基因的转录调控[10]。我们首次发现,脂肪组织内ASCs内Lamin A/C可负性响应力学刺激,并介导细胞增殖反应。与此类似的是,Qi等[11]探讨了细胞核骨架蛋白Lamin A/C在高血压高张应变诱导血管平滑肌细胞增殖中的作用及其机制,发现了Lamin A/C作为重要的保护性因子,其表达降低参与了高血压高张应变诱导的血管平滑肌细胞异常,并提示有Lamin A/C可能作为高血压血管重建的潜在靶标分子,具有重要的临床转化价值。
Lamin A/C作为Integrinβ1下游关键分子,负性调控ASCs增殖功能。至此我们证实细胞内力学传导信号已基于细胞骨架系统从胞外传导至胞核。Lamins通LINC复合体(linker of nucleoskeleton and cytoskeleton complex)与细胞质骨架直接结合,同时可直接与染色质上DNA片段结合,这为细胞内力学信号的传导提供了良好路径[8]。与此同时,染色质作为化学信号中基因转录发生的核心部位,力学刺激能激活转录因子(transcription factor,TF)促进基因转录[9]。重要的是,Lamin A/C可与基因启动子区域内的DNA序列或片段结合,可通过与DNA片段可逆性结合,调控TF转录[12]。因此Lanin A/C作为细胞核内力学感受器,起到了将力学信号化学化的关键作用。
本实验首次证实了Lamin A/C作为Integrin轴下游关键分子,通过负性调控ASCs增殖参与力学诱导的工程室化组织再生过程。本实验深入探讨了工程室化组织再生过程中种子细胞ASCs扩增的分子机制,为脂肪组织工程室的临床应用提供了参考依据。