茉莉花JsMYB108和JsMYB305基因的克隆及其对TPS基因的激活作用
张月 袁媛 何弦 王宇婷 吕美玲 伍炳华 陈清西
摘 要:基于茉莉花叶转录组(GenBank登录号为GHOY00000000)筛选了2个在花瓣中及夜间优势表达,且与其他物种中香气调控转录因子同源度高的MYB基因进行克隆并分析了它们在花朵开放中的表达模式。2个MYB基因编码序列长度分别为864 bp和588 bp,编码287 aa和195 aa个氨基酸残基。分别与拟南芥AtMYB108及AtMYB24亲缘关系相近,与油橄欖(Olea europaea var. sylvestris)MYB108-like protein和MYB305-like protein相似度最高,分别命名为JsMYB108和JsMYB305。JsMYB108和JsMYB305在夜间表达量显著高于白天,与4个茉莉花萜类合成酶基因JsTPS表达特征一致。为探究JsMYB108和JsMYB305是否参与萜类香气调控,将其构建至植物表达载体pK7FWG2.0(35 S启动子,GFP报告基因)中,利用茉莉花茎段愈伤组织遗传转化体系检测其对愈伤组织中4个JsTPS基因表达水平的影响。结果显示:转化了JsMYB108和JsMYB305的愈伤组织内能检测到GFP荧光和2个MYB基因转录本;JsMYB108可显著提高JsTPS2表达水平,JsMYB305可显著提高4个JsTPS基因的表达,暗示JsMYB108和JsMYB305可能不同程度地参与了萜类合成的调控。该研究结果为今后茉莉花香气调控的深入研究提供参考。
关键词:茉莉花;MYB转录因子;TPS基因;愈伤组织;遗传转化
中图分类号:S685.16 文献标识码:A
Cloning of JsMYB108 and JsMYB305 and Analysis of Their Activation on TPS Gene in Jasminum sambac
ZHANG Yue, YUAN Yuan*, HE Xian, WANG Yuting, LYU Meiling, WU Binghua, CHEN Qingxi
College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: Two MYB genes which were of high homology with fragrance regulating transcription factors in other species and predominant expressed in flower at night and were screened and cloned from the jasmine flower & leaf transcriptomes (Genebank GHOY00000000), and the expression pattern during flower opening were detected. Results showed that the coding sequence was 864 bp and 588 bp in length, respectively, and encoded 287 and 195 amino acid residues respectively. They were of homology to Arabidopsis thaliana AtMYB108 and AtMYB24, and had the highest similarity to MYB108-like protein and MYB305-like protein in Olea Europaea var. sylvestris, and was named JsMYB108 and JsMYB305, respectively. The expression level of JsMYB108 and JsMYB305 was significantly higher at night than at day, which was consistent with the four JsTPSs expression characteristics. To investigate whether JsMYB108 and JsMYB305 were involved in the regulation of terpene synthesis, they were constructed into the plant expression vector pK7FWG2.0 (35 S promoter with GFP reporter) and transformed to jasmine callus to detect the effect on the expressions of four JsTPS genes. The results showed that GFP fluorescence and transcripts of JsMYB108 and JsMYB305 could be detected in the transformed callus. Furthermore, JsMYB108 could significantly enhance the expression of JsTPS2, while JsMYB305 could significantly increase the expression level of four JsTPS genes, suggesting that JsMYB108 and JsMYB305 might be involved in the regulation of terpene synthesis. The results of the study would lay a foundation for further studies on the regulation of jasmine fragrance.
Keywords: Jasminum sambac; MYB transcript factor; TPS gene; callus; genetic transformation
DOI: 10.3969/j.issn.1000-2561.2021.06.005
茉莉花[Jasminum sambac (L.) Aiton]为木犀科(Oleaceae)素馨属(Jasminum)常绿灌木,广泛应用于茉莉花茶窨制、香料香精、化妆品、药品、食品和园林应用等方面,是著名的芳香植物和香料作物[1]。我国茉莉鲜花基本上用于花茶生产,优质茉莉花茶每千克原料需配1.28 kg茉莉花[2],且不同级别的茉莉花茶对其香气要求特别严格[3]。对于茉莉花茶窨茶工艺的探索以及花茶品质的研究均表明茉莉花的香气在花茶的经济和文化中起着重要作用[4-6]。
茉莉花挥发性香气主要为单萜、倍半萜、苯环类/苯丙烷类,以及其他微量物质如挥发性脂肪衍生物,其中芳樟醇、α-法呢烯和乙酸苄酯在J. sambac及3个近缘种茉莉的挥发性香气中占了80%以上[7]。作为一种夜花植物(nocturnal flowering plant),茉莉香气在子夜前达到高峰[7],对萜类合成途径以及乙酸苄酯合成途径一些酶在花瓣中的活性测定及其中一些酶编码基因的表达分析也证实了这一点[8],因此茉莉香气释放过程是受到严格调控的,但相應的调控因子类别及其调控机理尚不清楚。
对于挥发性物质萜类、苯环类/苯丙类和脂肪酸类等有关的转录因子调控机理还十分有限[9]。目前,相较另外2类挥发性物质,苯环类/苯丙类调控的MYB调控研究较为深入,如矮牵牛(Petunia hybrida)PhODO1、PhEOBI、PhEOBII、PhMYB4等[10-14]、草莓(Fragaria × ananassa)FaEOBII[15]、百合(Lilium spp.)LhODO1[16]、拟南芥AtMYB3、AtMYBL2和AtMYB6[17]等。相比之下,萜类合成途径中报道的转录因子很少,目前仅在姜花(Hedychium coronarium)[18]、紫丁香(Syringa oblata)[19]和金龙胆(Conyza blini H. lev)[20]中有初步探索,分子层面的系统研究尚未开展。
关于香气调控相关转录因子的研究在茉莉中尚无报道。我们曾对双瓣茉莉开放48 h过程中香气释放和花、叶转录组(GeneBank登录号为GHOY00000000)进行了关联分析[21],初步筛选出在花朵中优势表达,在时间上与香气释放高峰阶段同期上调,且与矮牵牛[10-11]和草莓[15]中调控香气的转录因子同源性高的2个MYB序列(编号C58515、C50112),推测其参与香气的调控。此外,我们从转录组中挖掘了4个萜稀合成酶(terpene synthase,TPS),与草莓芳樟醇合成酶FaNES1[22]、云杉(Picea abies)芳樟醇合成酶[23]、油橄榄(Olea europaea)倍半萜合成酶(AF I47927.1)同源性高,且在花朵和夜间优势表达,编号为c60643_g1、c58633_g1、c60545_g4、c58382_g2,分别命名为JsTPS1、JsTPS2、JsTPS3、JsTPS4。为探究这2个MYB转录因子是否参与了萜类香气物质的调控,本研究将它们的编码序列进行克隆并构建入植物表达载体,并利用茉莉茎段遗传转化体系检测其对茉莉愈伤中4个JsTPS基因表达的调控。
1 材料与方法
1.1 材料
1.1.1 植物材料 以双瓣茉莉盆栽3年生植株为供试材料。扩增MYB基因编码序列时,于花蕾开放次日凌晨1点采集花朵的花瓣,检测基因在不同时间点的表达水平时,采集花蕾开放当夜21:00、次日凌晨01:00、次日白天中午11:00和下午15:00花朵,用锡箔纸包好后立即置于液氮中,保存于–80 ℃超低温冰箱用于提RNA。用于诱导茉莉愈伤组织时,采集幼嫩枝条中上部不带腋芽的茎段用于后期消毒和组织培养。
使用长至4~6片叶片的本氏烟草(Nicotiana benthamiana)进行表达载体瞬时转化后的GFP检测。本氏烟草种植于人工气候室,光周期为16 h/8 h(昼/夜),温度为26 ℃/22 ℃(昼/夜)。
1.1.2 载体和菌株 Gateway系统载体pK7FWG2.0(35 S启动子,GFP报告基因)以及农杆菌(Agrobacterium tunmefaciens)GV3101株系为福建农林大学园艺学院实验室保存。感受态大肠杆菌(E. coli)DH5α购自北京全式金生物技术有限公司。
1.2 方法
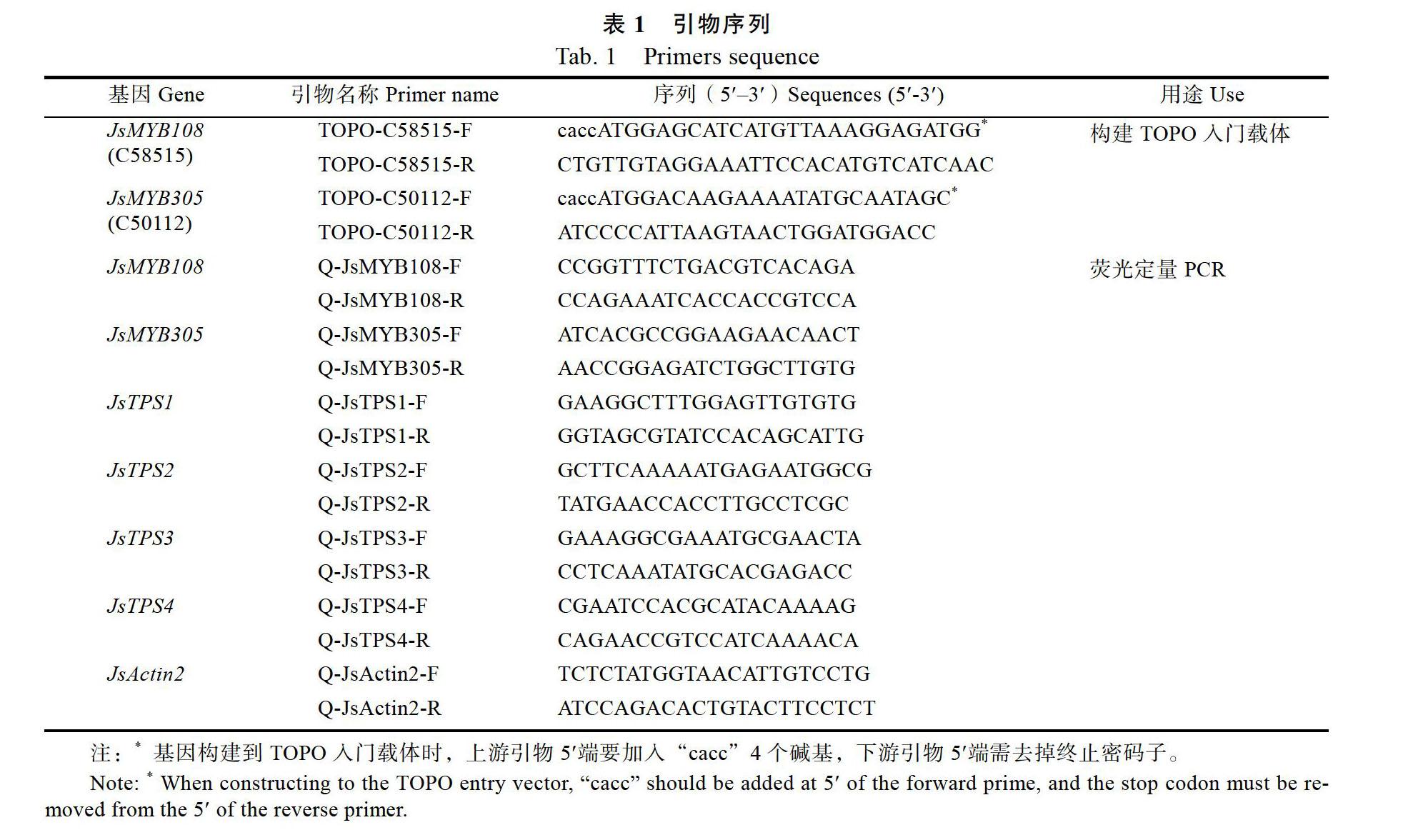
1.2.1 茉莉花2个MYB基因的克隆 茉莉花瓣总RNA提取按照TransZol Up Plus RNA Kit 试剂盒(北京全式金生物技术有限公司)说明书进行。第一链cDNA按照EasyScript? One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(北京全式金生物技术有限公司)进行。根据转录组中c58515和c50112序列(已包含完整的编码序列),设计扩增MYB基因特异性引物(表1),以cDNA为模板,扩增编码序列,PCR的扩增体系:1 μL上游引物,1 μL下游引物,12.5 μL Fastpfu mix(北京全式金生物技术有限公司),1 μL cDNA,9.5 μL H2O。PCR程序:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。反应结束后取2 μL进行琼脂糖凝胶电泳检测,大小无误后回收PCR产物,与TOPO入门载体(pENTR/SD/D-TOPO,Invitrogen)相连,连接体系和条件见说明书。连接完成后转化到大肠杆菌DH5α感受态细胞,挑取白斑摇菌后送测序(铂尚生物技术有限公司)。
1.2.2 MYB序列的分析 将测序之后得到的核酸序列用生物软件网的SMS在线工具(http:// www.bio-soft.net/sms/index.html)中的DNA Figures进行序列翻译,Protein Figures进行多重序列比对;运用NCBI中的BLASTP进行MYB间的同源性比对;使用NCBI中的Conserved Domain Search Service(CD Search)进行结构域分析;用MEGAX软件分析茉莉花P450基因与拟南芥R2R3MYB基因的进化关系,使用Maximum Likelihood方法构建进化树;使用Protparam在线软件对MYB蛋白分子量进行预测。
1.2.3 植物表达载体的构建 利用Gateway技术,将测序无误的TOPO-JsMYBs质粒(AxyPrepTM PCR Clean up Kit提取质粒)与pK7FWG2.0植物表达载体进行LR反应,体系包含150 ng TOPO- JsMYB载体,150 ng pK7FWG2.0,加H2O至8 μL,再加入2 μL LR ClonaseTM II Enzyme mix,轻微涡旋后在25 ℃下反应1 h,加入Proteinase K solution终止反应。将反应产物转化到大肠杆菌DH5α感受态细胞,挑取白斑摇菌后送测序。将测序正确的pK7FWG2.0-JsMYBs(共2个)分别通过冻融法转入农杆菌GV3101株系,PCR检测无误后备用。
1.2.4 烟草瞬时表达 为验证pK7FWG2.0- JsMYBs载体是否构建成功,我们进行了烟草瞬时表达的检测。将验证转化成功的阳性克隆菌液取1 mL放入10 mL LB液体培养基,含50 mg/L庆大霉素(Gen)、50 mg/L 利福平(Rif)、50 mg/L 壮大霉素(Spec),于28 ℃、200 r/min的条件下振荡培养过夜,再取出适量菌液接种于50 mL LB液体培养基中(菌液OD600初始值在0.2左右)继续于28 ℃、200 r/min振荡培养若干小时至OD600值为0.8~1.0。将菌液5000 r/min离心10 min收集菌体,加入重悬液(1/2MS+200 ?mol/L乙酰丁香酮AS+10 mmol/L MES),暗培养3 h之后,轻轻摇匀菌液,用10 mL无菌注射器吸取菌液,去掉针头,用注射口贴住叶背面,轻柔地注入菌液,直到肉眼观察到菌液完全浸染整个烟草叶片,吸干净叶片表面沾染的菌液,将侵染的叶片做好标记,暗培养24~30 h,用激光共聚焦显微镜(Leica TCS SP8)观察判断GFP是否表达,观察GFP时Ex=488 nm,Em=507 nm,观察叶绿素Ex=488 nm,Em=681 nm。
1.2.5 茉莉茎段愈伤组织的获得及转化 从生长健壮的茉莉植株上剪取当年生无病虫害的幼嫩枝条,将幼嫩枝条依次使用洗衣粉水、多菌灵、链霉素、巴氏消毒液进行处理,用无菌水冲洗多次备用[25]。将消毒后幼嫩枝条切成长0.5 cm左右的茎段,接种至预培养基W1(表2)中培养30 d用于浸染。共培养:挑取转化的农杆菌单菌落,接种于10 mL含50 mg/L Rif、50 mg/L Gen和50 mg/L Spec的LB液体培养基中,28 ℃、200 r/min振荡培养过夜,再将过夜培养的菌液3 mL接种于50 mL含相应抗生素的LB液体培养基继续培养3~4 h,至菌液浓度OD600=0.6左右。将菌液在5000 r/min室温离心8 min收集菌体,用W2重悬液重悬OD600=0.6左右可用于浸染。将30 d的外植体放入侵染液中侵染30 min,期间不断轻柔晃动,取出后置于滤纸上吸干水分,然后置于共培养基W3上,25 ℃遮光培养2 d。各培养基配方见表2。
1.2.6 抗性茉莉茎段愈伤组织的筛选 将共培养后的茎段使用含头孢Cef(300 mg/L)的无菌水轻晃清洗3次,每次10 min,再无菌水冲洗4~5遍,滤纸上吸干表面水分,置于含80 mg/L Kan的筛选培养基W4上培养。
1.2.7 茉莉愈伤组织中GFP荧光检测 为验证pK7FWG2.0-JsMYBs是否成功转入茉莉茎段并表达,检测了愈伤组织中的GFP荧光。将经Kan抗性筛选14 d后生长良好的抗性茉莉愈伤组织,使用Leica体式荧光显微镜(Leica M205 FA)观察愈伤组织中报告基因GFP的表达情况。
1.2.8 荧光定量PCR分析 为分析2个JsMYB和4个JsTPS基因在开花不同时间点的表达水平,提取相应花瓣RNA进行检测;为分析转化后愈伤组织中2个JsMYB和JsTPS基因表达水平时,提取抗性愈伤组织RNA。RNA提取同1.2.1,第一链cDNA合成使用试剂盒同1.2.1,体系为42 ℃15 min,85 ℃ 5 s。使用TransStart? Top Green qPCR SuperMix试剂盒(北京全式金生物技术有限公司)进行荧光定量PCR分析,体系为:cDNA模板1.6 μL,上下游引物0.4 μL,Super mix 10 μL,ddH2O 7.6 μL;程序為:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 45 s,40个循环,引物见表1。每个样品做3次生物学重复。基因表达量为相对JsActin2基因[24]的表量,以2–ΔΔCT [25-26]法进行计算。
1.3 数据处理
使用Microsoft Excel 2007软件对荧光定量结果进行数据处理。使用GraphPad Prism 7软件绘图,差异显著性分析使用IBM SPSS Statistics软件中的two-way ANOVA分析和t检测。
2 结果与分析
2.1 茉莉花2个MYB基因的克隆及序列分析
转录组中C58515和C50112序列已包含完整的编码序列,根据编码序列设计特异性引物,以cDNA为模板进行PCR扩增,分别获得864、588 bp的片段(图1),分别编码287、195个氨基酸残基,预测分子量分别为32.68、22.42 kDa。
通过与拟南芥R2R3MYB成员进行进化树分析,发现C58515与拟南芥AtMYB112和AtMYB108亲缘关系较近,C50112与拟南芥AtMYB21和AtMYB305亲缘关系较近(图2),通过NCBI比对,发现C58515和C50112分别与油橄榄(Olea europaea var. sylvestris)中的MYB108-like protein和MYB305-like protein同源性最高,相似度分别为78.36%和88.21%(表3)。基于以上结果,将这2个基因命名为JsMYB108和JsMYB305。
通过多序列比对的结构域分析(图3),发现JsMYB108和JsMYB305氨基酸序列存在明显的R2和R3基序,属于R2R3-MYB类蛋白。在这2个结构域中均含有保守色氨酸残基W。
2.2 茉莉花JsMYB108和JsMYB305在花朵开放过程中的表达特征
在获得JsMYB108和JsMYB305序列并进行生物信息学分析的基础上,测定了这2个基因在昼夜不同时间点(夜间21:00、次日凌晨01:00、次日白天中午11:00和下午15:00)的表达水平,花朵状态见图4。结果显示,JsMYB108在夜间21:00和次日凌晨01:00的相对表达量分别为17.6和13.2,而在白天中午11:00及下午15:00表达量仅1.02和1.01;相似的,JsMYB305在夜间21:00和次日凌晨01:00的表达量分别为22.5和8.6,而在白天中午11:00及下午15:00相对表达量仅1.2和2.7,即JsMYB108和JsMYB305在夜间2个时间点表达量高,在白天2个时间点表达量低,夜间显著高于白天。
JsMYB108 和JsMYB305在开放过程中昼夜不同时间点的表达特征与茉莉花4个萜类合成酶基因JsTPS相同,JsTPS1、JsTPS2、JsTPS3、 JsTPS4均表现为夜间的时间点表达量高,白天的时间点表达量低,昼夜表达量差异可达100倍(图4)。
2.3 表达载体的构建及转化
根据转录组序列设计引物扩增目的片段,将PCR产物分别与TOPO入门载体连接、转化、涂板后进行菌液PCR检测,使用载体上的获得阳性克隆(图5A),测序无误后,将TOPO-JsMYB108和TOPO-JsMYB305与pK7FWG2.0植物表达载体进行LR反应,连接、转化、涂板后进行菌液PCR检测,获得片段长度与预期一致(图5B),经测序验证后正确,提取重组质粒,获得植物表达载体pK7FWG2.0-JsMYB108和pK7FWG2.0-JsMYB305。将重组质粒转化根癌农杆菌GV3101株系,并进行PCR檢测,片段大小无误(图5C),表明重组质粒已成功转化农杆菌GV3101。
2.4 烟草叶片GFP荧光检测
为检测pK7FWG2.0-JsMYB108和pK7FWG 2.0-JsMYB305是否构建成功,将带有pK7FWG 2.0-JsMYB108和pK7FWG2.0-JsMYB305表达载体的农杆菌注射到本氏烟草叶片中,暗培养24~30 h后,用激光共聚焦显微镜观察烟草叶片,均可在细胞中检测到绿色荧光,位置为细胞核(图6),表示pK7FWG2.0-JsMYB108和pK7FWG2.0- JsMYB 305载体构建成功,JsMYB108-GFP、JsMYB305-GFP融合蛋白成功表达。
2.5 茉莉花茎段愈伤组织诱导与抗性筛选
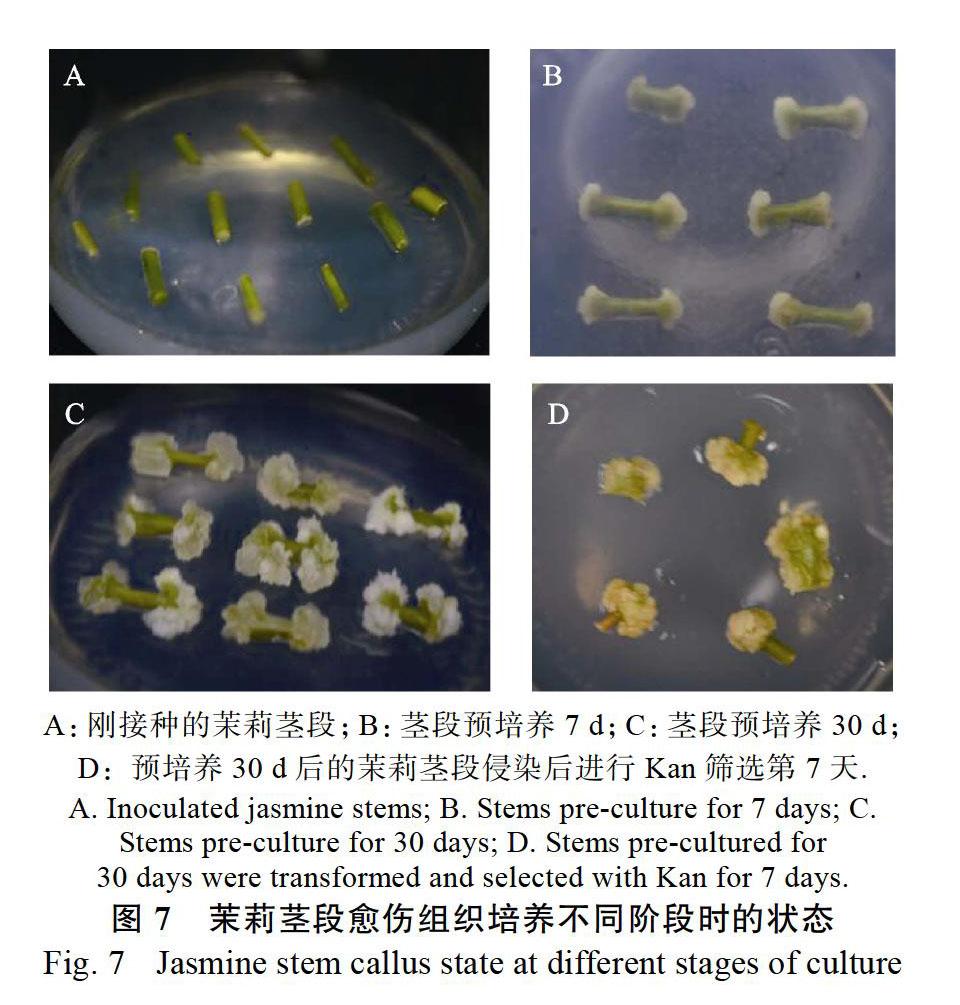
茉莉茎段在预培养期间切口处不断生长和膨大(图7A~图7C),当茉莉茎段预培养7 d后,茎段两端膨大形成白色愈伤组织(图7B),预培养30 d后,茎段切口处愈伤组织已形成较多白绿色小块愈伤组织(图7C)。将预培养30 d的茉莉愈伤茎段分别侵染pK7FWG2.0-JsMYB108和pK7FWG 2.0-JsMYB305载体,然后转入筛选培养基,结果显示愈伤组织生长状态较好,抗性愈伤生成率较高(图7D)。
2.6 茉莉抗性愈伤组织中GFP荧光检测
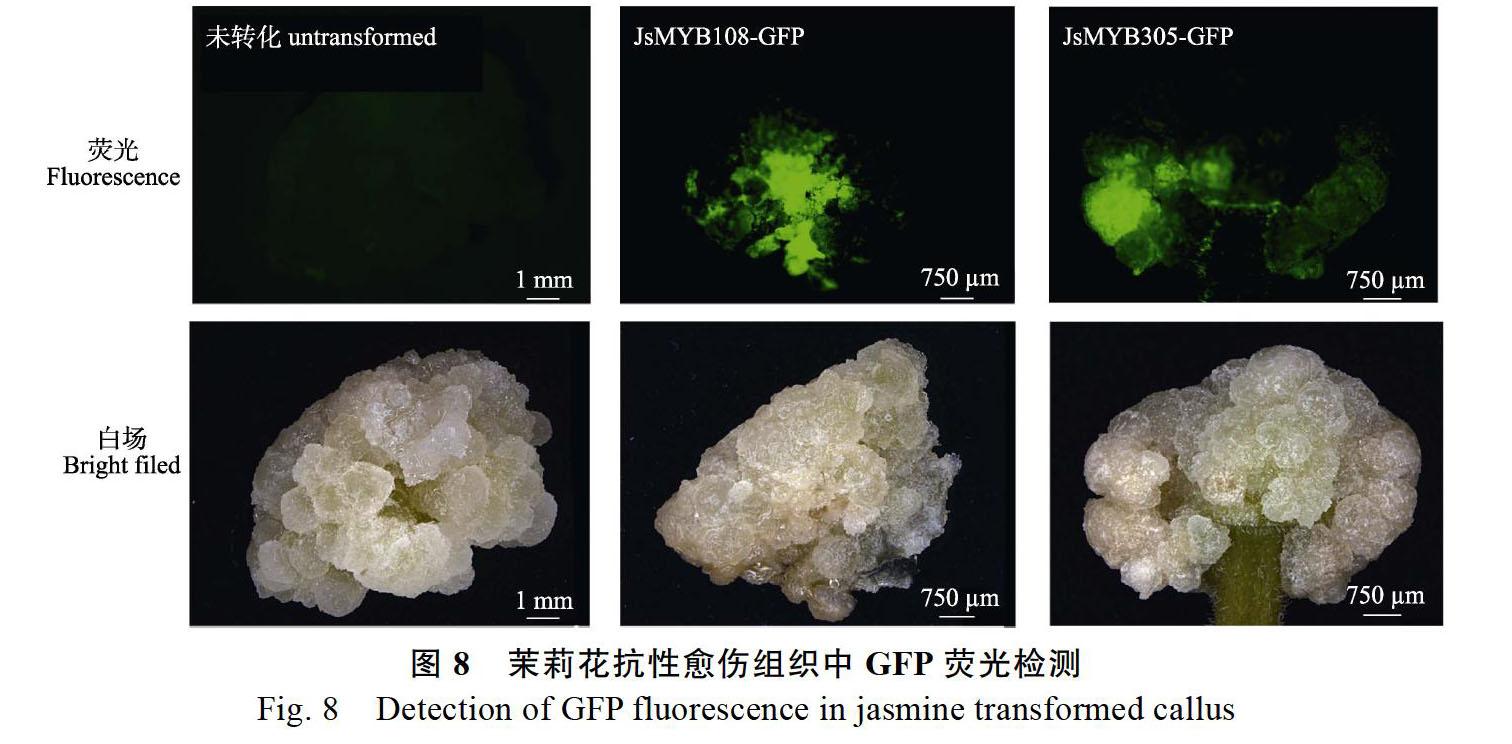
将转化了JsMYB108和JsMYB305的茉莉茎段愈伤筛选培养14 d后进行荧光体式显微镜检测,结果显示转化了JsMYB108和JsMYB305的愈伤组织中均检测到强烈的绿色荧光,而未转化的茉莉愈伤组织中未检测到荧光(图8),说明JsMYB108-GFP、JsMYB305-GFP融合蛋白在愈伤组织中成功表达。
2.7 转化后愈伤组织中JsMYB基因及4个JsTPS基因表达水平检测
当JsMYB108和JsMYB305构建到35S启动子之下并转化茉莉茎段愈伤组织后,转化后愈伤组织中JsMYB108和JsMYB305的转录本为未转化的愈伤组织中表达量的2.12倍和2.28倍(图9A~图9B),有显著提高,说明JsMYB108和JsMYB305基因在愈伤组织中已表达。
JsMYB108转化后的茉莉茎段愈伤组织中JsTPS2表达量显著提高。pK7FWG2.0-JsMYB108使JsTPS2表达量显著提高,为未转化愈伤组织的5.07倍,对另4个JsTPS基因的表达水平无显著影响(图9C)。JsMYB305转化后的愈伤组织中4个JsTPS基因的表达量均显著提高,其中提高量最大的是JsTPS2,为未转化愈伤组织的5.46倍,其次为JsTPS3和JsTPS4,分别为未转化愈伤组织的3.53倍和2.06倍(图9D),JsTPS4表达量为未转化的1.85倍。以上结果说明JsMYB108和JsMYB305不同程度地激活了4个JsTPS基因的表达。
3 讨论
3.1 茉莉花愈伤组织转化体系可用于转录激活检测
茉莉花在自然条件下结实率非常低[27],种子在自然条件下难以萌发,实生苗很难获得[28]。因此通过传统的杂交育种手段改良茉莉香型存在巨大困难。利用基因工程技术对香型进行改造已在月季[29]、草莓[15]、苹果[30]、矮牵牛[31]等多个物种中得以实现,为茉莉的香型改造提供了可能。孙艳妮等[32]、何丽斯[33]和李聪聪[34]、严华兵等[35]对双瓣茉莉的离体快繁体系进行了探索和优化,甘煌灿等人对双瓣茉莉愈伤组织培养及转化进行了一系列研究[28, 36-37],为实验的开展提供了重要参考。本研究预实验中使用了不同的预培养时间,发现采用预培养1个月长出小块愈伤组织的茉莉茎段为转化材料进行转化,前期生长周期短,转化后愈伤组织生长稳定,且方便进行GFP检测,与甘煌灿等[36]发现培养30 d的茉莉茎段愈伤生长迅速且稳定的结论相一致。
甘煌灿等[28]将刺葡萄DFR基因成功转化茉莉愈伤组织,表明外源基因可成功通过愈伤组织转化体系进入茉莉的基因组中。本研究将茉莉JsMYB108和JsMYB305基因转化茉莉茎段愈伤组织,通过烟草GFP荧光检测、愈伤组织GFP荧光检测以及JsMYB108和JsMYB305转录本分析,表明2个MYB基因在自身愈伤组织中成功地进行了过表达。JsMYB108和JsMYB305基因过表达后愈伤组织中4个JsTPS的表达量得到了不同程度的提高,表明利用愈伤组织进行转录激活实验是可行的。我们进一步将JsMYB108和JsMYB305构建到诱导型载体pMDC7[38-39]转化茉莉茎段愈伤,诱导培养14 d,使用10 μm雌二醇(17α-estradiol)诱导表达48 h后检测愈伤组织中4个JsTPS基因的表达水平,获得了与本研究中一致的结果(未发表),进一步证实了此系统验证转录激活的可行性。
3.2 茉莉花JsMYB108和JsMYB305可能参与了萜类香气物质合成的调控
茉莉花JsMYB108和JsMYB305有典型的R2R3结构域,表明它们为R2R3型MYB转录因子。JsMYB108和JsMYB305与其他物种中MYB108和MYB305蛋白相似度最大,MYB108对花瓣颜色的遗传调控与进化发挥了重要作用[36],而MYB305相关蛋白在花中苯丙类生物合成基因中有一定的激活作用[37],表明它们可能参与了花色和花香的调控。此外,将JsMYB108和JsMYB 305与拟南芥 R2R3型MYB转录因子构建遗传进化树,发现JsMYB108和JsMYB305与拟南芥AtMYB112以及AtMYB21亲缘关系最近,其中MYB112是在非生物胁迫条件下促进花青素积累的调控因子[36]。而拟南芥MYB21和MYB24分别与矮牵牛EOBI和EOBII同源,属于MYB家族的不同分支,通过同时调节初级代谢和苯丙烷代谢的基因来触发苯丙烷途径代谢产物的合成[38],提示JsMYB108和JsMYB305与香气调控相关。
对一些植物香气相关转录因子的研究表明其调控的下游基因通常与转录因子具有一致的表达特征[10-12]。本研究中,JsMYB108和JsMYB305在昼夜不同时间点的表达水平与4个JsTPS基因的表达特征一致,表现为夜间21:00及1:00高量表达,白天11:00和15:00表达量低,与前人对双瓣茉莉花主要萜烯类成分相对含量变化规律相一致[40]。此外,JsMYB108转化茉莉愈伤组织后JsTPS2表达水平显著提高,JsMYB305转化茉莉愈伤组织后4个JsTPS基因表达量均显著提高。介于TPS是萜类代谢途径下游的限速酶[9],JsTPS1、JsTPS2和JsTPS3与倍半萜合成酶TPS2高度同源,而JsTPS4与单萜合成酶FaNES1[22]高度同源,此结果提示JsMYB108和JsMYB305可能参与倍半萜和单萜类香气的调控。由于萜类合成途径中报道的转录因子很少,目前仅在姜花[18]、紫丁香[19]和金龙胆[20]中有初步探索,本研究的結果为将来茉莉花萜类香气的深入调控研究提供了一些候选方向和基因选择。
参考文献
[121] 方秋萍. 茉莉在中国的传播及其影响研究[D]. 南京: 南京农业大学, 2009.
[122] 李先玉. 高品质茉莉花茶加工技术及品质影响关键因素的研究现状[J]. 福建轻纺, 2019(3): 30-34.
[123] 孟 菲, 秦昭君. 特种茉莉花茶及其品质影响因素的研究[J]. 乡村科技, 2018(1): 78-79.
[124] 安会敏, 欧行畅, 熊一帆, 等. 茉莉花茶挥发性成分在窨制过程中的变化研究[J]. 茶叶通讯, 2020, 47(1): 67-74.
[125] 叶秋萍, 金心怡, 李鑫磊, 等. 茉莉花茶窨制过程理化指标及花茶品质变化的研究[J]. 食品工业科技, 2015, 36(12): 99-103, 108.
[126] 陈志伟. 福州茉莉花茶窨制工艺的研究分析[J]. 中国绿色画报, 2018(7): 101.
[127] Bera P, Kotamreddy J N, Samanta T, et al. Inter-specific variation in headspace scent volatiles composition of four commercially cultivated jasmine flowers[J]. Natural Product Research. 2015, 29(14): 1328-1335.
[128] Bera P, Mukherjee C, Mitra A. Enzymatic production and emission of floral scent volatiles in Jasminum sambac[J]. Plant Science, 2017, 256: 25-38.
[129] Muhlemann J K, Klempien A, Dudareva N. Floral volatiles: from biosynthesis to function[J]. Plant Cell Environment, 2014, 37(8): 1936-1949.
[130] Spitzer-Rimon B, Marhevka E, Barkai O, et al. EOBII, a gene encoding a flower-specific regulator of phenylpropanoid volatiles biosynthesis in Petunia[J]. Plant Cell, 2010, 22(6): 1961-1976.
[131] Spitzer-Rimon B, Farhi M, Albo B, et al. The R2R3- MYB-like regulatory factor EOBI, acting downstream of EOBII, regulates scent production by activating ODO1 and structural scent-related genes in Petunia[J]. Plant Cell, 2012, 24(12): 5089-5105.
[132] Van Moerkercke A, Haring M A, Schuurink R C. The transcription factor EMISSION OF BENZENOIDS II activates the MYB ODORANT1 promoter at a MYB binding site specific for fragrant petunias[J]. Plant Journal, 2011, 67(5): 917-928.
[133] Colquhoun T A, Kim J Y, Wedde A E, et al. PhMYB4 fine-tunes the floral volatile signature of Petunia × hybrida through PhC4H[J]. Journal of Experimental Botany, 2011, 62(3): 1133-1143.
[134] CnaAni A, Mühlemann J K, Ravid J, et al. Petunia × hybrida floral scent production is negatively affected by high-temperature growth conditions[J]. Plant Cell Environment, 2015, 38(7): 1333-1346.
[135] Medina-Puche L, Molina-Hidalgo F J, Boersma M, et al. An R2R3-MYB transcription factor regulates eugenol production in ripe strawberry fruit receptacles[J]. Plant Physiology, 2015, 168(2): 598-614.
[136] Yoshida K, Oyama-Okubo N, Yamagishi M. An R2R3-MYB transcription factor ODORANT1 regulates fragrance biosynthesis in lilies (Lilium spp.)[J]. Molecular Breeding, 2018, 38(12): 144.
[137] Borevitz J O, Xia Y, Blount J, et al. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J]. Plant Cell, 2000, 12(12): 2383-2394.
[138] Yue Y, Yu R, Fan Y. Transcriptome profiling provides new insights into the formation of floral scent in Hedychium coronarium[J]. BMC Genomics, 2015, 16: 470.
[139] Zheng J, Hu Z, Guan X, et al. Transcriptome analysis of Syringa oblata Lindl. inflorescence identifies genes associated with pigment biosynthesis and scent metabolism[J]. PloS One, 2015, 10(11): e0142542.
[140] Sun W J, Zhan J Y, Zheng T R, et al. The jasmonate-responsive transcription factor CbWRKY24 regulates terpenoid biosynthetic genes to promote saponin biosynthesis in Conyza blinii H. Lév[J]. Journal of Genetics, 2018, 97(5): 1379-1388.
[141] Wang P W, Niu P N, Liu F F, et al. Cloning and functional assessments of floral-expressed SWEET transporter genes from Jasminum sambac[J]. International Journal of Molecular Sciences, 2019, 20(16): 4001.
[142] Aharoni A, Giri A P, Verstappen F W A, et al. Gain and loss of fruit flavor compounds produced by wild and cultivated strawberry species[J]. Plant Cell, 2004, 16(11): 3110- 3131.
[143] Martin D M, F?ldt J, Bohlmann J. Functional characterization of nine Norway Spruce TPS genes and evolution of gymnosperm terpene synthases of the TPS-d subfamily[J]. Plant Physiology, 2004, 135(4): 1908-1927.
[144] Lu Y, Liu Z Y, Lyu M L, et al. Characterization of JsWOX1 and JsWOX4 during callus and root induction in the shrub species Jasminum sambac[J]. Plants, 2019, 8(4): 79.
[145] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
[146] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
[147] 赖明志. 台湾种茉莉的种性与繁殖特性[J]. 福建农业大学学报, 1995(3): 291-294.
[148] 甘煌灿, 赖呈纯, 潘 红, 等. 刺葡萄DFR基因植物表达载体构建及转化茉莉花愈伤组织的研究[J]. 热带作物学报, 2018, 39(6): 1128-1136.
[149] Zvi M M B, Shklarman E, Masci T, et al. PAP1 transcription factor enhances production of phenylpropanoid and terpenoid scent compounds in rose flowers[J]. New Phytologist, 2012, 195(2): 335-345.
[150] Yauk Y K, Souleyre E J, Matich A J, et al. Alcohol acyl transferase 1 links two distinct volatile pathways that produce esters and phenylpropenes in apple fruit[J]. Plant Journal for Cell and Molecular Biology, 2017, 91(2): 292-305.
[151] Fujii N, Miyama T A. Interlinking showy traits: co-engineering of scent and colour biosynthesis in flowers[J]. Plant Biotechnology Journal, 2010, 6(4): 403-415.
[152] 孙艳妮, 汤访评, 房伟民, 等. 茉莉离体快繁体系的建立[J]. 浙江农业学报, 2009, 21(4): 390-394.
[153] 何丽斯. 茉 莉(Jasminum sambac L.)对低温胁迫的生理响应及离体快繁研究[D]. 南京: 南京农业大学 2010.
[154] 李聪聪. 双瓣茉莉快繁体系的建立和温度对其开花的影响[D]. 南京: 南京师范大学, 2012.
[155] 嚴华兵, 闭志强, 蒙宗健, 等. 茉莉及其家族成员非试管快繁技术研究[J]. 广西农业科学, 2009(2): 190-193.
[156] 甘煌灿, 赖呈纯, 朱育菁, 等. 茉莉花愈伤组织的诱导及其继代保持[J]. 福建农业学报, 2013, 28(10): 976-980.
[157] 甘煌灿. 茉莉花离体培养及其花色遗传转化体系的初步研究[D], 福州: 福州大学, 2014,
[158] Curtis M D, grossniklaus U. A gateway cloning vector set for high-throughput functional analysis of genes in planta[J]. Plant Physiology, 2003, 133(2): 462-469.
[159] Zuo J, Niu Q W, Chua N H. An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants[J]. The Plant Journal, 2000, 24(2): 265-273.
[160] 李 鹤, 俞 滢, 陈桂信, 等. 双瓣茉莉花[Jasminum sambac(L.) Ait]开放过程香气成分的动态变化[J]. 茶叶学报, 2015, 56(1): 29-38.
责任编辑:黄东杰

