昆虫钠离子通道的研究进展
吴少英, 段文波, 李 芬, 杨 磊, 王 颢, 王力奎
(海南大学三亚南繁研究院, 海南三亚 572025)
伴随着从低等无脊椎动物到高等脊椎动物的进化,昆虫电压门控钠离子通道(voltage-gated sodium channel)也经历了漫长的演化,其蛋白结构和功能与哺乳动物类似(Littleton and Ganetzky, 2000; Zakon, 2012)。相较于哺乳动物有9个及以上的钠离子通道基因,在目前已经完成基因组测序的143种昆虫中,除了蚜虫有2个钠离子通道基因(Ameyetal., 2015; Zuoetal., 2016; Jiangetal., 2017; 段文波等, 2020; 王颢等, 2020)外,其他昆虫均只有1个钠离子通道基因(Dongetal., 2014; Yinetal., 2016; Wuetal., 2017)。尽管昆虫钠离子通道基因数量较少,但其可通过可变剪切和RNA编辑等方式丰富其钠离子通道的生理功能。比如去除可变剪切外显子b后,绿盲蝽Apolyguslucorum、黑腹果蝇Drosophilamelanogaster和德国小蠊Blattellagermanica等昆虫钠离子通道在双电极电压钳系统下的电压信号迅速增强(Songetal., 2004; Zhangetal., 2020)。作为很多动物源和植物源毒素以及拟除虫菊酯类杀虫剂等化合物的作用靶标,昆虫钠离子通道的突变可导致靶标敏感性显著下降。研究表明,删除德国小蠊钠离子通道基因可变剪切位点G1111后,其对Ⅱ型拟除虫菊酯——溴氰菊酯的敏感性显著下降,但是对Ⅰ型拟除虫菊酯——苄氯菊酯的敏感性并没有改变(Duetal., 2009a)。黑腹果蝇胚胎中可变剪切f占所有剪切体的比例远远高于成虫,但在胚胎中j的出现率仅为10%,在成虫中却高达89%(Songetal., 2004)。可变剪切还可以调节神经兴奋。例如,黑腹果蝇钠离子通道可变剪切f可导致电压依赖性钠离子通道活化并使其向超极化方向偏移(Linetal., 2009)。由上述可知,昆虫钠离子通道可变剪切不仅影响其表达量,还可改变其电压依赖程度。此外,RNA编辑也会改变钠离子通道的门控特性。如德国小蠊BgNav1-1基因U至C的RNA编辑(核苷酸变化T3854C,氨基酸变化L1285P),可导致钠离子通道的激活和失活并向去极化方向偏移(Liuetal., 2004)。综上,昆虫钠离子通道基因序列或者表达上的微小差别,均能引起其行为反应的巨大差异。
神经毒剂与昆虫钠离子通道相互结合位点一直是研究的热点和难点。Catterall(1992)推测每一种通道只有一个药剂结合位点。O′Reilly等(2006)以钾离子通道晶体结构为基础,通过计算机建模,模拟家蝇Muscadomestica钠离子通道与拟除虫菊酯杀虫剂相互作用的分子模型,认为其只有一个结合区域,但在这个区域外却发现了更多的突变位点。早在2000年Vais等曾经预测,昆虫钠离子通道上存在两个拟除虫菊酯杀虫剂结合位点(Vaisetal., 2000)。2013年董珂课题组关于埃及伊蚊Aedesaegypti钠离子通道突变体的研究也证实了这一点,发现跨膜区位点突变能导致钠离子通道结构和功能发生变化(Duetal., 2013)。虽然昆虫钠离子通道与不同拟除虫菊酯药剂有双结合位点的共性,但它们对相同拟除虫菊酯药剂的选择性存在差异。Wu等(2017)发现在蜂-螨防治过程中使用的一种拟除虫菊酯药剂——氟胺氰菊酯,它对狄斯瓦螨Varroadestructor等其他昆虫毒性高,但对蜂毒性却很低,从而引起蜂对氟胺氰菊酯的敏感性降低,这是由于熊蜂Bombusimpatiens钠离子通道氨基酸位点的特异性导致。综上,国内外科研人员在过去几十年间对钠离子通道和拟除虫菊酯杀虫剂作用于钠离子通道的分子机理研究方面已经取得了长足进展。
因此,基于昆虫钠离子通道多物种适应性进化,进一步探索其结构和功能,对于研发安全、高效的钠离子通道靶向型化学药剂,并以此防治田间害虫有重要推动作用。
1 昆虫钠离子通道基因序列和结构
1.1 昆虫钠离子通道基因鉴定、外源表达和结构解析
Loughney等(1989)从黑腹果蝇中首次克隆出昆虫钠离子通道基因DmNav,由于该基因位于黑腹果蝇温度敏感的麻痹区域(paralysis locus),因此又将其通称为para。DmNav与哺乳动物钠离子通道α亚基序列相似性极高,即高度保守(Loughneyetal., 1989; Soderlund, 2005; Dong, 2007)。随后科学家们利用非洲爪蟾Xenopuslaevis卵母细胞对DmNav展开功能研究,这奠定了昆虫钠离子通道分子、功能和药理学研究的基础(Fengetal., 1995; Warmkeetal., 1997)。目前,已经在非洲爪蟾卵母细胞中成功表达的昆虫钠离子通道包括黑腹果蝇钠离子通道DmNav(Loughneyetal., 1989)、家蝇钠离子通道Vssc1(Smithetal., 1997)、德国小蠊B.germanica钠离子通道BgNav(Liuetal., 2000; Tanetal., 2002)、狄斯瓦螨钠离子通道VdNav(Duetal., 2009b)、埃及伊蚊钠离子通道AaNav(Duetal., 2013)、西方蜜蜂Apismellifera钠离子通道AmNav1(Badaroudineetal., 2015)、熊蜂钠离子通道BiNav(Wuetal., 2017)、绿盲蝽钠离子通道AlNav(Zhangetal., 2020)、褐飞虱Nilaparvatalugens钠离子通道NlNav(Sunetal., 2020)和斑翅果蝇Drosophilasuzukii钠离子通道DsNav(未发表),这些昆虫钠离子通道均表现出复极化、失活、去激活和失活后恢复等主要的门控特性。上述基于双电极电压钳系统的研究验证了部分昆虫钠离子通道可变剪切和RNA编辑的功能,解释了昆虫钠离子通道部分突变位点与拟除虫菊酯药剂抗药性的互作关系。此外,还可以利用CRISPR/Cas9等基因编辑技术对尚未鉴定到的昆虫钠离子通道展开功能研究。
冷冻电镜开辟了离子通道三维结构研究的先河,研究人员最初以钾离子通道的晶体结构为基础,通过计算机建模,模拟昆虫钠离子通道的空间结构(O′Reillyetal., 2006)。2011年第一个原核生物钠离子通道结构NavAb的晶体结构被解析,2012年《Science》杂志同一期报道了原核生物钠离子通道NavRh失活态(inactivated state)和NavAb另外两种失活态的晶体结构(Payandehetal., 2011; Payandehetal., 2012; Zhangetal., 2012)。2017年科学家首次从真核生物美洲大蠊Periplanetaamericana中得到钠离子通道PaNav的结晶体-EM结构,其包括一个与VSD1区域比邻的保守型氨基端结构域和一个与domain Ⅲ-domain Ⅳ-linker链接在一起的羧基端结构域(Shenetal., 2017)。这是昆虫钠离子通道里程碑式的发现,并为进一步研究钠离子通道和与之有关的钙离子通道功能奠定了重要基础。Shen等(2018)发现美洲大蠊PaNav与河豚毒素和蛤蚌毒素结合在选择性滤器入口处,而与蜘蛛毒素结合在孔道结构域之间的外侧部位。随后,Yan等(2017)采用电镜法解析了电鳗钠离子通道EeNav1.4的结构,并首次揭示了其β亚基的结构及其与α亚基的相互作用。上述这些研究表明冷冻电镜技术不仅有助于解析昆虫钠离子通道多个不同状态的构象,还有助于阐明昆虫钠离子通道结构的动态变化过程。
1.2 昆虫钠离子通道α亚基
昆虫钠离子通道由一个分子量为260 kD左右的α亚基和5个辅助小亚基组成,将α亚基单独注射入爪蟾卵母细胞中,其具有钠离子通道活性,而另外5个辅助亚基则起到调节钠离子通道表达或者调节钠离子通道门控的作用(Armstrong and Bezanilla, 1997; Goldin, 2002)。钠离子通道α亚基是跨膜糖蛋白,由domain Ⅰ, domain Ⅱ, domain Ⅲ和domain Ⅳ 4个同源性极高的跨膜结构域和一个 N端及C端组成(图1: A)。4个结构域相互围绕形成中央孔洞,各个跨膜结构域之间由接头(linker)相互连接,形成一个四联体,构成钠离子通道的结构基础(Dong, 2007)。每个结构域由6个疏水性跨膜螺旋体(S1-S6)组成,S1-S4构成电压感受模块,S5, S6和连接S5及S6段的LOOP(P-LOOP)形成钠离子通道的孔模块。每个S4跨膜螺旋体包含带正电荷的氨基酸残基的重复基序,其次是两个疏水残基,构成钠离子通道电压传感器。为响应膜去极化,S4开始向外移动,且构象发生变化,通道打开,导致钠离子通道失活。在通道打开和关闭期间,S4和S5段由短细胞内连接子(L45)连接(Catterall, 2000)。
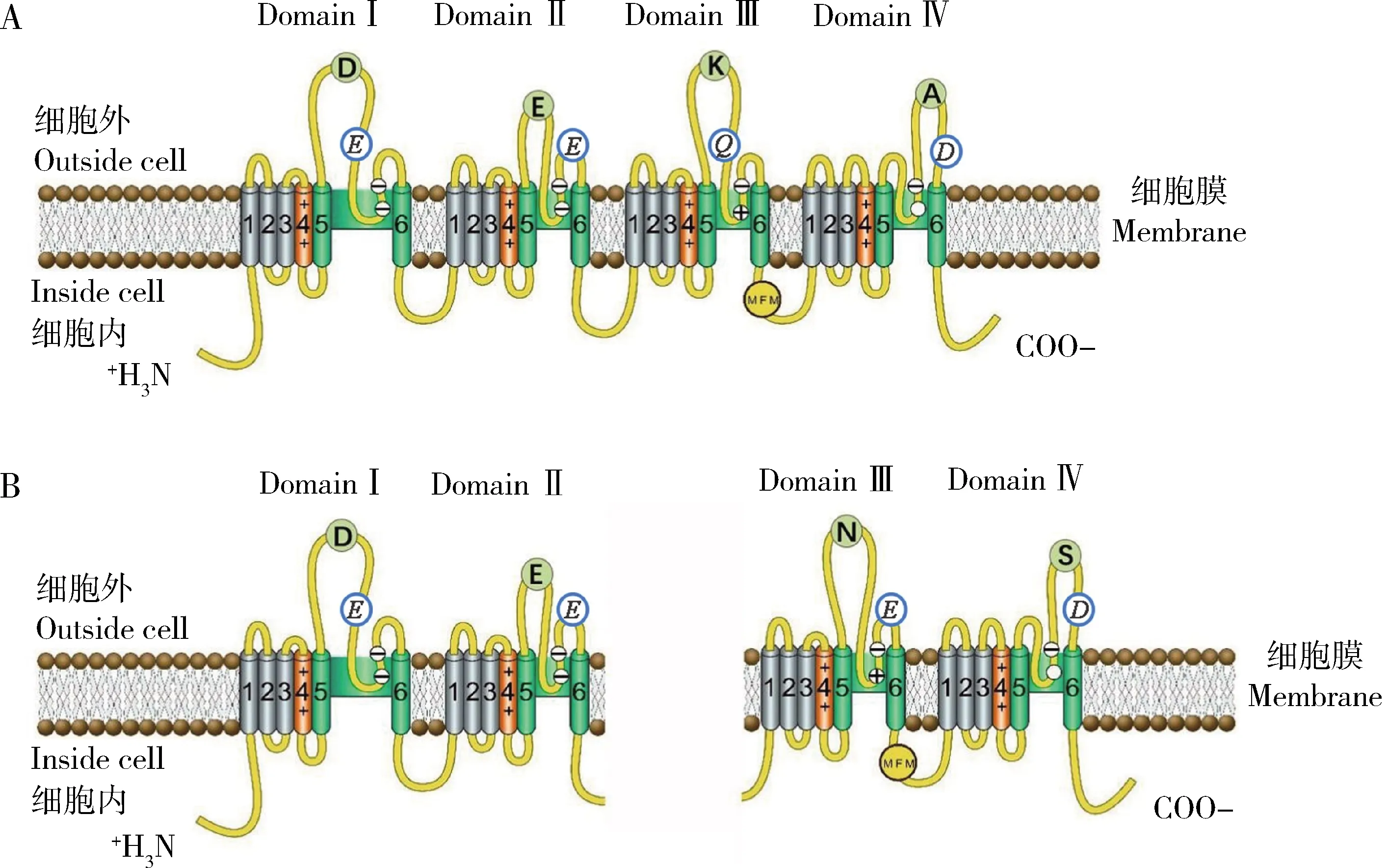
图1 非蚜虫类昆虫(A)和蚜虫(B)电压门控钠离子通道的跨膜拓扑结构(改自Jiang et al., 2017)
每个同源结构域的S4跨膜区都含有一个保守元件,其含有带正电荷的精氨酸或赖氨酸重复基序(repeated motif),这些氨基酸分别由2个中性氨基酸隔开,形成通道的电压敏感元件,即电压感受器。当细胞去极化时,这些正电荷能检测膜电场,导致钠离子通道4个结构域的S4跨膜片段向膜外移动,带动S1, S2和S3移动,引起钠离子通道构象变化,从而实现跨膜口和通道的开启。通道开放伴随着大量钠离子内流,进而产生门控电流(gating current),数毫秒后,S4往后移动,带动S1, S2和S3恢复原位,激活闸门和离子通道关闭。S5和S6两个跨膜区参与形成钠离子通道亲水孔道,即4个同源结构域的8个S5和S6跨膜片段共同围绕形成细胞亲水孔道(Dongetal., 2014)。
钠离子通道结构域P-LOOP环上分别有D, E, K和A 4个氨基酸残基,它们决定了钠离子通道的选择性,昆虫钠离子通道domain Ⅲ和Ⅳ之间还存在一个失活阀门MFM(Met-Phe-Met),DEKA和MFM是判断普通昆虫钠离子通道α亚基的关键氨基酸位点(Dongetal., 2014)。哺乳动物钠离子通道中失活阀门是IFM,IFM快失活基序可与domain Ⅲ和Ⅳ结构域中6-TM的S4-S5 linker和S6作用,导致钠离子通道快速失活,推测其可能限制了钠离子通道的开放构象,从而发挥作用(Yanetal., 2017; Panetal., 2018)。由上述可知,昆虫钠离子通道失活阀门MFM与哺乳动物钠离子通道IFM起类似作用。
半翅目蚜虫类钠离子通道结构较为特殊,其分别由分子量为130 kD和 110 kD左右的两个α亚基组成(图1: B),且选择性过滤器内圈关键氨基酸并非常见的DEKA,而是DENS,其外圈关键氨基酸也并非其他生物常见的EEQD,而是EEED。蚜虫钠离子通道domain Ⅲ和Ⅳ间存在MFM元件,其在昆虫中十分保守,是失活门控关键氨基酸(Ameyetal., 2015; Zuoetal., 2016; Jiangetal., 2017; 段文波等, 2020; 王颢等, 2020)。电生理数据显示当黑腹果蝇钠离子通道的“DEKA”被“DENS”取代后,其对河豚毒素(tetrodotoxin, TTX)的敏感性降低,这与蚜虫对TTX不敏感的生物测定结果一致,推测与其钠离子通道选择性过滤器DENS相关,且可能是进化或遗传漂变产生的结果(Ameyetal., 2015)。而哺乳动物钠离子通道可分为TTX敏感型和TTX不敏感型两大类,其中前一类型分布远远广于后一类型(Ogata and Tatebayashi, 1993)。
1.3 昆虫钠离子通道辅助亚基
昆虫TipE蛋白和TipE同源蛋白(TEH1-4)作为辅助亚基,在调控钠离子通道表达过程中发挥重要作用。二者均由两个跨膜结构域、连接两个跨膜区的细胞外连接肽和细胞内N端及C端氨基酸残基构成。不同昆虫TipE蛋白和TEH蛋白在调控钠离子通道门控性质时既有相似之处,也存在差异。研究表明多种昆虫的TipE和TEH1-2均可以促进钠离子通道α亚基的表达,进而参与其动力学和电压门控的调节(Fengetal., 1995; Warmkeetal., 1997; Leeetal., 2000; Duetal., 2013)。将黑腹果蝇的DmNav9-1, DmNav22和DmNav26分别与TipE和TEH1-4共表达,结果表明TipE, TEH1和TEH2均能促进钠离子通道的表达,其中TipE可使其向超级化方向移动,而TEH1则使钠离子通道的激活、快速失活和慢失活都往超级化方向移动;反之,TEH3和TEH4产生的外向电流对钠离子通道的表达有抑制作用,它们是否也参与其他离子通道的门控调控仍需做进一步探究(Wangetal., 2013, 2015)。有研究指出美洲大蠊TipE与黑腹果蝇钠离子通道α亚基共表达所产生的电流比黑腹果蝇钠离子通道α亚基与TipE共表达产生的电流大,但美洲大蠊TipE与α亚基共表达却没有电流出现(Bourdinetal., 2015)。TipE和TEH1-4在不同组织中的表达模式也存在差异,其中TEH1只在神经系统中广泛分布,而TipE和TEH2-4除在神经系统中表达外,还在其他组织,如脂肪体、马氏小管、肠道、唾液腺、中枢神经系统和体壁肌肉中表达(Derstetal., 2006)。
目前人类钠离子通道NaV1.4 α亚基与β1亚基的相互作用已经通过结构生物学方法得到解析(图2),人类钠离子通道NaV1.4 α亚基与β1亚基的结合部位位于Domain Ⅲ区域。NaV1.4 α亚基Domain Ⅲ与Domain Ⅳ区域的电压传感器是完全重叠的,但是Domain Ⅰ或Domain Ⅱ却没有表现出此类特性。通过模拟其空间结构,发现人钠离子通道NaV1.4 α亚基与细菌NaChBac的Domain Ⅲ结构高度相似(Molinaroloetal., 2018)。因此,哺乳动物晶体结构的解析对昆虫辅助亚基功能研究有重要借鉴意义。
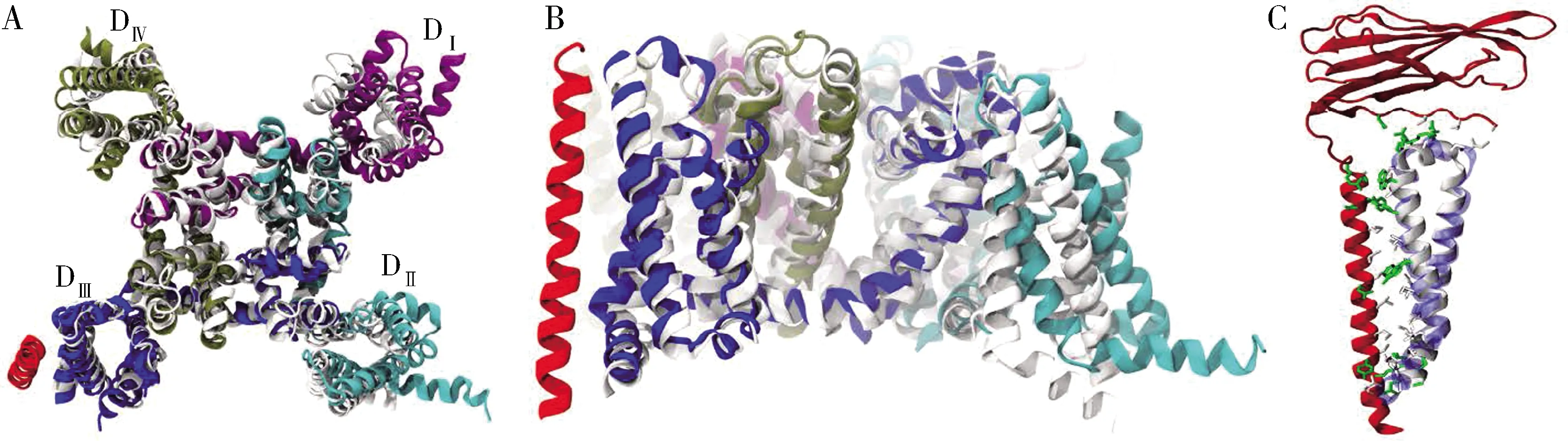
图2 钠离子通道NaV1.4 α/β1亚基互作结构模型(引自Molinarolo et al., 2018)
2 昆虫钠离子通道可变剪切和RNA编辑
哺乳动物有9个不同的钠离子通道α亚基,它们在不同类型细胞、组织和发育阶段表达,且在特定细胞中行使独特的生理功能(Catterall, 2000; Goldinetal., 2000; Yu and Catterall, 2003)。而绝大部分昆虫只有1个或者2个钠离子通道基因,其如何能用数量甚少的钠离子通道基因行使复杂的生理功能仍是当下的研究热点与难点。研究表明绿盲蝽和黑腹果蝇等昆虫的钠离子通道存在大量的可变剪切和RNA编辑(Loughneyetal., 1989; Thackeray and Ganetzky, 1994, 1995; Hanrahanetal., 2000; Reenanetal., 2000; Olsonetal., 2008; Zhangetal., 2020),这些可变剪切和RNA编辑有助于钠离子通道行使门控通道和药理学功能。
2.1 昆虫钠离子通道可变剪切
可变剪切(alternative splicing)是一种基因转录后调控机制,可增加mRNA的多样性。昆虫不同组织部位和不同发育阶段可以产生多个不同的可变剪切转录本,从而增加钠离子通道基因的多样性,使其呈现出相似、差异或者互斥的功能,进而导致钠离子通道门控和药理学性质等方面的差异(Tanetal., 2002)。
Lee等最先报道了黑腹果蝇钠离子通道存在11种可变剪切外显子,其中外显子a, b, e, f, h, i和j位于细胞内接头上,4个互斥外显子c/d和k/l位于跨膜区,这与其他昆虫钠离子通道结构(Leeetal., 2002; Sonodaetal., 2008)类似。但同种昆虫不同部位和不同发育阶段产生的选择性剪切类型或出现的频率不同。如,黑腹果蝇钠离子通道在胚胎中的剪切体类型是27种,而在成虫期是29种(Olsonetal., 2008; Linetal., 2009)。外显子j在黑腹果蝇胚胎和成虫中出现的频率分别为10%和89%,而外显子f在胚胎中的出现频率则显著高于成虫。黑腹果蝇、绿盲蝽和德国小蠊钠离子通道中外显子b的出现频率分别是60%, 55%和20%(Linetal., 2009)。另外,黑腹果蝇存在外显子c和d,而德国小蠊和西方蜜蜂中只存在外显子c而没有外显子d;反之,绿盲蝽和赤拟谷盗Triboliumcastaneum则只存在外显子d,而没有外显子c(Daviesetal., 2007; Zhangetal., 2020)。可变剪切不仅参与钠离子通道的表达调控,还可改变钠离子通道激活和失活电压。如,不含外显子b的黑腹果蝇、绿盲蝽和德国小蠊钠离子通道在双电极电压钳系统下的表达速率显著加快(Songetal., 2004; Zhangetal., 2020)。研究表明,除绿盲蝽和赤拟谷盗仅含有互斥子l外,大部分昆虫,如桃蚜Myzuspersicae等钠离子通道均含有k/l两个保守性很高的互斥子(Daviesetal., 2007; Zhangetal., 2020)。黑腹果蝇钠离子通道中的互斥外显子k和l与电流的持续性产生相关(Linetal., 2009),即含有外显子l的钠离子通道神经活动比含有外显子k的钠离子通道更加活跃。德国小蠊与黑腹果蝇k/l同源的外显子分别是G1/G2,除G1和G2外,其还存在一个与哺乳动物类似的含终止密码子的外显子G3,或参与生物体兴奋传导(Songetal., 2004)。此外,家蚕Bombyxmori和褐色桔蚜Toxopteracitricid也存在外显子a, f, h和i,但这些在所有钠离子通道剪切体中均存在,因此不属于可变剪切(Shaoetal., 2009; Jiangetal., 2017)。Davies等(2007)曾报道外显子e仅存在部分双翅目昆虫中,后续褐色桔蚜的研究也表明此物种确实没有外显子e(Daviesetal., 2007; Jiangetal., 2017)。综上,昆虫钠离子通道可变剪切可能出现在昆虫的不同部位及发育阶段,从而行使不同功能,但某个可变剪切的具体功能仍需做进一步探究。
2.2 昆虫钠离子通道RNA编辑
RNA编辑是mRNA在转录水平上通过碱基插入、缺失或者替换从而引起氨基酸改变,扩大了生物体遗传信息,有利于其更好地适应外界环境。昆虫钠离子通道存在两种RNA编辑形式:一种是A至I编辑,另一种是U至C编辑。A至I编辑是腺苷A去氨基转变为次黄嘌呤I,这种编辑方式在昆虫中出现频率很高。RNA编辑最初发现于锥虫线粒体中(Benneetal., 1986),之后在黑腹果蝇、绿盲蝽和德国小蠊等昆虫中相继被报道(Palladinoetal., 2000; Songetal., 2004; Zhangetal., 2020)。在黑腹果蝇钠离子通道基因中已经鉴定了11个A至I编辑位点,其中9个可导致氨基酸突变(Hanrahanetal., 2000; Palladinoetal., 2000; Reenanetal., 2000; Riederetal., 2013)。环境条件的改变能诱导昆虫钠离子通道的RNA编辑,如10~30℃的温度变化能迅速引起果蝇钠离子通道A至I编辑(Riederetal., 2015)。在德国小蠊中发现两个A至I编辑位点,氨基酸突变分别为K184R和I1660M,其中K184R突变能引起钠离子通道激活向去极化方向偏移。在绿盲蝽钠离子通道中也发现同样的RNA编辑位点I1660M(Songetal., 2004; Zhangetal., 2020)。此外,昆虫钠离子通道还存在U至C编辑,例如F1919S位点编辑同时存在于黑腹果蝇和德国小蠊中,且此类编辑可产生持久电流(Liuetal., 2004)。RNA编辑存在组织特异性,A至I编辑通常发生于神经节中,U至C编辑则存在卵巢和肠道中。德国小蠊4类RNA编辑K467R, Y548C, N567D 和K699R在幼虫、蛹和成虫不同发育阶段出现的频率不同,其中K467突变为467Q或467R都能提高瞬时内向电流(Ryanetal., 2012)。RNA编辑还能引起昆虫神经性兴奋,并产生巨大的生物物理学反应(Sunetal., 2012)。
尽管昆虫钠离子通道基因数量较少,但其可以通过两种转录后修饰(可变剪切和RNA编辑)增加其功能多样性,某些核苷酸的细微变化就能引起昆虫钠离子通道结构与功能的改变,有的可以导致昆虫生理功能缺陷(Lindsayetal., 2008),有的能够帮助昆虫迅速适应外界环境的变化(Riederetal., 2015),还有些则能改变昆虫钠离子通道与外源物质的结合能力(Songetal., 2011)。
3 几种神经毒剂与昆虫钠离子通道相互作用
3.1 神经毒素与钠离子通道的结合位点
钠离子通道是许多动物源毒素、植物源毒素和化合物等的作用靶标(Stevensetal., 2011)。神经毒素是能够影响神经系统的天然或者人工化学分子,其作用于钠离子通道的方式主要有两种:一种是改变门控力学和电压依赖性,另一种是侵占孔道并影响离子通透性。神经毒素(包括天然毒素和杀虫剂)作用于钠离子通道的位点共有8种类型(图3):位点1,河豚毒素(tetrodotoxin, TTX)、石房蛤毒素(saxitoxin, STX)和μ-芋螺毒素(μ-conotoxin)插入孔区,使钠离子通道失活(Stephanetal., 1994; Narahashi, 2008; Chauetal., 2011; Shenetal., 2018);位点2,蟾毒素(batrachotoxin)、藜芦定(veratridine)和木藜芦毒素(grayanotoxin)等毒素能抑制钠离子通道的失活,使其保持持续激活状态(Wang and Wang, 1998, 1999; Duetal., 2001);位点3,蝎毒素(scorpion α-toxin)、海葵毒素(sea anemone toxin)、蜘蛛毒素(δ-atracotoxin)和黄蜂毒素(β-PMTX)能延缓或抑制钠离子通道的失活(Rogersetal., 1996; Tejedor and Catterall, 1988; Nicholsonetal., 2004; Schiavonetal., 2010);位点4,β-蝎毒素(scorpion β-toxin)、β-蜘蛛毒素(spider β-toxin)和μO-芋螺毒素(μO-conotoxin)能激活钠离子通道,且使钠离子通道失活(Nicholson, 2007; Billenetal., 2010; Songetal., 2011);位点5,环聚醚复合物包括双鞭甲藻毒素(brevetoxin)和雪卡毒素(ciguatoxin)等能够抑制并改变钠离子通道的激活(Gawleyetal., 1995; Badenetal., 2005; Perezetal., 2011);位点6,δ-芋螺毒素(δ-conotoxin)等位点毒素延缓钠离子通道的失活(Fainzilberetal., 1994; Shonetal., 1994);位点7,拟除虫菊酯(pyrethroid)和DDT(dichloro-diphenyl-tricgloroethane)能够延缓或抑制通道的失活(Soderlund, 2008; Duetal., 2013; Wuetal., 2017);位点8,局部麻醉剂(local anesthetic)和抗痉挛药(anticonvulsant)等药剂可阻断钠离子通道(Zhangetal., 2016)。
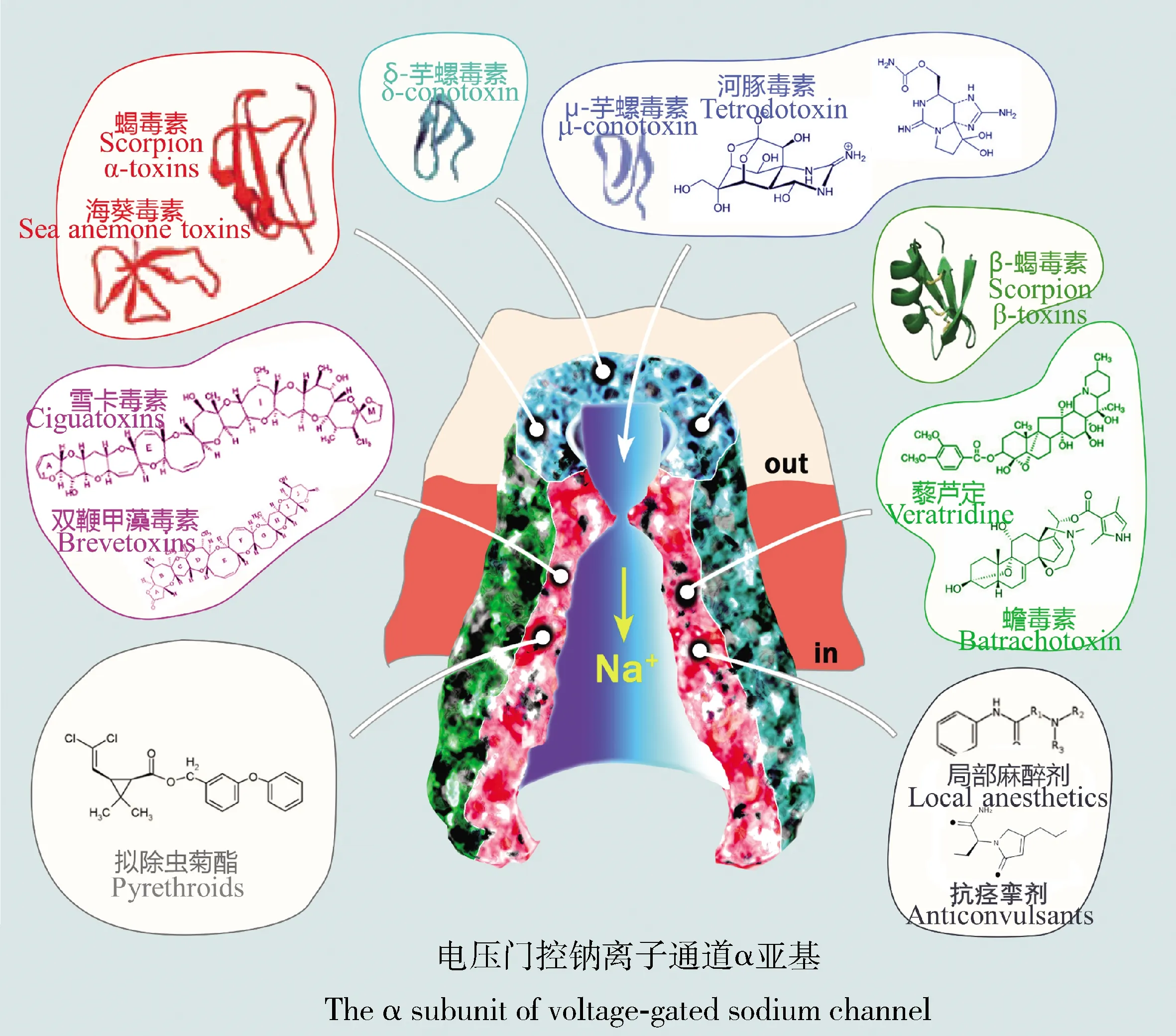
图3 电压门控钠离子通道的神经毒素结合位点(改自Stevens et al., 2011)
3.2 拟除虫菊酯与昆虫钠离子通道相互作用
在农业害虫控制过程中,由于拟除虫菊酯类杀虫剂的不合理使用,抗药性问题日益突出,其中由钠离子通道基因突变导致昆虫钠离子通道与拟除虫菊酯类杀虫剂的结合亲和性下降而产生的击倒抗性(knockdown resistance, kdr)已成为靶标抗性的重要机制之一(Fieldetal., 2017)。
钠离子通道普遍存在于神经细胞、内分泌细胞等可兴奋细胞的细胞膜上,可产生初始动作电位(Armstrong, 1981)。钠离子通道的开启和关闭受电刺激控制,在整个过程中依次呈现静息状态,激活状态以及失活状态。当细胞受到电刺激时,钠离子通道被激活,阀门打开,钠离子顺着电化学梯度跨膜通过并涌入细胞,但仅仅数毫秒后通道就迅速关闭。钠离子通道的开放导致膜两侧电位极性改变,并引起电位差,造成细胞膜动作电位上升(Dong, 2007)。钠离子通道复极化(repolarization)过程包括失活(inactivation)和去激活(deactivation),其中去激活过程中记录的电流称为尾电流(tail current),钠离子通道的失活后恢复(recovery from inactivation)指钠离子通道阀门重新开启并恢复到静止状态(Dongetal., 2014)。钠离子通道的主要功能是维持细胞兴奋性及传导,对心肌细胞、神经元、内分泌细胞和骨骼肌细胞等动作电位的传导有重要作用(Levitan and Kaczmarek, 2002)。拟除虫菊酯药剂可抑制昆虫钠离子通道的失活和去激活化,并延长昆虫钠离子通道开放时间。拟除虫菊酯杀虫剂分为Ⅰ型和Ⅱ型,二者作用于昆虫钠离子通道的原理存在差异:Ⅰ型拟除虫菊酯药剂的作用原理和DDT相似,通过延长钠离子通道开放时间使动作电位升高,导致神经细胞重复放电;Ⅱ型拟除虫菊酯药剂使动作电位低于阈电位,不重复放电,但能扰乱神经突触功能(Lund and Narahashi, 1981)。双电极电压钳试验表明,相比于Ⅱ型拟除虫菊酯,Ⅰ型拟除虫菊酯诱导钠离子通道尾电流衰减的速度更快(Narahashietal., 1996)。拟除虫菊酯Ⅰ型和Ⅱ型药剂使昆虫中毒的症状存在差异,这或许是两种药剂对昆虫钠离子通道尾电流动力学响应不同所致。
拟除虫菊酯杀虫剂在昆虫钠离子通道上有两个结合位点(图4):结合位点Ⅰ,由结构域Ⅱ的S4-S5连接肽、结构域Ⅱ的跨膜螺旋S5和结构域Ⅲ的跨膜螺旋S6组成(O′Reillyetal., 2006);结合位点Ⅱ,由结构域Ⅰ的S4-S5连接肽、结构域Ⅰ的跨膜螺旋S5和S6以及结构域Ⅱ的跨膜螺旋S6组成(Duetal., 2013)。拟除虫菊酯结合位点Ⅰ和Ⅱ在空间上是对称的,但是两个位点的结合方向却相反。溴氰菊酯在与昆虫钠离子通道结合位点Ⅰ结合时,二苯醚基向细胞内侧移动,二溴乙烯基向细胞外侧移动,而结合位点Ⅱ正好与结合位点Ⅰ相反(Duetal., 2015)。虽然结合位点I和结合位点Ⅱ在空间上是对称的,但是二者的功能并不完全相同,例如N3i20A(结合位点Ⅰ:ⅢS6)突变使昆虫对拟除虫菊酯药剂的敏感性显著降低,但N2i20A(结合位点Ⅱ:ⅡS6)突变却不产生类似效果(Duetal., 2015)。研究表明,家蝇和绿盲蝽钠离子通道经典kdr突变F1014L和super-kdr突变M918Ⅰ可赋予其对拟除虫菊酯的抗性,且利用双电极电压钳技术证实了F1014L/M918Ⅰ双突变导致拟除虫菊酯药剂失去与绿盲蝽钠离子通道的结合能力(Wangetal., 2020)。此外,埃及伊蚊钠离子通道L1014位点存在多种形式的突变,如L1014F, L1014C, L1014W, L1014H和L1014S(Scott, 2019)。这些单突变、双突变和多突变使昆虫对杀虫剂所产生的抗性倍数不同,且与地理分布有关。
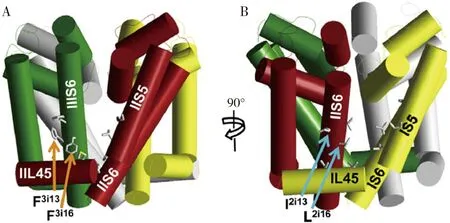
图4 计算机构建的埃及伊蚊钠离子通道的三维结构(引自Du et al., 2013)
相较于大部分昆虫,哺乳动物对拟除虫菊酯药剂均不敏感,这是由于其钠离子通道仅存在结合位点Ⅰ,不存在结合位点Ⅱ导致(Duetal., 2013),且结合位点Ⅰ(IIL45)、结合位点Ⅱ(IL45和IS5)部分氨基酸的突变导致其对拟除虫菊酯药剂的敏感性降低(Soderlund, 2012; Oliveiraetal., 2013)。
虽然不同昆虫钠离子通道与拟除虫菊酯的作用区域均位于结合位点Ⅰ和结合位点Ⅱ,但具体结合位点也存在差异。蜂类(以熊蜂为模型)钠离子通道的研究表明,熊蜂存在V926, F1525和T841等不同于其他昆虫的氨基酸残基(图5),但这些残基在12种蜂类中具有保守性,因此,蜂类的钠离子通道与氟胺氰菊酯(tau-fluvalinate)的结合力没有黑腹果蝇等昆虫的强,这决定了熊蜂钠离子通道对氟胺氰菊酯与其他拟除虫菊酯的独特选择性,揭示了生产中可用氟胺氰菊酯作为蜂类杀螨剂的分子机理(Wuetal., 2017)。

图5 溴氰菊酯(A)和氟胺氰菊酯(B)在熊蜂钠离子通道的结合位点侧视图(引自Wu et al., 2017)
3.3 茚虫威和氰氟虫腙与昆虫钠离子通道相互作用
茚虫威和氰氟虫腙为钠离子通道阻断型杀虫剂,可阻断昆虫中枢和外周神经系统的神经元动作电位(Caballeroetal., 2019)。茚虫威是美国杜邦公司开发的噁二嗪类新型高效杀虫剂,其对鳞翅目和部分同翅目及鞘翅目害虫具有较好的杀虫活性,经口被摄入后可经酯酶或酰胺酶催化并迅速代谢为N-去甲氧羰基代谢物(decarbomethoxylatedmetabolite, DCJW)(Wingetal., 2000)。氰氟虫腙是德国巴斯夫公司与日本农药公司联合推出的一种新型的缩氨基脲类杀虫剂(Salgado and Hayashi, 2007),对鳞翅目昆虫效果较好。神经生理学实验结果表明,茚虫威和氰氟虫腙能不可逆阻断昆虫钠离子通道的功能,导致靶标昆虫运动失调、停止取食、麻痹、死亡(Tsurubuchi and Kono, 2003; Salgado and Hayashi, 2007)。
研究人员在对茚虫威产生抗性的小菜蛾Plutellaxylostella和番茄潜麦蛾Tutaabsoluta种群中检测到了钠离子通道F1845Y和V1848I突变(Wangetal., 2016; Roditakisetal., 2017),在非洲爪蟾卵母细胞中表达两个位点突变后的钠离子通道,发现其与茚虫威的结合能力显著降低(Jiangetal., 2015)。Samantsidis等(2019)通过CRISPR/Cas9 技术在黑腹果蝇体内构建了F1845Y或V1848I突变品系,携带2个突变位点的黑腹果蝇均对茚虫威产生抗性。Gao等(2014)曾经报道了对茚虫威产生抗性的田间品系钠离子通道出现了L1014P突变,但该研究仅局限于domain Ⅱ,而尚未对domain Ⅳ进行点突变检测,因此,其对拟除虫菊酯类药剂产生的交互抗性可能与L1014P突变有关。
麻醉剂也是一种钠离子通道阻断剂。人类钠离子通道NaV1.4 α亚基可与部分麻醉剂相互结合,并引起多个氨基酸位点发生突变。在德国小蠊BgNav1-1中找到与人类钠离子通道NaV1.4相对应的氨基酸位点W377A/S, V1016K, F1463A/L, T1511A, T1760A和L1801A/C,并进行点突变,再通过爪蟾卵母细胞验证以上突变体的作用,结果表明这些点突变均能影响BgNav1-1与茚虫威或者氰氟虫腙的结合。此研究首次揭示了茚虫威和氰氟虫腙的分子选择性杀虫机制,并有助于研发靶向钠离子通道内孔的神经阻断剂(Zhangetal., 2016)。
综上,昆虫钠离子通道与其阻断剂互作机制的研究仍然非常有限,但目前田间农业昆虫对茚虫威和氰氟虫腙的抗性倍数逐年增加和突变位点的日益增多,今后应当进一步加强该方面的深入研究。
4 小结与展望
自32年前首个昆虫钠离子通道基因被克隆以来,人们对昆虫钠离子通道的电生理学、药理学和分子生物学认识取得了重大进展。昆虫钠离子通道在爪蟾卵母细胞中的成功表达及其结晶体的获得对该蛋白的功能研究起着重要的推动作用。尽管昆虫钠离子通道数量很少,但其可通过可变剪切和RNA编辑产生很多变异体(variants),从而丰富了昆虫钠离子通道的结构和功能,但可变剪切和RNA编辑在昆虫神经系统中的调节作用仍需继续探索。
虽然毒理学家已经探明了昆虫钠离子通道的基本结构和毒素结合区域,但是现阶段的研究仍然存在诸多问题。例如,近期的研究发现桃蚜、麦长管蚜Sitobionavenae、豌豆蚜Acyrthosiphonpisum、禾谷缢管蚜Rhopalosiphumpadi、褐色桔蚜等半翅目昆虫具有两个独立且完整的钠离子通道基因:第1个钠离子通道基因具有其他昆虫钠离子通道domain Ⅰ和domain Ⅱ的基本结构,第2个钠离子通道基因则具有其他昆虫钠离子通道domain Ⅲ和domain Ⅳ的基本结构(Ameyetal., 2015; Zuoetal., 2016; Jiangetal., 2017; 段文波等, 2020; 王颢等, 2020),且大部分选择性剪切均发生在第2个钠离子通道基因上。但到目前为止,蚜虫钠离子通道还未在爪蟾卵母细胞中得以成功表达,其具体功能仍需做进一步探索。昆虫钠离子通道辅助亚基的突变是否影响其与神经毒剂的结合或者影响其发育仍尚未知晓,但目前已经有昆虫钠离子通道的晶体结构被解析,且真核生物钠离子通道结构最高分辨率已经达到0.26 nm(Shenetal., 2018),这些研究结果都为后续钠离子通道的功能研究及作用机理解析提供了有价值的参考。
综上,近年来神经毒剂与钠离子通道互作引起了毒理学家的浓厚兴趣,这一领域的深入研究将极大地加深对神经毒剂与害虫耐药性互作分子机制的认知,有助于进一步解析各种神经毒素和杀虫剂与昆虫钠离子通道互作的分子机制,并推动更高效、安全新型杀虫剂的研发。

