秦盾祛痛风胶囊的黄嘌呤氧化酶抑制活性研究
钟剑锋 谢宇宝 蔡汇明 何家豪 杨咏祺 陈晓珺 崔明筠 朱钦昌 付开聪 贺震旦

【摘 要】 目的:秦盾祛痛风胶囊(TFCAP)是哈尼族降尿酸民族药制剂,已在当地中医院用于痛风的治疗,极具潜力和应用前景,但缺乏现代科学证据及机制研究。本研究检测该药的黄嘌呤氧化酶抑制活性和细胞毒性,对其降尿酸机理进行初步探讨,为其应用提供实验支撑和依据。方法:用纯水和乙醇分别提取TFCAP,利用紫外分光光度法建立黄嘌呤氧化酶活性评价模型,检测TFCAP水提物和醇提物及成分标准品降尿酸活性;使用cck8试剂检测该药对不同细胞株的细胞毒性;对醇提物进行HPLC分析。结果:TFCAP水提物的黄嘌呤氧化酶抑制作用较低;TFCAP醇提物对黄嘌呤氧化酶的IC50为(338.3±50.9) μg/mL,对实验所用不同细胞CC50在1.3~2.2 mg/mL之间;建立了醇提物的HPLC指纹图谱。结论:TFCAP醇提物具有良好的黄嘌呤氧化酶抑制活性,是其临床发挥降尿酸作用的可能机制之一,且体外细胞毒性较小,安全性良好。
【关键词】 痛风;哈尼族;黄嘌呤氧化酶;细胞毒性
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2021)13-0033-06
Abstract:Objective Qindunqutongfeng Capsule (TFCAP) is a traditional medicine derived from Hani nationality using for urate-lowering therapy. It has been used in the treatment of gout in the local Chinese medicine hospital. Although with great application prospects in urate-lowering therapy,TFCAP lacks modern scientific evidence and mechanism research. To provide experimental support for the application of TFCAP,this study examines the xanthine oxidase inhibitory activity and cytotoxicity of TFCAP,and preliminarily investigates its mechanism. Methods TFCAP was extracted with pure water and ethanol respectively,and in vitro xanthine oxidase activity evaluation model was applied by using UV spectrophotometry to evaluate the xanthine oxidase inhibitory activity of TFCAP water and ethanol extract; CCK-8 reagent was used to detect the cytotoxicity of TFCAP ethanol extract and component standards on several cell lines; the fingerprint chromatography of TFCAP was determined by HPLC.Result The inhibitory effect of TFCAP water extract on xanthine oxidase is low; The IC50 of the ethanol extract of TFCAP on xanthine oxidase is (338.3±50.9) μg/mL,the CC50 on different cells used in the experiment is between 1.3~2.2 mg/mL; the fingerprint chromatography for ethanol extract of TFCAP was well established. Conclusion TFCAP ethanol extract has low cytotoxicity,and possesses inhibitory activity against xanthine oxidase,which may be one of the possible mechanisms for its urate-lowering effect.
Keywords:Gout; Hani nationality;Xanthine oxidase;Cytotoxicity
痛風是常见多发的代谢性风湿病,我国痛风发病率约为1%~3%[1],痛风临床表现为高尿酸血症,常与多种疾病伴发,严重者易导致肾衰竭危及生命[2]。尿酸由黄嘌呤氧化酶催化黄嘌呤生成 [3],尿酸催化生成过程中还会产生大量超氧阴离子和过氧化氢等自由基,与细胞损伤、炎症等密切相关[4]。因此,抑制黄嘌呤氧化酶的活性是痛风药物研究的一个重要靶点。临床常见的黄嘌呤氧化酶抑制剂主要有别嘌呤醇和非布索坦,但都伴有严重的副作用[5-6],寻找毒副作用小的中药活性成分具有重要的意义和研究前景。
秦盾祛痛风胶囊(原名尿酸消胶囊)是哈尼族民间中药制剂,主要含有秦皮、盾翅藤、虎杖、肾茶等成分,主治尿酸过高引起的痛风 [7]。当地患者使用疗效显著、副作用低,在临床样本观察中,痛风早期患者服用该药物两月后基本恢复正常,部分痛风晚期典型病例服用一或两个疗程后,尿酸值由800显著降低至500左右。但由于临床观察样本少,且具体的降尿酸作用和机制尚未阐明,无法打破该药的地方局限性。本研究以黄嘌呤氧化酶为靶点,利用紫外分光光度法[8],对秦盾祛痛风胶囊的水提和醇提物进行黄嘌呤氧化酶抑制活性和体外细胞毒性研究,并进行HPLC分析,初步探讨其降尿酸的作用和机制,为该民族药的开发和应用提供实验支撑和依据。
1 材料
1.1 药品和试剂 秦盾祛痛风胶囊(TFCAP)购自普洱市民族医院,批号:滇药制字(Z)20140010J;黄嘌呤和黄嘌呤氧化酶购自北京华夏远洋科技有限公司;别嘌呤醇和尿酸购自北京华威锐科化工有限公司;标准品秦皮甲素、虎杖苷、熊果酸购自云南西力生物技术股份有限公司;cck8试剂盒购自深圳莱伯生物科技有限公司。
1.2 仪器 旋转蒸发仪V-100(瑞士BUCHI公司);真空冷冻干燥机LGJ-12S(北京松源华兴生物技术有限公司);酶标仪Synergy H1(美国BioTek公司);高效液相色谱仪LC-2030C(日本Shimadzu公司)
1.3 细胞株 人大肠癌细胞(HCT116)、人宫颈癌细胞(Hela)、人肌肉横纹肌瘤细胞(RD)、和非洲绿猴肾细胞(Vero)主要来源于实验室课题组培养分离所得;人近端肾小管上皮细胞(HKC)购自北京北纳创联生物技术研究院。
2 方法
2.1 提取物制备 将TFCAP去胶囊化,各取TFCAP粉末30 g置于两个1 L圆底烧瓶,加入300 mL99.5%乙醇或300 mL蒸馏水进行回流提取2h,回收乙醇和水提取液,离心取上清液,使用滤纸滤过,然后用旋转蒸发仪(45 ℃,100 mbar,60 rpm)进行减压蒸馏,浓缩除去乙醇和水,放置-80 ℃冷冻冰箱过夜后用真空冷冻干燥机干燥,得秦盾祛痛风胶囊乙醇提取物粉末(TFCAP.E)和水提取物粉末(TFCAP.W)。
2.2 溶液配制
2.2.1 磷酸盐缓冲液(PBS)配制[9] 精密称取Na2HPO4·12H2O(分析纯)38.81 g和KH2PO4(分析纯)2.72 g,加入蒸馏水配制成500 mL浓度为0.2 mol/L的磷酸盐缓冲液,使用pH计将溶液pH值调至7.5。
2.2.2 黄嘌呤氧化酶(XO)溶液配制 精密称取黄嘌呤氧化酶(9.8 U/mg)1.96 U,为 2mg,加入PBS(pH=7.5)稀释至1.96 mL,即得 10U/mL的黄嘌呤氧化酶母液,将母液分装至4管EP管中,放置-20 ℃冰箱保存。用时取一管,吸取0.1 mL黄嘌呤氧化酶液,加入PBS稀释至5 mL,得0.2 U/mL的黄嘌呤氧化酶液。
2.2.3 黄嘌呤溶液配制 精密称取氢氧化钠0.006 g,加入0.8 mL蒸馏水溶解,得到氢氧化钠溶液,再加入精密称取的黄嘌呤0.0057 g,即为黄嘌呤氢氧化钠溶解液(a液)。精密称取磷酸二氢钾0.027 g,用1 mL蒸馏水溶解,获得磷酸二氢钾液(b液)。将a液、b液混合后,加蒸馏水稀释至4 mL,再用PBS(pH=7.5)稀释至10 mL,得到3.75 mmol/L的黄嘌呤母液,然后放置4 ℃冰箱保存。使用时精密量取1 mL,加入PBS液(pH=7.5)稀释至3.75 mL,即得到1 mmol/L的黄嘌呤液。
2.2.4 别嘌呤醇溶液配制 精密称量2 mg别嘌呤醇,用PBS(pH=7.5)100 mL溶解,配制成浓度为20 μg/mL的别嘌呤醇母液备用,放置4 ℃冰箱保存。
2.2.5 TFCAP醇提物溶液配制 精密称取TFCAP醇提物10 mg,加入5 mL PBS(pH=7.5)溶解,得2 mg/mL的样品溶液,使用时梯度稀释。
2.2.6 TFCAP水提物溶液配制 精密称取TFCAP水提物10 mg,加入5 mL PBS(pH=7.5)溶解,得2 mg/mL的样品溶液,使用时梯度稀释。
2.2.7 标准品溶液配制 分别称取2 mg虎杖苷、熊果酸和秦皮甲素,各加入1 mL DMSO溶液溶解,得浓度为1 mg/mL的标准品母液,使用时梯度稀释。
2.3 黄嘌呤氧化酶抑制活性检测 将PBS、黄嘌呤液、别嘌呤醇液、不同浓度的TFCAP醇提物溶液或水提物溶液或标准品、黄嘌呤氧化酶液依次加入96孔板中,每组设置三个复孔,使用酶标仪在292 nm[10]下连续检测10 min,每分钟读数一次,测定吸收度A与时间的变化,作线性回归处理,以(dA/dt)作为酶反应速率,计算样品对黄嘌呤氧化酶的半数抑制浓度IC50。
2.4 TFCAP醇提物细胞毒性检测 使用cck8试剂盒对人大肠癌细胞(HCT116)、人宫颈癌细胞(Hela)、人肌肉横纹肌瘤细胞(RD)、人近端肾小管上皮细胞(HKC)、非洲绿猴肾细胞(Vero)五类细胞进行体外细胞毒性检测,以药物浓度作为横坐标,细胞抑制率作为纵坐标进行分析,并计算TFCAP醇提物对各细胞的半数抑制浓度CC50。
2.5 TFCAP高效液相色谱分析
2.5.1 流动相配置 甲醇使用 0.45 μm的一次性水系滤膜过滤,流动相使用前进行10~30 min超声脱气。
2.5.2 对照品溶液制备 精密称取虎杖苷2 mg,置于10 mL量瓶中,加甲醇定容搖匀,配成0.2mg/mL对照品溶液,超声处理40 min,使用0.45 μm微孔滤膜过滤,得对照品溶液。
2.5.3 供试品溶液制备 精密称取1mg TFCAP乙醇提取物,加入1 mL甲醇溶解,配成1 mg/mL供试品溶液,超声处理40 min,使用0.45 μm微孔滤膜过滤,得供试品溶液。
2.5.4 色谱条件 色谱柱:Hypersil BOS C18(250 mm×4.6 mm);流动相:A水,B甲醇;流速:0.4mL/min;分析时间:75 min;进样体积:20μL;柱温:30 ℃;梯度条件:0~15 min,B:5%~10%;15~45 min,B:10%~60%;45~55 min,B:60%~85%,55~65 min,B:85%~100%;65~75 min,B:100%;检测波长:254 nm。
2.6 统计学分析 通过prism、SPSS软件对数据进行统计学处理分析,数据结果用均数加减标准差(x±s)表示,多组之间两两比较采用组间t检验,P<0.05为差异具有统计学意义。
3 结果与分析
3.1 黄嘌呤氧化酶活性评价模型的建立和应用
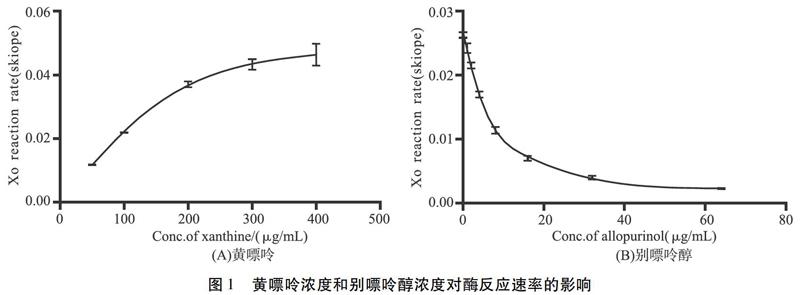
3.1.1 模型建立和验证 反应体系中酶和底物的完全反应浓度比值未知,因此需要对酶和底物的浓度进行探索。固定酶的浓度(0.04 U/mol),测定酶在不同浓度的底物条件下的反应速率,选定合适的底物浓度,然后使用典型的黄嘌呤氧化酶抑制剂别嘌呤醇作为阳性药物加入至模型中检测酶活性评价是否真实有效。如图1(A)所示,底物浓度在50~200 μg/mL范围时,酶的反应速率与底物浓度呈明显的剂量依赖,差异有统计学意义(P<0.05),而底物浓度大于200 μg/mL后,酶反应速率的提升趋于缓慢,说明底物趋于饱和,没有发挥酶的最大效率,因此选择200 μg/mL作为后续活性评价模型中的黄嘌呤底物浓度。图1(B)结果显示,酶的反应速率代表酶的活性,随别嘌呤醇浓度的增加活性显著降低(P<0.05),抑制曲线明显,证明评价模型有效。
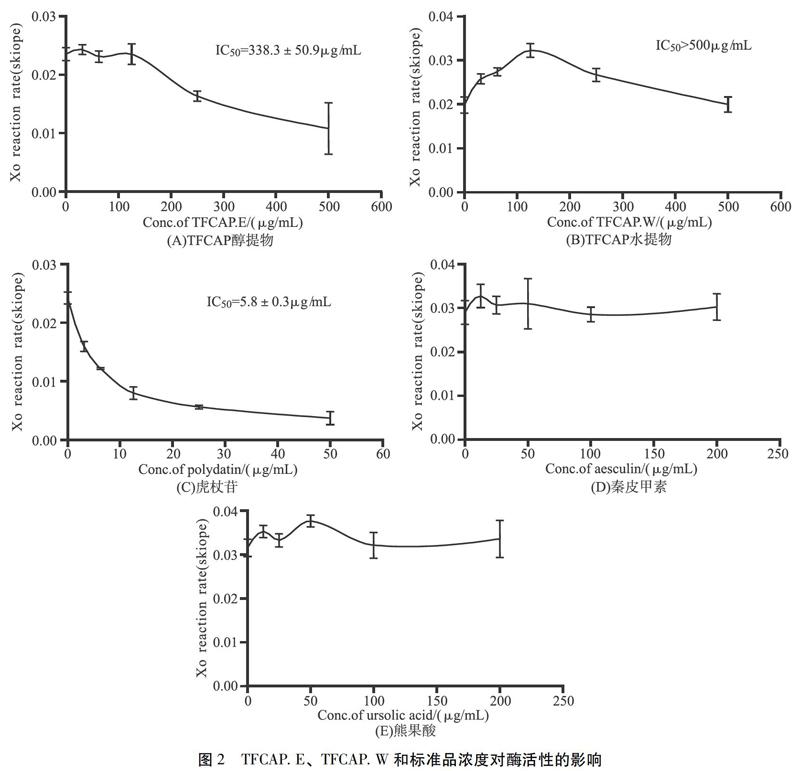
3.1.2 样品检测结果 用前述建立的黄嘌呤活性评价模型对TFCAP醇提物、TFCAP水提物、主要成分标准品进行活性检测,结果如图2所示,在TFCAP醇提物0、31.25 μg/mL、62.5 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL[KG*4]6个浓度下,浓度大于125μg/mL时,随着浓度的增加,酶的反应速率逐渐降低(P<0.05),表现出对酶的抑制活性,有较好的量效关系,计算TFCAP醇提物对黄嘌呤氧化酶的半数抑制浓度IC50为(338.3±50.9)μg/mL。TFCAP水提物500 μg/mL浓度内与不加药对比未表现降尿酸作用(P<0.05),因此采用醇提物进行后续分析。同时对三种主要成分标准品进行活性检测,结果表明,只有虎杖苷表现出黄嘌呤氧化酶抑制活性(P<0.05),测定IC50为(5.8±0.3)μg/mL,因此推断TFCAP醇提物中起酶抑制作用的主要活性成分可能为虎杖苷。
3.2 体外细胞毒性检测 体外条件下,使用抑制活性较高的TFCAP醇提物对HCT116、Hela、RD、Vero、HKC细胞进行24h梯度浓度药物处理后使用cck-8试剂盒进行毒性检测,结果如图4所示。TFCAP醇提物对五种细胞用0.5 mg/mL以下浓度处理时毒性没有明显差异(P>0.05),在1~2mg/mL浓度范围时毒性明显增加,有显著性差异(P<0.05)对细胞的杀伤作用与醇提物的浓度呈正相关。对HCT116、Hela、RD、Vero和HKC细胞的半数抑制浓度和治疗指数TI值见表1,计算结果表明TFCAP醇提物具有较好的安全性。
3.3 TFCAP醇提物和虎杖苷对照品HPLC指纹图谱 前文提及TFCAP醇提物中起酶抑制作用的主要活性成分可能为虎杖苷,故进一步对TFCAP醇提物和虎杖苷标准品进行HPLC分析,建立TFCAP醇提物的HOLC指纹图谱,色谱图结果如图4所示,相同色谱条件下,TFCAP醇提物和虎杖苷均在保留时间t=43.2 min,254 nm处有吸收峰,进一步验证TFCAP醇提物中含有虎杖苷起抑制黄嘌呤氧化酶的作用,同时也为TFCAP的质量控制提供依据。
4 讨论
痛风是常见多发的代谢性疾病,现有的西药种类少,临床使用副作用大,患者依从性差,而新药的研发成本高、耗时长、风险大,相比之下中药具有安全性高、来源广、国内患者易接受等优势。大量研究也证明很多中草药含有的黄酮、皂苷、生物碱等活性成分有显著的降尿酸作用[11],常用中药黄柏、金银花、葛根、菊花、黄芪、土茯苓、车前子、虎杖、高良姜、吴茱萸、红花、丹参、姜黄、木瓜、七叶莲、甘草、大黄等某些提取成分能起到抑制黄嘌呤氧化酶活性的作用[12]。许多传统民族药方和地方中成药具有良好的降尿酸疗效而未被挖掘出来,因此寻找确有疗效的中药成分或民族药方在痛风治疗上极具潜力和研究前景。
尿酸生成增多和排泄减少是尿酸含量增加的主要途径。导致尿酸排泄减少的具体发病机制目前仍不清楚,与多基因遗传病相关,肾脏内介导尿酸重吸收和分泌的尿酸转运蛋白是促尿酸排泄药物的主要研究靶点,其中尿酸盐阴离子转运蛋白1(URAT1)是研究的热门,萆薢总皂苷可以通过抑制高尿酸血症大鼠肾脏URAT1表达而减少尿酸重吸收[13]。秦盾祛痛风胶囊是否也存在URAT1抑制活性还需未来通过动物模型进行研究。
秦盾祛痛风胶囊主要含有秦皮、盾翅藤、虎杖、肾茶等成分。侯建平等[14]研究证明虎杖提取物在大鼠高尿酸血症模型中有降尿酸作用,能抑制黄嘌呤氧化酶活性。吴杲等[15]研究表示虎杖苷可抑制URAT1的mRNA表达,增加尿酸分泌转运蛋白OAT1、OAT3的mRNA表达,增强肾脏对尿酸的排泄作用。
中药提取一般采取乙醇或纯水提取,本研究中秦盾祛痛风胶囊水提物在500 μg/mL的高浓度下和未加药组对比依旧未表现降低尿酸的作用,而是在低浓度促进,高浓度再缓慢抑制尿酸生成,具体机制还待后续探讨,因此本实验主要研究了醇提物的活性机制。此外黄嘌呤氧化酶活性检测有紫外分光光度法、NBT/MTS-PMS比色法、電化学法、放射化学法和色谱法等[18],本研究采用紫外分光光度法检测292 nm下生成尿酸的吸光度值来建立黄嘌呤氧化酶活性评价模型,有报道称许多天然药物中含有在292 nm下有吸收的化合物[16],采用终点法检测会影响尿酸的吸光度,因此本实验使用连续动力学测定,每分钟检测一次连续检测10min来消除药物中原有的292 nm吸光度值影响。
秦盾祛痛风胶囊醇提物在体外检测中表现了较好的黄嘌呤氧化酶抑制活性,IC50为(338.3±50.9)μg/mL,虎杖苷标准品IC50为(5.8±0.3)μg/mL,结合HPLC色谱分析,推断其主要活性成分为虎杖苷,具体的成分含量还有待后续HPLC方法学考察。同时使用该药对多种细胞进行了体外细胞毒性检测,CC50/IC50在4.5~6.5之间,说明具有较好的安全性。但是活性和毒性检测均在体外进行,对其详细的疗效和安全性研究还需进一步的动物实验或临床观察进行验证。
参考文献
[1]曾小峰,陈耀龙.2016中国痛风诊疗指南[J]. 浙江医学,2017,39(21):1823-1832.
[2]原发性痛风诊治指南(草案)[J]. 中华风湿病学杂志,2004(3):178-181.
[3]展鹏,刘涛,刘新泳. 以黄嘌呤氧化酶为靶点的新型非嘌嘌呤类抗痛风及高尿酸血症药物研究进展[J].中国药物化学杂志,2012,22(5):403-415.
[4]BACEVIC M,BRKOVIC B,ALBERT A,et al. Does oxidative stress play a role in altered chara-cteristics of diabetic bone A systematic review[J]. Calcifiedtissue Int,2017,101(6):553-563.
[5]杨媛,李静,甄健存,等. 抗痛风药别嘌呤醇、苯溴马隆及秋水仙碱不良反应报告分析[J].中国医院药学杂志,2013,33(15):1296-1297.
[6]PASCHOU E,GAVRIILAKI E,PAPAIOANNOU G,et al. Febuxostat hypersensitivity: another cause of DRESS syndrome in chronic kidney disease[J]. European Annals of Allergy and Clinical Immunology,2016,48(6):251-255.
[7]石云,王晓妃. 尿酸消胶囊微生物限度检查法的建立和验证[J]. 中国医院用药评价与分析,2018,18(7):928-930.
[8]罗六保,谢志鹏. 紫外分光光度法测定中药中黄嘌呤氧化酶抑制活性研究[J]. 化学世界,2009,50(5):273-275,270.
[9]林伟青. Eupatilin对黄嘌呤氧化酶活性抑制的实验研究[C].//江西省第十一次中西医结合活血化瘀学术年会论文集. 江西省中西医结合学会活血化瘀专业委员会,2015:5.
[10]VALENTAO P,FERNANDES E,CARVALHO F,et al. Antioxidant activity of centaurium erythraea infusionevidenced by its superoxide badical scavenging and xanthine oxidase inhibitory activity[J]. J Agric FoodChem,2001,49(7):3476-3479.
[11]周潔,孙超,李飞. 中药活性成分降尿酸作用机制研究进展[J]. 中国药理学通报,2018,34(1):19-22.
[12]王爱华,金玥,吴越,等. 具有黄嘌呤氧化酶抑制作用的中药及中成药治疗高尿酸血症研究进展[J]. 天津中医药,2019,36(12):1241-1245.
[13]陈光亮,朱立然,那莎,等. 萆薢总皂苷对大鼠慢性高尿酸血症和肾小管尿酸转运体1表达的影响[J]. 中国中药杂志,2013,38(14):2348-2353.
[14]侯建平,王亚军,严亚峰,等.虎杖提取物抗动物高尿酸血症的实验研究[J].西部中医药,2012,25(5):21-24.
[15]吴杲,吴汉斌,蒋红. 虎杖苷的降尿酸作用及其机制研究[J]. 药学学报,2014,49(12):1739-1742.
[16]罗六保,谢志鹏. 紫外分光光度法测定中药中黄嘌呤氧化酶抑制活性研究[J].化学世界,2009,50(5):273-275.
(收稿日期:2020-12-03 编辑:程鹏飞)

