SOE-PCR法构建新型PHA嵌合酶研究
赵小慧,张卉妍,胡风庆*
(1.辽宁省经济作物研究所,辽宁 辽阳 111000;2.辽宁大学 轻型产业学院,辽宁 沈阳 110036)
聚羟基脂肪酸酯(Polyhydroxyalkanonate,PHA)是很多微生物在碳源充足,氮源缺乏状态下产生的一类颗粒状可作为生物体内碳源和能量储备物的高分子生物聚酯[1,2].PHA因具有生物可降解性、气体相隔性、生物相容性等许多优秀性能[3-6],从而应用在可降解包装材料、医药行业及组织工程等众多领域[7-11].
PHA合酶是PHA合成过程中的关键酶,它的活性和底物特异性决定着PHA的含量和组成[12].对PHA合酶进行基因工程改造获得有益基因可增加PHA产量、改变单体组成和降低生产成本,其中构建嵌合酶是创造新酶、改变PHA单体组成的一种有效方式.Matsumoto等[13]构建了由26%的富养产碱菌(R.eutropha)PhaCAcN端和74%的豚鼠气单胞菌(A.caviae)PhaCReC端嵌合成的AcRe12,在E.coliLS5218表达,当以月桂酸为碳源时,产生了比亲本含量高的PHA,且产生了新的组分HO,并降低了PHA的分子量.随后,Sun等[14]做了进一步研究,把AcRe12在富养产碱菌(R.eutropha)和恶臭假单胞菌(P.putida)中表达,以月桂酸为原料,均产生了新的组分HO,且在P.putidaGpP104还发现了微量的HD.嵌合酶由于融合了两个或者更多的酶,因而能表现出亲本酶的特性.应用嵌合PHA合酶可以改变其底物的广泛性,有效提高PHA产量从而从根本上降低生产成本,并产生新类型的PHA,以使它的物理化学性质更加接近化学合成的塑料以适应对不同性能PHA的不同的需求,开发PHA的新的用途[15].
实验以嗜水气单胞菌PHA合酶(PhaCAh)和富氧产碱菌PHA合酶(PhaCRe)为亲本,利用数据库对二级结构进行预测,找到两个酶合适的嵌合位点,利用SOE-PCR构建新型嵌合酶PhaCAhRe,以产生新型的PHA.
1 实验材料与试剂
1.1 实验菌株
所用菌株包括:嗜水气单胞菌WQ,富氧产碱菌H16,大肠杆菌S17-1,富氧产碱菌PHB-4[16],均由本实验室保存.
1.2 主要试剂与酶
葡萄糖(Glucose)、果糖(fructose)、月桂酸(Lauric acid),沈阳禹王试剂公司;葡萄糖酸钠(Gluconate)、油酸(Oleic acid)、乳糖(Lactose),生工;
DNA聚合酶、PrimeSTAR HS DNA Polymerase、T4 DNA连接酶、限制性内切酶、蛋白酶K,以上均来自TaKaRa公司;RNA酶、溶菌酶,来自生工生物工程(上海)股份有限公司.
1.3 主要实验仪器和设备
DL-6M大容量冰冻离心机(长沙湘仪离心机仪器有限公司);气相色谱仪Agilent 7890A(美国Agilent);GeneAmp PCR system 9700(SINGAPORE);Dolphin-Doc凝胶成像系统(WEALTEC).
1.4 常用培养基
实验所用LB培养基、矿物盐培养基的配制根据文献[17].
2 实验方法
2.1 PHA合酶基因扩增
基因组提取参照《分子克隆实验指南》[18],目的片段PCR扩增方法参考文献[19],PCR产物回收采用AxyPrep DNA Gel Extraction Kit.
PHA嵌合基因SOE-PCR扩增条件为98 ℃预变性2 min,95 ℃变性45 s,56 ℃退火15 s,72 ℃延伸2 min,35个循环,72 ℃充分延伸10 min,PCR产物4 ℃保存.
2.2 PHA合酶分析方法
为获得有活性的、能产生新型PHA的嵌合PHA合酶,必须选择合适的结合位点,既不破坏蛋白正常构象,保证蛋白的正确折叠,又能产生新的变化,产生新的种类.为了不破坏蛋白的正确构象,需要对蛋白的结构进行预测.由于PHA合酶蛋白的晶体接够目前还未获得,对其高级结构的预测无从下手,对其二级结构进行预测在一定程度上提供保证.用Predtor、GOR4、SOPMA三种在线二级结构预测软件对A.hydrophilaWQ PHA合酶(PhaCAh)和R.eutrophaPHA合酶(PhaCRe)的二级结构进行预测.为保证嵌合的正确性,需要进一步对序列进行同源分析.故结合生物分析软件Vector NTI 6.0序列比对结果找到两个酶的合适的结合位点.
2.3 质粒构建
PCR扩增获得的合酶基因切胶回收,经HindⅢ和EcoRI双酶切,插入pBBR1MCS2中,T4连接酶16℃过夜连接.取10 μl连接反应液电转化大肠杆菌S17-1,37 ℃培养过夜,挑取阳性克隆进行鉴定,获得重组质粒.将重组质粒通过结合转化转入PHA缺失突变株PHB-4中,获得重组菌.
2.4 PHA合酶/嵌合酶功能验证
将含有质粒的R.eutrophaPHB-4重组菌采用两步培养法,先用牙签挑取单菌落于10 mL LB中过夜培养,待种子液长好,再转接入100 mL组分(体积)比例为5∶93.5∶1∶0.1矿物盐培养基中,添加相应抗生素,在30 ℃条件下,200 rpm培养72 h,8 000 rpm离心10 min收集菌体,水洗一次,醇洗一次,冷冻干燥至恒重,称重并称取50 mg酯化进行气相色谱分析,同时设定对照组,每个样三个平行.
2.5 菌体干重及PHA含量计算
2.5.1 菌体干重
8 000 rpm离心10 min,收集菌体,并用蒸馏水和95%乙醇洗涤菌体2~3次,离心收集菌体,经冷冻干燥,获得干菌体,并称重.
2.5.2 PHA含量分析
PHA含量通过气相色谱法测定[16],PHA含量计算公式如下:

标样质量=10 mg
3 结果与讨论
3.1 PHA合酶基因克隆
根据文献[19],从NCBI中获得A.hydrophilaWQ序列,并以此序列设计引物AH1(5′-GCTAAGCTTCTAATGAGCCAACCATCTTAT-3′)和AH2(5′-TTTGAATTCTCATGCGGCGTCCT-3′),PCR扩增得到phaCAh,测序结果与发表序列一致.
根据NCBI中的R.eutrophaH16phaCRe的序列,设计带有HindIII和EcoRI酶切位点的引物RH1(5′-GATAAGCTTCTAATGGCGACCGGCAAAGG-3′)和RH2(5′-TACGAATTCTCATGCCTTGGCTTTGACGT-3′),以R.eutropha基因组为模板,PCR扩增获得phaCRe,测序结果与发表序列一致.
3.2 二级结构预测寻找嵌合酶结合位点
3.2.1 PhaCAh和PhaCRe二级结构预测
无规卷曲作为分子中间的连接肽,结构比较松散,相互作用比较小,围绕单键转动阻力极小,因此不具独特的三维结构和最适构象,适合作为连接区.
3.2.2 序列比对及结合位点选择
二级结构预测出来的无规卷曲区表明这段序列可能适合作为结合区,为保证嵌合的正确性,需要进一步对序列进行同源分析.采用生物分析软件Vector NTI 6.0对两个酶进行序列比对,通过序列比对和二级结构预测,寻找到R.eutropha第159位氨基酸和A.hydrophila第154位氨基酸适合作为结合位点.
3.3 嵌合基因SOE-PCR扩增
以pBBR1MCS2-phaCAh为模板,AH1和AH3(5′-GCAAGGAAGTTGGTGGCCAGGAAGT-3′)为引物,PCR获得ΔphaCAh,大小为462 bp,切胶回收DNA备用.
以pBBR1MCS2-phaCRe为模板,利用引物RH2和RH3(5′-AACTTCCTTGCCACCAATCCC-3′)得到ΔphaCRe,大小为1296 bp.切胶回收DNA备用.
以回收的ΔphaCAh和ΔphaCRe为模板,以引物AH3和RH3中的相同部分为互补末端,AH1和RH2为引物,经重叠延伸剪接技术(SOE-PCR)扩增得到嵌合基因phaCAhRe,大小为1758 bp.
3.4 PHA合酶/嵌合酶功能验证
3.4.1 重组菌R.eutrophaPHB-4-AH PHA合酶功能验证
将含有质粒的重组菌R.eutrophaPHB-4-AH采用两步培养法后通过气相色谱分析,重组菌R.eutrophaPHB-4-AH所产PHA的分子组成及含量的结果见表1.
如表1所示,当以乳糖和葡萄糖为单一碳源时,重组菌不生长,以其他为碳源时均能生长;当以葡萄糖酸钠和果糖为单一碳源时,细胞干重很大,最高达8.525 g/L,但是只产生了3HB一种单体,而在其他碳源中发酵时均产生3HB和3HHx两种单体.其中,以辛酸钠和葡萄糖酸钠混合碳源发酵时菌体生长最好,达4.68 g/L,PHA也产量最高,占细胞干重的79.68%.辛酸钠为单一碳源时细胞干重最少,相对应的PHA含量也最少,其余介于二者之间.辛酸钠为唯一碳源时两种单体组中HHx含量为4种碳源之中最多的.
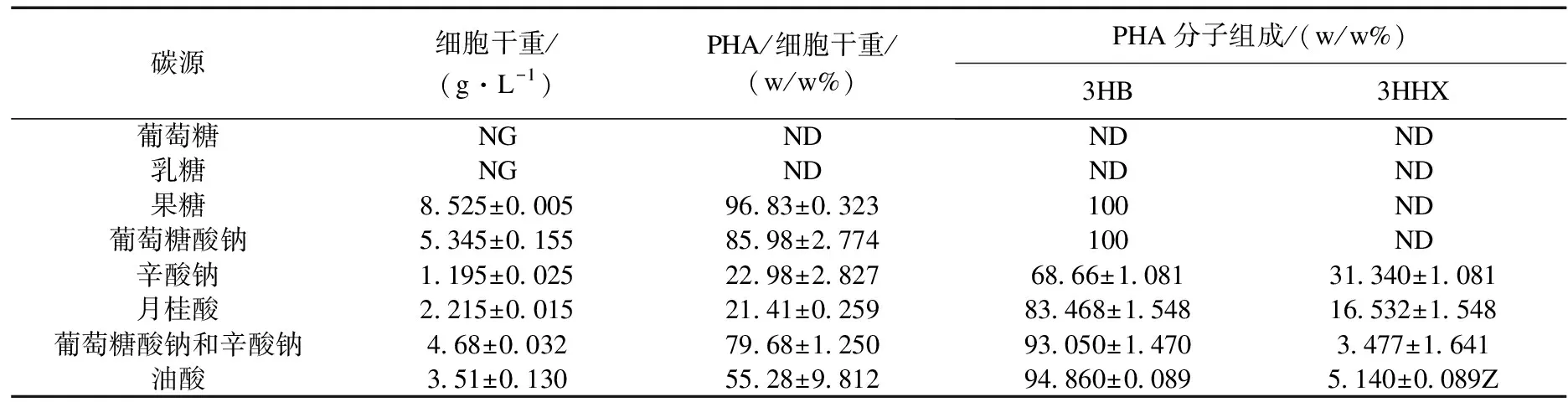
表1 重组菌R.eutropha PHB-4-AH利用不同碳源发酵生产PHA的含量及单体组成
3.4.2 重组菌R.eutrophaPHB-4-RE PHA合酶功能验证
将含有质粒的重组菌R.eutrophaPHB-4-RE采用两步培养法后通过气相色谱分析,其所产PHA的分子组成及含量的结果见表2.
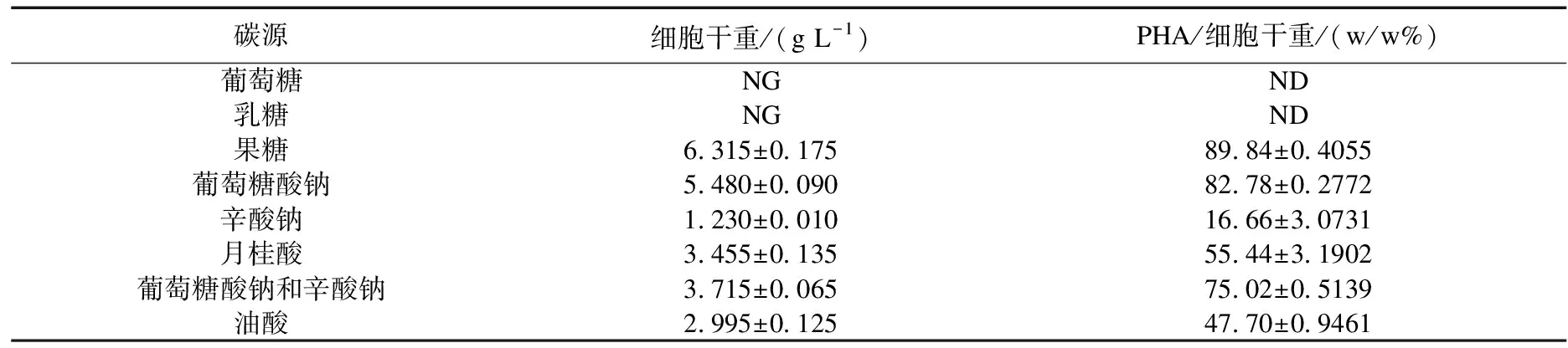
表2 重组菌R.eutropha PHB-4-RE利用不同碳源发酵生产PHA的含量及单体组成
如表2所示,以葡萄糖和乳糖为碳源时,重组菌RE与重组菌AH一样不生长,以其他碳源生长时重组菌只产生HB一种单体.以果糖为碳源时菌体生长状态最好,细胞干重达6.315 g/L,PHA也产量最高,占细胞干重的89.84%;以辛酸钠为碳源时重组菌生长不好,细胞干重仅为1.230 g/L,PHA含量也仅为16.66%,其他碳源介于这两者之间.
3.4.3 嵌合酶功能验证
将含有质粒的重组菌R.eutrophaPHB-4-AHRE采用两步培养法后通过气相色谱分析,其所产PHA的分子组成及含量的结果见表3.
由表3可以得出,当以乳糖和葡萄糖为碳源时,重组菌不生长,而其他碳源均能生长.且当以葡萄糖酸钠和果糖为碳源时,细胞干重很大,最高达8.020 g/L,PHA含量也最高,最高占细胞干重的91.72%,但是只产生3HB.而其他碳源均产生3HB、3HHx和3HO.其中,以月桂酸为碳源发酵时菌体生长最好,细胞干重为5.595 g/L.以葡萄糖酸钠和辛酸钠混合碳源发酵时,PHA产量最高,占细胞干重的57.54%.以辛酸钠为单一碳源细胞干重最少,产生的PHA含量也最少,其余介于二者之间.辛酸钠为唯一碳源时新的单体组成3HO含量最高,占PHA总量的1.932%,证明表达质粒构建成功且嵌合酶具有合成PHA的功能.

表3 重组菌R.eutropha PHB-4-AHRE利用不同碳源发酵生产PHA的含量及单体组成
综上,利用PCR技术,分别从A.hydrophilaWQ和R.eutropha获得PHA合酶基因.采用Predtor、GOR4、SOPMA三种方法对两亲本PHA合酶进行二级结构预测,获得两个亲本酶的无规卷曲区域,同时,利用生物分析软件Vector NTI 6.0对两个酶进行序列比对,获得保守区域,二者结合,获得嵌合酶结合位点.利用SOE-PCR技术,以亲本质粒pBBR1MCS2-phaCAh和pBBR1MCS2-phaCRe为模板,获得嵌合基因phaCAhRe,经双酶切与载体pBBR1MCS2连接,获得重组质粒pBBR1MCS2-phaCAhRe,酶切测序正确,结合转化入R.eutrophaPHB-4,获得重组菌R.eutrophaPHB-4-AHRE.结果显示,当以乳糖和葡萄糖为碳源时,重组菌不生长,而其他碳源均能生长.且当以葡糖糖酸钠和果糖为碳源时,细胞干重很大,最高达8.020 g/L,PHA含量也最高,最高占细胞干重的91.72%,但是只产生3HB.在以辛酸钠、月桂酸、油酸、辛酸钠和葡萄糖酸钠混合物为碳源时,与对照,除了产生3HB和3HHX,还产生了新的组分3HO,其中以月桂酸为碳源发酵时菌体生长最好,细胞干重为5.595 g/L.以葡萄糖酸钠和辛酸钠混合碳源发酵时,PHA产量最高,占细胞干重的57.54%.以辛酸钠为单一碳源细胞干重最少产生的PHA含量也最少,其余介于二者之间.辛酸钠为唯一碳源时新的单体组成3HO含量最高,占PHA总量的1.932%.在构建PHA嵌合酶的研究中,与嵌合石油假单胞菌和富氧产碱菌PHA合酶基因相比,本研究的重组菌在不同碳源中产生的PHA 产量相对较高,且除了产生相同组分3HB与3HO,还产生了新组分3HHx.与起皱假单胞菌和恶臭假单胞菌PHA合酶基因嵌合相比,本实验重组菌能在更多不同碳源中生长并产生不同组分.这充分表明本研究新的PHA嵌合酶构建成功,获得了新型PHA,为今后利用基因工程技术解决菌株PHA单体组成单一提供了具体有效的方法,为获得具有更好材料学特性的PHA奠定了工作基础,对PHA嵌合酶的研究及PHA生产利用具有现实意义.

