人参叶中高产皂苷菌种的筛选及培养条件优化
冯 颖,陶 亮,2,肖学爱,2,赵存朝,2,李 畅,2,田 洋,2,3*
(1.云南农业大学 食品科学技术学院,云南 昆明 650201;2.食药同源资源开发与利用教育部工程研究中心,云南 昆明 650201;3.国家辣木加工技术中心,云南 昆明 650201)
人参(Panax ginseng)为五加科人参属植物,作为滋补珍品已有几千年的历史。现代医学证明人参具有诸多生物活性功能[1],不仅抗癌、抗衰老、抗氧化[2],还有效改善机体的免疫调节系统[3]。人参的主要活性成分为人参皂苷,具有抗肿瘤、抗疲劳[4]、延缓衰老、调节中枢神经、提高机体免疫力、改善心脑血管供血不足等作用[5]。现代研究表明,人参叶与人参具有相似的化学成分[6],人参茎叶中含有大量的茎叶皂苷(约7%~16%),其药理活性也与人参根类似[7]。如果人参叶中的人参皂苷能被充分的利用,不仅能避免了人参叶的浪费,同时也变废为宝,为人参皂苷的开发开辟了另一条新途径。
传统的人参皂苷提取方法有热水浸提法[8]、煎煮、浸渍法、超临界辅助提取法等[9]。近年来,新的提取方法不断的应用于人参皂苷提取的研究中,目前,微生物发酵技术用于人参叶皂苷的提取研究鲜见报道。微生物发酵技术主要是利用微生物在生长代谢过程中分泌的各种生物酶类,破坏植物细胞的结构,使活性成分能够较大程度溶出,提高提取效率[10]。研究表明,人参作为药食两用植物,经过发酵,可以使原有的药性发生变化,产生新的人参皂苷或提高人参稀有皂苷的含量,从而提高人参的药用价值[11],比如增强或产生新的功效,降低药物毒性等。本研究以吉林不同产地(长白山、通化市榆林镇及白山市抚松县)人参叶为发酵基质,对发酵高产人参皂苷的菌株进行了筛选,并对发酵条件及发酵培养基进行优化,旨在提高发酵后的人参皂苷含量,拓宽人参叶利用范围,为人参叶发酵生产人参皂苷提供理论基础和数据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
人参叶:分别采购于吉林长白山、吉林通化市榆林镇及吉林怀化白山抚松县;嗜酸乳杆菌(Lactobacillu acidophilus)CICC 20710、克鲁维毕赤酵母(Pichia kluyveri)CICC 32845、酿酒酵母(Saccharomyces cerevisiae)CICC 31393、酿酒酵母(Saccharomyces cerevisiae)GIM 2.43、罗伊氏乳杆菌(Lactobacillus reuteri)CICC 6226、植物乳杆菌(Lactobacillus plantarum)BNCC 194165:中国工业微生物菌种保藏中心。
1.1.2 化学试剂
高氯酸(分析纯):天津市鑫源化工有限公司;葡萄糖、果糖(均为分析纯):山东西王生化科技有限公司;蔗糖、乳糖(均为分析纯):安徽金禾实业股份有限公司;柠檬酸(分析纯):昆山荣之誉精细化工有限公司;醋酸、丙酮酸(均为分析纯):广州市鸿胤生物科技有限公司;酵母粉、蛋白胨、牛肉膏(均为生化试剂):北京市奥博星生物技术有限责任公司;人参皂苷Re标准品(纯度≥98%):上海经科化学科技有限公司。
1.1.3 培养基
营养肉汤培养基、MRS肉汤培养基:北京市奥博星生物技术有限责任公司。
1.2 仪器与设备
YXQ-LS-100SII立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;HH-4数显恒温水浴锅:金坛市城东新瑞仪器厂;UV-5100紫外可见分光光度计:上海元析仪器有限公司;HPX-9272ME恒温培养箱:上海博讯实业有限公司。
1.3 方法
1.3.1 样品处理
选用三组不同的新鲜人参叶(A:吉林省长白山;B:通化市榆林镇;C:白山市抚松县),流水洗去表面杂质,于60 ℃恒温干燥箱中烘干,粉碎后过60目筛,得人参叶粉,并储存于低温、避光、干燥的环境中,备用。
1.3.2 菌种筛选
乳杆菌及酵母菌均能通过发酵有效的释放出人参皂苷,本实验供试六种菌种,分别是三种乳杆菌[嗜酸乳杆菌(Lactobacillu acidophilus)CICC 20710、罗伊氏乳杆菌(Lactobacillus reuteri)CICC 6226、植物乳杆菌(Lactobacillus plantarum)BNCC 194165]及三种酵母菌[克鲁维毕赤酵母(Pichia kluyveri)CICC 32845、酿酒酵母(Saccharomyces cerevisiae)CICC 31393、酿酒酵母(Saccharomyces cerevisiae)GIM 2.43]。
菌种活化培养:取酵母菌菌株CICC 31393、CICC 32845、GIM2.43分别接种于200 mL灭菌营养肉汤培养基中,在恒温培养箱中28 ℃培养24 h得到第一代菌悬液。按12%的接种量将一代菌悬液接种于营养肉汤培养基中,28 ℃恒温培养18 h得第二代菌悬液。重复上述步骤28 ℃恒温培养12 h,进行第三次活化得到第三代活化菌悬液,即为实验用菌液,4 ℃冰箱储存,备用。
1.3.3 分析检测
人参皂苷Re标准曲线的绘制:参照万玉华等[12]的方法略作修改。用电子天平精密称取人参皂苷Re标准品1.5 mg,置10 mL试管中,利用移液枪精确移取6 mL甲醇,使之充分溶解,得到质量浓度为0.25 mg/mL的Re标准品溶液。分别取50 μL、100 μL、200 μL、300 μL、400 μL、500 μL、600 μL、700 μL Re标准品溶液于10 mL具塞试管中,75 ℃水浴蒸干,分别加入0.2 mL 5%香草醛-冰乙酸溶液,再加入0.8 mL高氯酸,在60 ℃水浴加热15 min,迅速用冰水冷却5 min,加入5 mL冰乙酸,漩涡仪振荡摇匀,同时做空白对照。以1 cm比色皿在560 nm波长条件下测定其吸光度值[13]。以人参皂苷Re标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制人参皂苷Re标准曲线,得到标准曲线回归方程为y=0.004 8x-0.010 4,相关系数R2为0.998 2。
样品人参皂苷含量测定[14]:准确称取冷冻干燥后的发酵人参叶粉1.5 mg,置10 mL试管中,加入6 mL甲醇,溶解,得到质量浓度为0.25 mg/mL样品溶液。取500 μL、600 μL、700 μL样品溶液,置于10 mL带塞试管中,在恒温水浴锅中75 ℃水浴蒸干,加入0.2 mL 5%的香草醛冰乙酸溶液,再加入0.8 mL高氯酸,60 ℃水浴加热15 min,冷却5 min,加入5 mL冰乙酸,漩涡仪振荡摇匀,同时做空白对照。以1 cm比色皿于560 nm波长条件下测定其吸光度值。按照人参皂苷Re标准曲线回归方程计算样品中人参皂苷含量。
1.3.4 发酵条件优化
以发酵后的人参叶皂苷含量为评价指标,分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、接种量(0.5%、1.0%、1.5%、2.0%、2.5%)以及初始pH值(4.0、4.5、5.0、5.5、6.0)4个因素对发酵后人参叶皂苷含量的影响,确定最佳发酵条件。
1.3.5 发酵培养基优化
参照李昊然[15]的方法,以发酵后的人参叶皂苷含量为评价指标,考察氮源(蛋白胨、牛肉膏、酵母粉、蛋白胨+酵母粉(1∶1)、蛋白胨+硫酸铵(1∶1))、碳源(葡萄糖、蔗糖、乳糖、果糖、葡萄糖+蔗糖(1∶1)、乳糖+蔗糖(1∶1))、有机酸(醋酸、乳酸、丙酮酸、柠檬酸)及磷盐(磷酸二氢钾、磷酸氢二钾)对人参叶皂苷含量的影响,确定最佳发酵培养基。
1.3.6 发酵前后皂苷含量对比
(1)对照实验
准确称取人参叶粉9 g,按料液比1∶10(g∶mL)加入蒸馏水,离心20 min测定上清液吸光度值。
(2)最优条件下发酵
准确称取人参叶粉9 g,按料液比1∶10(g∶mL)加入蒸馏水,按发酵液体积添加酵母粉+蛋白胨1%、果糖2%、丙酮酸0.14%、磷酸氢二钾0.08%,混匀,得到人参叶发酵液,调节初始pH值为5.0,2组平行实验。于121 ℃灭菌15 min,冷却后按发酵液体积2.0%接种菌株,在30 ℃条件下培养6 d。于50 mL离心管中,4 000 r/min离心20 min,测定上清液吸光度值。
1.3.7 数据处理
通过SPSS22.0软件进行数据分析,应用GraphPad 8.0软件进行作图。
2 结果与分析
2.1 不同菌种发酵对人参皂苷含量的影响
分别选取CICC 20710、CICC 6226、BNCC 194165、CICC 32845、CICC 31393、GIM2.43 六种不同菌种,在自然pH下发酵,研究人参皂苷产量的差异,结果见图1。由图1可知,发酵后人参叶中的皂苷含量均明显增加。这表明微生物发酵能够有效促进人参叶中皂苷含量的增加。同时,不同菌种发酵对人参叶中皂苷的释放是有差异的。酿酒酵母、罗伊氏乳杆菌均能高效的释放出人参叶中的皂苷,但当发酵菌种为酿酒酵母CICC 31393时,人参皂苷含量最高。这可能是由于酿酒酵母CICC 31393能够在人参叶基质上良好共生或相互协同产生丰富的水解酶系,并且酿酒酵母与植物细胞具有很多相同的结构,容易培养,生长周期短,代谢旺盛,能促进人参叶中皂苷的释放。因此,选择酿酒酵母CICC 31393为最佳发酵菌种。
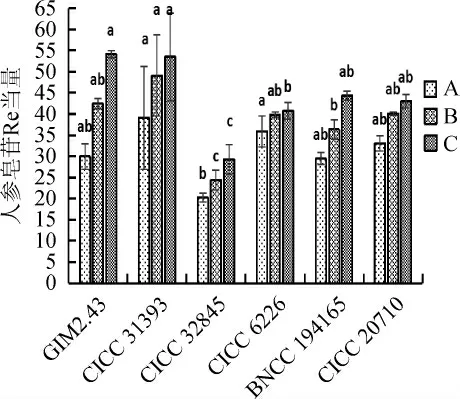
图1 不同菌种的发酵对人参皂苷含量的影响Fig.1 Effect of different strains fermentation on ginsenoside contents
2.2 发酵条件优化
2.2.1 人参叶发酵料液比的筛选
影响微生物发酵的因素很多,料液比会影响底物浓度,进而影响发酵效率。本实验选择不同料液比,考察它们对人参皂苷含量的影响,结果见图2。由图2可知,不同料液比对人参皂苷的含量有明显的差异,随着料液比的增加呈现出先上升后下降的趋势。在料液比为1∶5~1∶10(g∶mL)时,人参皂苷含量逐渐增加;在料液比为1∶10(g∶mL)时,人参皂苷含量最高,为159.73 mg/g;在料液比1∶10~1∶25(g∶mL)时,人参皂苷含量呈下降趋势。这可能是因为料液比过大时,部分人参叶未能与菌种充分接触进行发酵;料液比过小时菌液中溶氧过低菌体不能完全生长繁殖和积累所需的代谢产物,使菌种产酶得能力降低,不能发酵充分[16]。因此,确定最佳料液比为1∶10(g∶mL)。

图2 不同料液比对人参皂苷含量的影响Fig.2 Effect of different material and liquid ratio on ginsenoside contents
2.2.2 发酵温度的筛选
发酵温度是酵母菌正常生理活动的重要因素,适宜的温度有益于酵母菌的生长,可以提高发酵速度,增加人参皂苷含量,以发酵后人参皂苷的含量为标准,分别考察不同发酵温度对人参叶中皂苷含量的影响,结果见图3。

图3 不同发酵温度对人参皂苷含量的影响Fig.3 Effect of different fermentation temperature on ginsenoside contents
由图3可知,不同发酵温度对人参皂苷的含量有显著的差异,人参皂苷的含量随发酵温度在26~34 ℃之间变化,呈先上升后下降的趋势。在发酵温度为26~30 ℃时,人参皂苷的含量逐渐增加;在发酵温度为30 ℃时,人参皂苷的含量最高,为146.96 mg/g;在发酵温度高于30 ℃之后,随着温度逐渐升高,人参皂苷的释放量减少,呈现下降的趋势。这可能是由于温度较低时微生物生长缓慢[17],温度过高又会导致微生物代谢能力下降,活性降低,对微生物的发酵作用产生不利影响[18],导致影响了人参皂苷的最终产量。同时,温度除了直接影响发酵过程中各种反应速率外[19],还影响基质和氧在发酵液的溶氧和传递速率及某些基质的分解吸收速度[20]、生物合成方向等[21]。因此,确定最佳发酵温度为30 ℃。
2.2.3 接种量的筛选
接种量会影响微生物的生长繁殖,从而影响人参皂苷含量。所以适量的接种有利于微生物的生长,以人参皂苷的含量为标准,分别考察不同接种量对人参叶中皂苷含量的影响,结果见图4。由图4可知,不同的接种量对发酵后释放的人参皂苷含量有显著的差异,随着接种量在0.5%~2.5%范围内增加,人参叶中皂苷的含量呈先增加后减少的趋势。接种量为0.5%~2.0%时人参皂苷含量随接种量的增加而上升;接种量为2.0%时皂苷的含量最高;接种量>2.0%之后,皂苷含量随着接种量的增加而降低,这可能由于微生物数量出现过饱和的状态[22],接种量过多,接种量过多导致养分不足,菌的繁殖受到限制[23],代谢缓慢,影响皂苷含量的变化。因此,确定最适接种量为2.0%。

图4 不同接种量对人参皂苷含量的影响Fig.4 Effect of different inoculum on ginsenoside contents
2.2.4 初始pH值的筛选
pH随微生物的变化而变化,因此确定相应的pH值对菌体生长和人参皂苷含量的增加具有重要意义。以人参皂苷的含量为标准,分别考察不同初始pH值对人参叶中皂苷含量的影响,结果见图5。由图5可知,不同的初始pH值对发酵后人参皂苷的含量有显著差异,随着初始pH值在4.0~6.0范围内逐渐增加,人参皂苷的含量呈现先上升后下降的趋势。当初始pH值为4.0~5.0时,人参叶皂苷的含量逐渐增加;当初始pH值为5.0时,人参叶皂苷的含量达到最高值148.35 mg/g;当初始pH值>5.0之后,人参皂苷的含量又呈下降的趋势。pH值是影响发酵液及代谢产物的物理化学性质,初始pH过低或过高均不利于菌体的生长[24]。培养基初始pH对酒酿酵母的生长有一定影响,当初始pH在4.0~5.0范围内酵母生长良好,且在该pH值下酒酿酵母的生长繁殖速度最快。因此,确定最佳初始pH值为5.0。

图5 不同初始pH值对人参皂苷含量的影响Fig.5 Effect of different initial pH value on ginsenoside contents
2.3 发酵培养基的优化
2.3.1 不同氮源对人参皂苷含量的影响
氮源是细胞合成产物的重要物质,数量过少,产物合成不足,数量过多,有可能造成底物抑制,细胞合成酶的数量降低,从而使菌体产酶活性降低[25]。氮源不仅促进发酵初期菌体的生长,而且促进发酵后细胞的生长,并提高人参叶的皂苷含量。本实验选取不同氮源(添加量为1%),在相同发酵条件下,考察它们对人参皂苷含量的影响,结果见图6。

图6 不同氮源对人参皂苷含量的影响Fig.6 Effect of different nitrogen sources on ginsenoside contents
由图6可知,在培养基中加入不同氮源对人参叶释放的皂苷含量影响显著,当牛肉膏、蛋白胨、酵母粉作为单一氮源加入时,人参皂苷的含量没有明显增加,而当蛋白胨+酵母粉按1∶1比例混合添加作为氮源时,人参皂苷含量最高,这可能是因为蛋白胨中富含氨基酸,而且含有更多的维生素和其他能促使菌体生长的营养因子。酵母浸粉中富含蛋白质、氨基酸、维生素B、生长因子、微量元素及其他营养物质,有助于菌体的生长。两者结合能较好的发挥作用,使发酵充分。因此,选用添加量1%蛋白胨+酵母粉(1∶1)作为最适氮源。
2.3.2 不同碳源对人参皂苷含量的影响
在自然界中大多数的微生物都可以利用糖类、油脂、有机酸、氨基酸等有机物作为生长所需碳源,可是微生物的种类及其繁多,不同种的微生物之间生理特性是不同的,所以每种微生物生长所需碳源都不一样。本实验选取不同碳源(添加量为2%),在相同发酵条件下,考察它们对人参皂苷含量的影响,结果见图7。

图7 不同碳源对人参皂苷含量的影响Fig.7 Effect of different carbon sources on ginsenoside contents
由图7可知,不同的碳源对人参叶皂苷的含量均有影响,当葡萄糖、果糖、蔗糖、乳糖作为单一的外源碳源时,人参叶中皂苷的含量要明显高于混合碳源中人参皂苷的含量,而果糖作为单一碳源时,人参皂苷的含量最高,这可能是因为果糖更适合酿酒酵母的代谢利用,促进了菌体繁殖和代谢能力。因此,选用添加量为2%果糖作为最适碳源。
2.3.3 不同有机酸对人参皂苷含量的影响
在本实验中,醋酸、乳酸、丙酮酸和柠檬酸被选为有机能源,按0.14%添加到培养基中[15],在相同发酵条件下,考察它们对人参皂苷含量的影响,结果见图8。
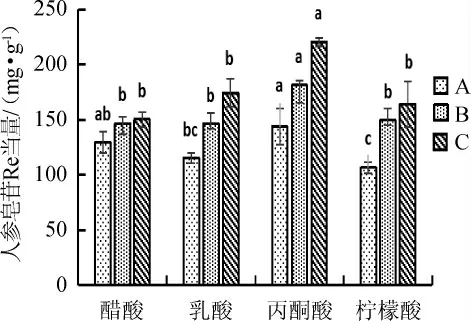
图8 不同有机酸对人参皂苷含量的影响Fig.8 Effect of different organic acids on ginsenoside contents
由图8可知,在培养基中加入不同的有机酸对人参皂苷的含量有明显差异,当丙酮酸作为外源有机酸加入培养基中所产生的人参皂苷含量要明显高于乳酸,柠檬酸和醋酸。因此,选择选择0.14%丙酮酸作为最适有机酸。
2.3.4 不同磷酸盐对人参皂苷含量的影响
本实验通过在发酵培养基中增添磷酸氢二钠以及磷酸二氢钾用来补充微量元素,添加量为0.08%[15],其他发酵培养基组分不变进行对照实验,结果见图9。
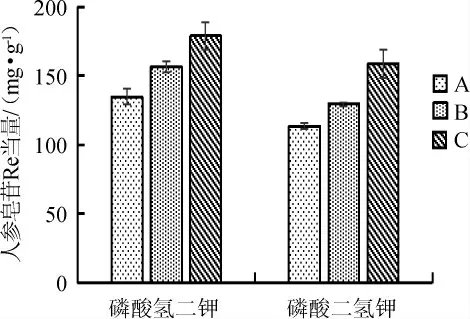
图9 不同磷酸盐对人参皂苷含量的影响Fig.9 Effect of different phosphate salts on ginsenoside contents
由图9可知,不同的磷盐作为外源辅料添加到培养基中对人参皂苷含量的影响不同,磷能够合成一些很重要的辅酶如烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)+、辅酶A(coenzyme A,CoA)等,同时是许多高能磷酸化合物的重要辅料,磷酸盐主要被应用在发酵和细菌培养中,因能补充微生物生长所需的磷和钾,促进糖的新陈代谢和微生物的生长繁殖,所以常被用作外源辅料添加在发酵培养基中。当磷酸氢二钾作为磷盐发酵人参叶时,人参皂苷的含量最高。这可能是因为在发酵液中,磷酸盐能够调节酸碱度,促进发酵液中的pH达到最适的生长条件,从而能够在发酵过程中保持着适宜微生物生长的条件以及产物的合成。因此,选择添加量为0.08%磷酸氢二钾作为最适磷盐。
2.4 最佳发酵条件及最佳培养基发酵
在最佳发酵条件及最佳培养基条件下发酵,得到人参皂苷含量,结果见图10。
由图10可知,通过之前对发酵条件及培养基组分的筛选,利用选出的最佳条件进行复配,在料液比1∶10(g∶mL),发酵温度30 ℃,接种量2.0%,初始pH值为5.0,同时添加外源辅料复配蛋白胨+酵母粉(1∶1)1%、果糖2%、丙酮酸0.14%、磷酸氢二钾0.08%的条件下进行发酵,3个不同产地人参皂苷的含量分别194.25 mg/g、214.57 mg/g、271.75 mg/g,较未发酵组产量(64.11 mg/g、86.19 mg/g、106.91 mg/g)均分别提高了约2.5倍。
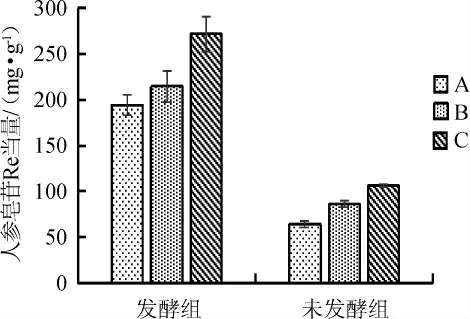
图10 培养条件优化前和优化后皂苷含量比较Fig.10 Comparison of ginsenoside contents before and after culture conditions optimization
3 结论
通过微生物发酵提取技术可提高人参叶皂苷的提取率,筛选得到的最佳发酵菌种为酿酒酵母CICC 31393,最佳发酵条件是料液比1∶10(g∶mL),初始pH 值为5.0,发酵温度30 ℃,接种量2.0%,发酵时间6 d;最佳培养基成分为酵母粉+蛋白胨(1∶1)1%、果糖2%、丙酮酸0.14%、磷酸氢二钾0.08%,以此培养条件进行发酵,3个不同产地人参皂苷含量分别为194.25 mg/g、214.57 mg/g、271.75 mg/g,较未发酵组产量(64.11 mg/g、86.19 mg/g、106.91 mg/g)均分别提高了约2.5倍。微生发酵法制备人参叶皂苷可大大提高了人参叶皂苷的提取率,条件温和、无污染,是一种应用前景较好的制备技术。

