R406抑制脂多糖诱导的RAW264.7细胞炎症及其机制研究
林 杰, 张 波
(同济大学附属东方医院医学超声科,上海 200120)
炎症反应是机体受到内外界有害刺激时产生的一种防御性反应,是一种常见且重要的生理反应[1]。炎症反应是机体抵御外界感染的基本反应,但炎症反应过度会造成机体损伤。炎症反应与多种疾病的发生和发展密切相关,比如动脉粥样硬化、肿瘤、关节炎、炎症性肠病等。炎症性疾病的发生发展与巨噬细胞的分化以及表达分泌的炎症因子和介质有着密切关系,调节巨噬细胞的炎性活化,为炎症性疾病提供治疗的新方案。
脾酪氨酸激酶(spleen tyrosine kinase, Syk)表达于各类细胞,包括巨噬细胞、肥大细胞等。作为细胞内的一个信号转导分子,Syk广泛参与调节机体的免疫应答和炎症反应[2]。相关研究表明,巨噬细胞表面受到相关抗原刺激后,信号分子激活Syk,使其磷酸化,磷酸化的Syk激活下游因子,促进炎症因子的表达和分泌[3]。因此,抑制Syk的激活,可以成为抑制炎症方法之一。R406是一种小分子抑制剂,能抑制Syk底物接头磷酸化,阻断Syk依赖的免疫细胞活化,并减少免疫复合物介导的炎症[4]。可见,R406能通过抑制Syk的信号传递,抑制下游炎症因子的表达。本研究利用脂多糖(lipopolysaccharide, LPS, 50 ng/mL)刺激RAW264.7(单核巨噬细胞)分化为炎性细胞,分泌各类炎症因子,构建体外炎症模型,检测R406对炎症因子的分泌以及相关基因表达的影响,探究R406的抗炎作用及其机制。
1 材料和方法
1.1 材料
RAW264.7(KG097)购自圆创生物科技(上海);R406(HY-11108)购自美国MedChemExpress公司;胎牛血清(fetal bovine serum, FBS; 10100147)购自Gibco(澳大利亚);DMEM培养基(dulbecco’s modi-fied Eagle’s medium, DMEM; SH30022.01)和双抗(链霉素+青霉素,SV30010)购自上海北诺生物科技有限公司;二甲基亚砜(ST038-100 mL)、一氧化氮(nitric oxide, NO)检测试剂盒(S0021S)、NF-κB抗体(AF0246)和p-NF-κB抗体(AF5878)购自碧云天生物公司(南京);引物(G3203-10D)购自武汉赛维尔生物公司(武汉);ELISA试剂盒肿瘤坏死因子(tumor necrosis factor, TNF-α): 70-EK282/3-96;单核细胞趋化蛋白1(C-C motif chemokine 2, CCL-2/human macrophage chemoattractant protein-1, MCP-1): 70-EK287/2-96购买自联科生物公司(杭州);脂多糖(916374-10G)购自美国Sigma-Adrich公司。
1.2 方法
1.2.1 RAW264.7细胞培养及R406的溶解 培养基配制条件: 500 mL DMEM+50 mL FBS+5 mL双抗。将RAW264.7细胞放置于37 ℃、5%CO2的细胞培养箱中培养,待细胞长满80%培养瓶时传代。复苏后的细胞在进行3次传代培养后用于实验。
使用二甲基亚砜溶解R406,将含有R406的DMSO溶解于培养基中,分别配成0.5、1.0、1.5 μmol/L 最终浓度的R406培养基溶液用于实验。
1.2.2 R406对RAW246.7细胞分泌炎症因子的影响 采用酶联免疫吸附法测定细胞上清液中炎症因子的表达。将对数生长期的RAW264.7细胞以1×106个/mL的细胞密度植在12孔板内,每孔1 mL,培养过夜。次日将细胞分为空白对照组,LPS模型组,0.5 μmol/L R406+LPS组,1.0 μmol/L R406+LPS组,2.0 μmol/L R406+LPS组,每组设置3个复孔,使细胞与LPS和R406共孵育24 h。
孵育结束后离心(离心半径9.85 cm,1 650 r/min,5 min)并收集细胞培养基上清液。按照ELISA试剂盒的操作步骤检测细胞上清液中的TNF-α,CCL-2/MCP-1的含量。每组实验设置3个复孔。
1.2.3 R406对RAW246.7细胞释放NO含量的影响 RAW264.7细胞按照1.2.1项方法分组处理后,收取细胞上清液,采用格里斯法检测细胞NO的表达。取50 μL细胞上清液与50 μL格里斯试剂Ⅰ和Ⅱ混合,在室温下孵育15 min后。检测样品在540 nm 条件下的吸光度(A540),并使用标准品亚硝酸钠配制成浓度梯度溶液并制作标准曲线,计算样品中NO的含量。每组实验设置3个复孔。
1.2.4 R406对RAW246.7细胞中炎症因子mRNA表达的影响 RAW264.7细胞按照1.2.1项方法分组处理后,收集细胞,使用预冷的PBS重悬3次细胞后得到沉淀,裂解细胞,提取细胞mRNA,反转录合成cDNA,通过RT-PCR检测TNF-α,白细胞介素-1β(interleukin-1β, IL-1β)和诱导型一氧化氮合酶(inductible nitric oxide synthase, iNOs)的mRNA表达,引物序列如表1所示。PCR反应条件: 98 ℃预变性10 min,98 ℃变性20 s,55 ℃退火20 s,72 ℃延伸10 s,变性退火延伸进行40个循环,72 ℃末段延伸5 min,16 ℃降温2 min。计算TNF-α、IL-1β和iNOS的mRNA表达。每组实验重复3次。

表1 TNF-α、IL-1β和iNOS mRNA的引物序列
1.2.5 R406对细胞内NF-κB和p-NF-κB的表达的影响 使用Western印迹法检测细胞内NF-κB和p-NF-κB蛋白含量来研究R406抑制炎症的机制。RAW264.7细胞按照1.2.1项方法分组处理后,收集细胞,用预冷的PBS重悬3次后得到细胞沉淀,加入RIPA裂解液,裂解细胞,离心收集上清液,提取细胞总蛋白,用SDS-PAGE凝胶分离蛋白,然后转移至PVDF膜上,用5%的脱脂牛奶在室温下对PVDF膜封闭30 min,4 ℃过夜孵育NF-κB(1∶1 000)抗体,p-NF-κB(1∶1 000)抗体和β-actin(1∶2 000)抗体。回收一抗,PBST洗膜3次,每次5 min,在室温下孵育相对应的二抗30 min,PBST洗膜3次脱色,每次5 min,然后对膜进行曝光。使用Image J软件对得到条带整理去色并分析目标带的光密度值。每一项指标重复3次实验。
1.3 统计学处理
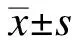
2 结 果
2.1 R406对RAW246.7细胞分泌炎症因子的影响
和空白对照组相比,RAW246.7细胞在受到LPS的刺激后,细胞上清液中TNF-α和CCL-2/MCP-1的含量和对照组相比明显升高且差异具有统计学意义,在酶联免疫吸附板上通过显色反应表现为更深的颜色(图1 A、B)。R406(1.0、1.5 μmol/L)能降低RAW246.7细胞炎症因子的分泌,且降低程度与R406浓度呈正相关且差异具有统计学意义(图2 A、B)。
2.2 R406对RAW246.7细胞释放NO的影响
通过格里斯法检测结果可知,相比于对照组,RAW246.7细胞在与LPS共孵育后会大量释放NO且差异具有统计学意义,在添加格里斯试剂Ⅰ和试剂Ⅱ后,细胞上清液发生化学反应变为紫色,见图1。R406(1.0、1.5 μmol/L)能降低RAW246.7细胞NO的释放且呈剂量依赖性,见图2。因此R406能抑制RAW246.7细胞释放NO。

图1 酶联免疫吸附法检和格里斯试剂法检测炎症因子和一氧化氮Fig.1 Detect inflammatory factors and nitric oxide by Enzyme-linked immunosorbent assay and Griess reagent methodA: 显色反应;B: 终止显色反应;C: 格里斯反应;1: 空白对照;2: LPS;3~5的R406浓度分别为0.5、1.0、1.5 μmol/L

图2 R406对巨噬细胞炎症因子和一氧化氮释放的影响Fig.2 The effect of R406 on the release of inflammatory factors and nitric oxide from macrophagesA: TNF-α;B: MCP-1/CCL-2;C: NO;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;1: 空白对照;2: LPS;3~5的R406浓度分别为0.5、1.0、1.5 μmol/L
2.3 R406对RAW246.7细胞中炎症因子mRNA的表达
RAW246.7细胞与LPS共孵育24 h后,细胞内TNF-α、IL-1β和iNOS的mRNA表达相比于空白对照组大量增加,而R406能降低RAW246.7细胞内TNF-α、IL-1β和iNOS的mRNA表达且呈剂量依赖性,差异具有统计学意义(P<0.000 1),见图3。相关引物序列见表1。

图3 R406对巨噬细胞基因表达的影响Fig.3 The effect of R406 on the gene expression of macrophagesA: TNF-α; B: IL-1β; C: NO;1: 空白对照;2: LPS;3~5的R406浓度分别为0.5、1.0、1.5 μmol/L
2.4 R406对细胞内NF-κB和p-NF-κB表达的影响
与空白对照组相比,LPS在和RAW264.7细胞共孵育24 h后,NF-κB p65的磷酸化显著提高,而R406能降低NF-κB p65磷酸化水平,见图4。这说明R406抑制Syk能作用在NF-κB的信号通路上来抑制炎症。

图4 R406对巨噬细胞NF-κB磷酸化水平的影响Fig.4 The effect of R406 on the phosphorylation level of NF-κB in macrophagesA: Western印迹法;B: 定量分析;1: 空白对照;2: LPS;3~4的R406浓度分别为0.7、1.5 μmol/L
3 讨 论
LPS是革兰阴性细菌壁外壁的组成成分,和TNF-α、CCL-2/MCP-1等致炎因子一样,常用于构建体外细胞炎症模型[5-6]。LPS刺激可诱导巨噬细胞分化为促炎型细胞,分泌各种炎症因子,包括TNF-α、CCL-2/MCP-1、IL-1β、IL-6等[7-8]。TNF-α是在炎症反应中起到重要作用,巨噬细胞分泌TNF-α后,TNF-α作为刺激因子继续对巨噬细胞具有刺激作用,促进炎症反应的“正反馈”,放大炎症。CCL-2/MCP-1是一种趋化因子,能吸引人体中的免疫细胞到达炎症部位[9],继而扩大炎症反应。在LPS作用下,巨噬细胞释放的各类炎症因子的功能交错、互相作用,导致炎症反应的大爆发。本研究显示,R406能抑制LPS诱导巨噬细胞表达和分泌炎症分子。
NO是炎症反应中一个重要的信号传递分子,由活化了的巨噬和中性粒细胞产生,是参与炎症反应的介质之一[10]。NO的过度产生由诱导型iNOS基因表达异常引起,LPS刺激巨噬细胞iNOS mRNA表达上调,产生大量NO自由基,与过氧阴离子氧化形成氧化亚硝酸盐,引起组织损伤[11]。本研究显示,R406可以下调巨噬细胞iNOS的mRNA表达,抑制NO自由基的分泌。
NF-κB作为一种转录因子,它与机体的炎症、免疫反应密切相关[12-13]。TNF-α、IL-1β和iNOS等炎症相关的基因表达需要NF-κB的参与[14],而磷酸化是其活化的关键步骤。本研究显示LPS能诱导巨噬细胞内NF-κB磷酸化,而R406能降低其磷酸化水平[15]。
Syk属于非受体型酪氨酸激酶蛋白,是一种细胞质酪氨酸激酶,在许多免疫相关细胞中表达。Syk作为一种细胞内的信号传递分子,Syk在细胞内炎症信号传导中起关键作用[2]。研究表明,在炎症化的巨噬细胞中,Syk的磷酸化上调,且在各类炎症性和免疫性疾病如风湿性关节炎、过敏性鼻炎等病程进展过程当中,以抑制Syk活性为治疗手段获得了肯定的治疗效果[15-19],可见,Syk可以作为一个靶标治疗炎症[20]。本研究显示,R406通过抑制Syk能降低巨噬细胞炎质介质表达,且作用在NF-κB信号通路上,这可能是其抑制巨噬细胞炎症反应的原因和机制之一。
综上所述,R406具有下调巨噬细胞炎症反应的作用,能降低巨噬细胞炎症相关的基因表达,减少炎症相关介质和NO的分泌,并且负调控NK-κB的磷酸化,在调控炎症相干疾病方面有着重要作用。

