基于HDDA反应的稠合芳伯胺的合成与表征
张号 张孝荣

【摘 要】 炔烃芳构化加成反应(Hexadehydro-Diels-Alder)是合成芳环骨架研究热点之一,促使C-N的构建键由过渡金属催化转向无金属绿色合成。以四炔类化合物为基础底物,乌洛托品为氮源,在无惰性气氛保护下,以DMF为溶剂,100℃恒温加热12 h,经苯炔中间体亲核C-N偶联,成功构建两个碳碳键,一个碳氮键,成功合成了稠合芳伯胺化合物,并采用X射线衍射仪、核磁共振谱仪、质谱仪等仪器设备进行表征。
【关键词】 四炔;C-N偶联;稠合结构;芳胺化合物;HDDA反应
Synthesis and Characterization of Fused Primary Aromatic
Amines Based on HDDA Reaction
Zhang Hao1 ,Zhang Xiaorong2
(1.Chaohu University, Chaohu 238000, China;
2.KANGLONG Huacheng (Xi′an) New Drug Technology Co., Ltd, Xi′an 710018, China)
【Abstract】 The aromatization addition of alkynes (Hexadehydro-Diels-Alder, HDDA) is one of the hot topics in the synthesis of aromatic ring skeleton, which promotes the construction of C-N bond from transition metal catalysis to no metal green synthesis. Under the protection of inert atmosphere, tetraynes were used as substrate, hexamethylenetetramine as nitrogen source, DMF as solvent, heated at 100℃ for 12h, and then two C-C bonds and one C-N bond were successfully constructed by nucleophilic C-N coupling of phenylyne intermediate. The fused aromatic primary amines were successfully synthesized and characterized by X-ray diffractometer, nuclear magnetic resonance spectrometer and mass spectrometer.
【Key words】 tetraynes; C-N coupling; fused structure; aromatic amine compounds; HDDA reaction
0 引言
烏洛托品(Hexamethylenetetramine,HMTA)结构与金刚烷类似,由4个氮原子与6个亚甲基相连,构成四个相互稠合的多元氮杂环,既是一类常见的皮肤杀菌剂、消毒剂, 也是有机合成的重要原料,同时还是一类特种精细化学品, 用于金属缓蚀、军事燃料、军工炸药等领域[1]。目前,乌洛托品的合成应用主要侧重于药理性质挖掘[2]、功能材料优化[3]等方面,也作为氮源参与有机反应构建C-N键[4]。20世纪90年代以来,钯[5]、铜[6]、铁[7]等过渡金属催化C-N偶联是合成芳胺类化合物的重要手段,随着绿色合成的不断发展,无金属催化构建C-N键成为现代合成趋势[8,9]。近年来,通过炔烃芳构化加成反应[Hexadehydro-Diels-Alder(HDDA)] [10]构建芳环骨架是有机合成研究热点之一,为C-N偶联合成芳胺类化合物提供了新的实验思路。
芳胺及其衍生物也是一类重要的有机化工原料,常用作有机合成中间体[11],广泛应用于染料、医药、农药、树脂、涂料、炸药、香料、表面活性剂、橡胶硫化促进剂等有机合成领域[12]。本文实验以廉价的丙二酸二甲酯等二羰基类化合物为原始底物,经过Sonogashira端炔偶联等反应,合成含有一组对称共轭二炔键的多炔化合物,多炔化合物与乌洛托品在加热的条件下,通过HDDA反应历程,发生苯炔中间体亲核加成反应,芳构化得到稠合芳胺类化合物。
1 实验部分
1.1 实验试剂、仪器
主要原料试剂:丙二酸二甲酯、苯乙炔、对氟苯乙炔、对甲基苯乙炔、NBS、二(三苯基膦)二氯化钯、碘化亚铜、氢化钠、乙腈、三乙胺、四氢呋喃、硝酸银、丙酮、DMF、无水硫酸镁、乙酸乙酯、石油醚等,均为分析纯。
主要仪器设备:恒温加热电磁搅拌器、三口烧瓶、分液漏斗、恒压滴液漏斗、Schlenk反应瓶、冷凝管、层析柱(硅胶300~400 目)、Bruker Avance 300型核磁共振谱仪、XT-4型双目显微熔点仪、Agilent 6220质谱仪、X射线衍射仪等。
1.2 实验方法
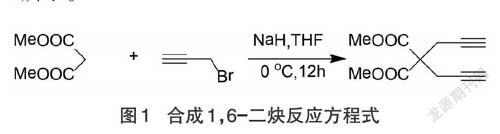
1.2.1 合成1,6-二炔
在三口烧瓶中,加入丙二酸二甲酯和无水THF(溶剂),在冰水浴和机械搅拌条件下缓慢加入氢化钠,搅拌均匀后,用恒压滴液漏斗滴加炔丙基溴,搅拌反应12 h,用水淬灭反应,乙酸乙酯萃取,无水硫酸镁干燥除水,减压蒸馏除乙酸乙酯等低沸物,柱层析分离提纯得到产物(白色或黄色固体),洗脱剂为乙酸乙酯与石油醚的混合液(体积比1:40),如图1所示。
1.2.2 合成芳基炔溴
在三口烧瓶中,加入芳基乙炔、NBS、催化用量硝酸银、丙酮(溶剂),光照室温条件下反应4 h,用水淬灭反应,乙酸乙酯萃取,无水硫酸镁干燥除水,减压蒸馏除乙酸乙酯等低沸物,得到反应粗产物(浅红色液体),反应产率达98%,无需柱层析分离提纯,静置备用(不宜长时间放置,现制现用为佳),如图2所示。
1.2.3 合成四炔
在三口烧瓶中,加入1,6-二炔、芳基炔溴、催化剂[二(三苯基膦)二氯化钯、碘化亚铜]、三乙胺(碱)、乙腈(溶剂),在室温条件下磁力搅拌12 h,用水淬灭反应,乙酸乙酯萃取,无水硫酸镁干燥除水,减压蒸馏除乙酸乙酯等低沸物,柱层析分离提纯得到产物(白色或黄色固体),洗脱剂为乙酸乙酯与石油醚的混合液(体积比1:60),如图3所示。
1.2.4 合成稠合芳伯胺
在干燥Schlenk反应瓶中,加入四炔化合物、乌洛托品、DMF(溶剂),油浴加热(100℃)搅拌,无需保护条件,反应12 h,用水淬灭反应,乙酸乙酯萃取,无水硫酸镁干燥除水,减压蒸馏除乙酸乙酯等低沸物,柱层析分离提纯得到产物(黄色固体),洗脱剂为乙酸乙酯与石油醚的混合液(体积比1:60),如图4所示。
2 实验过程与结果
2.1 反应优化
以2,2-二(5-苯基-2,4-二戊炔)丙二酸二甲酯与乌洛托品反应为优化实验模型,探索实验最优的反应温度、反应时间和反应溶剂。
2.1.1 确定最佳反应温度
固定反应溶剂(DMF)和反应时间(12 h),考虑四炔含有一组对称共轭炔键,反应活性可能较高,温度越高,反应越剧烈,可能产生副反应。设立80-120℃五组对比实验,测算80℃时产率仅为18%,温度较低,反应活性不高,硅胶板点样爬板显示,有部分反應物未参与反应,随着温度升高,产率明显增大,90℃时产率达到64%,100℃时达到最高产率82%,再升温产率开始下降,110℃时产率为62%,120℃时产率仅为9%,硅胶板点样爬板显示,副产物较多。因此,确定最佳温度为100℃,如表1所示。
2.1.2 确定最佳反应时间
固定反应溶剂(DMF)和反应温度(100℃),考虑有机反应一般反应时间较长,结构越活泼,反应时间越短。设立6 h、8 h、10 h、12 h、14 h、16 h六组对比实验,测算反应6 h的产率为65%,反应8 h的产率为74%,反应10 h的产率为79%,反应12 h的产率为82%,反应14 h的产率为82%,反应16 h的产率为80%,反应产率随时间增长整体呈上升趋势,在12 h时达到最大值,16 h产率下降,可能是产物发生反应,因此,确定最佳反应时间为12 h,如表2所示。
2.1.3 确定最佳溶剂
固定反应温度(100℃)和反应时间(12 h)后,考虑溶剂的极性和沸点,探索溶剂对反应的影响。设立甲苯(Toluene)、乙腈(CH3CN)、DMSO、H2O、DMF五组对比实验,甲苯极性较低,反应产率为66%,乙腈沸点81.6℃,低于反应设立温度,部分流失,导致反应体系溶剂量不足,反应产率较低,仅为9%,DMSO作为溶剂,产物点样爬板显示副产物增多,可能DMSO参与反应,反应产率降为35%,无机溶剂H2O有机溶解能力较差,不发生反应, DMF作为溶剂,反应产率最高(82%),而且点样爬板显示主产物单一,可确定为最佳溶剂,如表3所示。
2.2 反应底物拓展
在确定芳构化合成芳胺的最优反应条件后,探索不同结构的四炔类底物与乌洛托品的反应情况。炔基末端R基团上有甲基等供电子基团时,产率略微下降,而连有氟原子等吸电子基团时,产率略微提高,说明吸电子原子或基团降低了苯炔中间体的电子密度,促进了亲核加成反应,如表4所示。
2.3 产物表征
2.3.1 表征数据
3a (7-胺基-5-苯基-4-苯乙炔基-1H-茚-2,2(3H)-二甲酸二甲酯):黄色固体,产率82 %; m.p. 170-171℃; 1H NMR (300 MHz, CDCl3): δ 7.63-7.60 (d, J=6.0Hz, 2H), 7.44-7.37 (m, 4H), 7.29-7.25(m, 6H), 6.59 (s, 1H), 3.83 (s, 2H), 3.80 (s, 6H), 3.51 (s, 2H); 13C NMR (75.5 MHz, CDCl3): δ 172.05, 144.70, 144.66, 142.25, 140.63, 129.25, 128.15, 127.75, 127.49, 127.27, 124.12, 123.14, 114.54, 107.78, 93.67, 87.94, 59.47, 53.12, 41.40, 37.89; HRMS (APCI): m/z [M+H]+ calcd for C27H23NO4: 426.1700, found: 426.1702.
3b (7-胺基-5-对氟苯基-4-[(4-氟苯基)乙炔基]-1H-茚-2,2(3H)-二甲酸二甲酯):黄色固体,产率85%; m.p. 186-187℃; 1H NMR (300 MHz, CDCl3): δ 7.59-7.54 (m, 2H), 7.28-7.26 (m, 4H), 7.13-7.07 (t, J=8.7Hz, 2H), 7.01-6.98 (t, J=8.7Hz, 2H), 6.67 (s, 1H), 3.80 (s, 3H), 3.79 (s, 3H), 3.79 (s, 2H), 3.57 (s, 2H); 13C NMR (75.5 MHz, CDCl3): δ 172.07, 163.97 (JC-F=246.0Hz), 163.81 (JC-F=249.1Hz), 160.71, 160.51, 144.74, 143.58, 142.47, 136.64, 132.90, 130.93, 130.83, 123.25, 115.70, 115.41, 114.83, 114.55, 114.44, 92.73, 87.41, 59.48, 53.24, 41.40, 37.88; HRMS (APCI): m/z [M+H]+ calcd for C27H21F2NO4: 462.1511; found: 462.1503.
3c (7-胺基-5-对甲苯基-4-[(4-甲苯基)乙炔基]-1H-茚-2,2(3H)-二甲酸二甲酯):黄色固体,产率78%; m.p. 118-119℃; 1H NMR (300 MHz, CDCl3): δ 7.33-7.26 (m, 6H), 7.09-7.06 (m, 4H), 6.67 (s, 1H), 3.78 (s, 6H), 3.71 (s, 2H), 3.59 (s, 2H), 2.40 (s, 3H), 2.31(s, 3H); 13C NMR (75.5 MHz, CDCl3): δ 172.14, 144.68, 144.40, 142.09, 137.56, 130.99, 129.12, 128.95, 128.51, 122.99, 114.55, 96.47, 93.82, 59.50, 53.13, 41.47, 37.94, 22.67, 21.49, 21.26; HRMS (APCI): m/z [M+H]+ calcd for C30H29NO4: 454.2013,found: 454.2011.
2.3.2 核磁共振数据分析
核磁共振氢谱和碳谱均以氘代氯仿为溶剂,以3a为例,核磁氢谱中,化学位移在7.44-7.25 ppm之间是苯环氢原子,表现为多重峰吸收,在7.63-7.60 ppm之间是氨基氢原子,表现为双峰吸收,在3.8 ppm是甲基氢原子,表现为单峰吸收,在3.83 ppm、3.51 ppm是亚甲基氢原子,表现为单峰吸收;核磁碳谱中,化学位移在144.70-107.78 ppm之间峰较为密集,为苯环碳原子,在172.05 ppm的为羰基碳原子,在93.67 ppm、87.94 ppm的为炔基碳原子,在53.12 ppm的为甲基碳原子,化学位移在59.47 ppm的为羰基相邻季碳原子,化学位移在41.40 ppm、37.89 ppm的为五元环亚甲基碳原子。
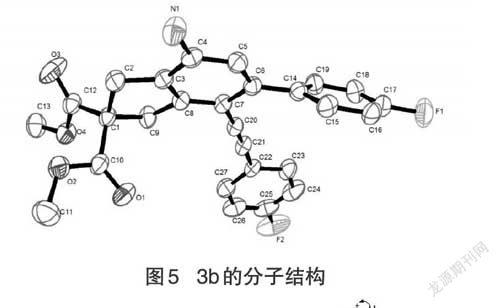
2.3.3 单晶测试
对化合物3b进行单晶衍射分析,分子结构如图5所示,晶体数据如表5所示。
2.4 反应机理
根据HDDA反应机理[9]及实验测算结果,推测可能反应机理:多炔底物分子受热分子内成环,生成苯炔中间体,乌洛托品受热分解释放NH3,NH3进攻苯炔中间体,发生亲核加成反应,形成苯基碳负离子,苯基碳负离子再进攻N上的H原子,结合H原子,生成稠合芳胺化合物,如图6所示。
3 结论
实验研究表明,乌洛托品和多炔底物在无任何保护条件下,以DMF为溶剂,100℃恒温加热12 h,经HDDA反应历程,成功构建两个C-C键,一个C-N键,“一锅法”合成了新的稠合芳伯胺类化合物。该反应条件温和,易操作,产率高,无保护条件、无金属催化剂、无辅助剂、无添加剂,充分彰显了绿色化学合成理念和技术方法,为合成芳胺类化合物提供了一条新的路线。而实验产物以茚环为中心骨架,同时具备C-N键、炔键,在医药农药合成、活性分子探索、功能材料开发等方面具有潜在的研究价值[13-14]。
[参考文献]
[1] 王维,杜林楠,吴贤,等. 六亚甲基四胺的结构及热稳定性研究[J]. 精细石油化工进展,2017,18(6): 40-44.
[2] 卢宗太,蔡建奎,安宝军,等. 乌洛托品腹腔注射治疗猪传染性胃炎的效果[J]. 兽医导刊,2020(13): 124.
[3] Karunakar S, Biswajyoti M, Amrita B, et al. Role of hexamethylenetetramine in ZnO-cellulose nanocomposite enabled UV and humidity sensor[J]. Materials Science in Semiconductor Processing , 2020(105).
[4] Ke Z G, Yu B, Wu Y Y, et al. A Novel Route to Synthesize N, N ‐Dimethyl Arylmethylamines from Aryl Aldehydes, Hexamethylenetetramine and Hydrogen[J]. Chinese Journal of Chemistry, 2020,38(8): 842-846.
[5] Stambuli J P, Kuwano R, Hartwig J F. Unparalleled Rates for the Activation of Aryl Chlorides and Bromides: Coupling with Amines and Boronic Acids in Minutes at Room Temperature[J]. Angew Chem Int Ed,2002,41(24): 4746-4748.
[6] Ma D , Cai Q , Zhang H . Mild Method for Ullmann Coupling Reaction of Amines and Aryl Halides[J]. Organic Letters,2003,5(14): 2453-2455.
[7] Guo D, Huang H, Xu J, et al. Efficient Iron-Catalyzed N-Arylation of Aryl Halides with Amines[J]. Organic Letters, 2008, 10(20): 4513-4516.
[8] Coeffard V, Moreau X, Thomassigny C, et al. Transition‐Metal-Free Amination of Aryl boronic Acids and Their Derivatives[J].Angew Chem Int Ed,2013,52(22): 5684-5686.
[9] 吳玉芹,于凉云,张奇,等. 四炔的芳炔环加成反应简便合成芳胺[J]. 有机化学,2015,35(3):724-730.
[10] Hoye T R, Baire B, Niu D, et al. The hexadehydro-Diels–Alder reaction[J].Nature,2012(490): 208-212.
[11] 赵伟明,叶华明,阮海良. 环保型染料中间体N-氰乙基-N-苄基苯胺的合成研究[J]. 化工管理,2019(13): 113-114.
[12] 翟康,王昭文,张磊,等. 邻硝基苯胺合成邻苯二胺用Pd/C催化剂研究[J]. 工业催化,2020,28(8): 61-64.
[13] 任丽磊,刘光仙. 新型四氢吡咯并二氢卟吩的合成及性质[J]. 廊坊师范学院学报(自然科学版),2019,19(3):42-44.
[14] 周永红,张佳燕,张秋燕,等. 一种新型苯乙烯吡啶盐的制备、结构及光学性质[J]. 廊坊师范学院学报(自然科学版),2018,18(3):58-60.

