角叉菜胶致大鼠慢性前列腺炎模型的影响因素
朱佩轩 范琼尹 张晶璇 高健 刘逍遥 赵睿学 苏泽琦 王停
摘要 目的:明確角叉菜胶注射部位、注射浓度、注射剂量对慢性前列腺炎大鼠模型建立的影响,以形成稳定、可靠的模型制备方案。方法:选用成年雄性SD大鼠,采用角叉菜胶直接注射到前列腺的方法制备模型。分别考察不同注射部位(前列腺背侧叶、腹侧叶)、角叉菜胶不同浓度(1%、3%、5%)和注射剂量(50 μL、80 μL)对模型制备的影响,以前列腺组织HE染色结果为指标进行判定,同时对成模时间及稳定性进行考察。结果:1)仅注射腹侧叶时,病理一致性较好,且操作简便易行,模型稳定。2)每针注射50 μL较80 μL引起的病理改变更为均衡。3)注射1%角叉菜胶时病理改变较轻,注射3%角叉菜胶的模型一致性较好。4)角叉菜胶注射7 d、21 d、35 d后,均有符合慢性前列腺炎的炎症反应。5)本模型病理改变以巨噬细胞增殖聚集为主,伴有一定程度的混合炎症细胞(单核细胞、淋巴细胞、浆细胞等)浸润。结论:在SD大鼠前列腺左、右腹侧叶各注射两针3%角叉菜胶50 μL(共计200 μL),可在7 d后成功建立慢性前列腺炎模型且模型能至少维持4周。本研究可为慢性前列腺炎动物模型的制备完善提供数据支撑,同时对于慢性前列腺炎发病机制研究及新药研发具有理论指导意义。
关键词 慢性前列腺炎;慢性骨盆疼痛综合征;动物模型;大鼠;角叉菜胶;病理;模型评价
Abstract Objective:To explore injection site,injection concentration and injection dose on the establishment of chronic prostatitis rat model induced by carrageenan,so as to form a stable and reliable preparation of chronic prostatitis rat model.Methods:In this experiment,adult male SD rats of SPF grade were selected,and a chronic prostatitis model was induced by carrageenan injection into the prostate.Different injection sites(the dorsal lobe of the prostate,the ventral lobe of the prostate),different concentrations of carrageenan(1%,3%,5%),and different injection doses of carrageenan(50 μL and 80 μL per needle)were investigated.In all experiments,the results of hematoxylin-eosin staining of rat prostate tissue were used as an index for model judgment,the time to establish the model and the stability of the model was evaluated at the same time.Results:1)Compared with only injected the dorsal lobe or injected the dorsal lobe and the ventral lobes at the same time,the pathological consistency is better when only ventral lobes are injected,meanwhile the operation is more simple and the model is more stable.2)The pathological changes of the 50 μL per needle injection group were more balanced than the 80 μL per needle injection group.3)The pathological changes were the lightest when 1% carrageenan was injected,and the pathological changes of 3% and 5% carrageenan were heavier than 1%,and the model with 3% carrageenan had better consistency.4)There was an inflammatory response consistent with chronic prostatitis after 7 d,21 d,35 d injection with carrageenan.5)The pathological changes of rats chronic prostatitis induced by carrageenan are mainly the proliferation and aggregation of macrophages,accompanied by a certain degree of mixed inflammatory cells infiltration(monocytes,lymphocytes,plasma cells,etc.).Conclusion:Based on the results of the study,two injections of 50 μL(200 μL in total)of 3% carrageenan were injected into both the left and right ventral lobes of the prostate of SD rats can make the chronic prostatitis model after 7 days and the model can be maintained for at least 4 weeks.This study can provide data support for the preparation of animal models of chronic prostatitis,and can provide theoretical guidance for the study of the pathogenesis of chronic prostatitis and the development of new drugs.
Keywords Chronic prostatitis; Chronic pelvic pain syndrome; Animal model; Rat; Carrageenan; Pathology; Model evaluation
中图分类号:R284;R697文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.14.007
慢性前列腺炎(Chronic Prostatitis,CP)又称慢性骨盆疼痛综合征(Chronic Pelvic Pain Syndrome,CPPS),我国CP发病率为6.0%~32.9%,是泌尿外科的常见疾病之一[1]。临床主要表现为尿急、尿频、尿痛、尿不尽、阴囊潮湿、骨盆区域疼痛或不适等,严重影响患者生命质量[2]。CP病因复杂,发病机制尚未被完全阐明[3-4],对其进行基础研究具有重要意义。现有CP动物水平研究中,以应用角叉菜胶直接注射至大鼠前列腺中诱导CP发生为主要造模方法,但现有文献对角叉菜胶的注射部位、注射浓度、注射剂量以及模型维持时间均无统一标准,未形成标准化实验流程,实验中的细节缺乏交待,导致在模型建立中出现大量重复性的工作。因此,本研究针对角叉菜胶致大鼠CP的关键因素,重点观察上述因素对模型建立的影响,以形成相对稳定、炎症反应程度较一致的模型制备方案,为CP动物水平的研究提供模型基础。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性SD大鼠,9周龄,体质量350~380 g,购自北京斯贝福生物技术有限公司,动物合格证号:SYXK(京)2016-0038。动物饲养于北京中医药大学屏障环境动物室,饲养期间自由摄食、饮水,光照周期明暗各12 h,温度控制在(24±2)℃,相对湿度控制在40%~70%。实验方案经北京中医药大学动物伦理委员会批准(动物伦理审批号:BUCM-4-2019102601-4027)。
1.1.2 试剂与仪器 角叉菜胶(SIGMA公司,美国,生产批号:C1013-25G);0.9%氯化钠注射液(石家庄四药有限公司,生产批号:1809252004);硫酸卡那霉素(GENVIEW公司,中国香港,生产批号:AK177-25G);10%甲醛中性组织固定液(南昌雨露实验器材有限公司,生产批号:190515);苏木精-伊红(HE)染色液套组(南昌雨露实验器材有限公司,生产批号:190601);一次性注射器(山东颐兴医疗器械有限公司,生产批号:190309);分体式包埋机(Leica公司,德国,型号:EG1150);半自动轮转式切片机(Leica公司,德国,型号RM2245);病理图像采集系统(OLYMPUS公司,日本,型号:BX53-DP26)。
1.2 方法
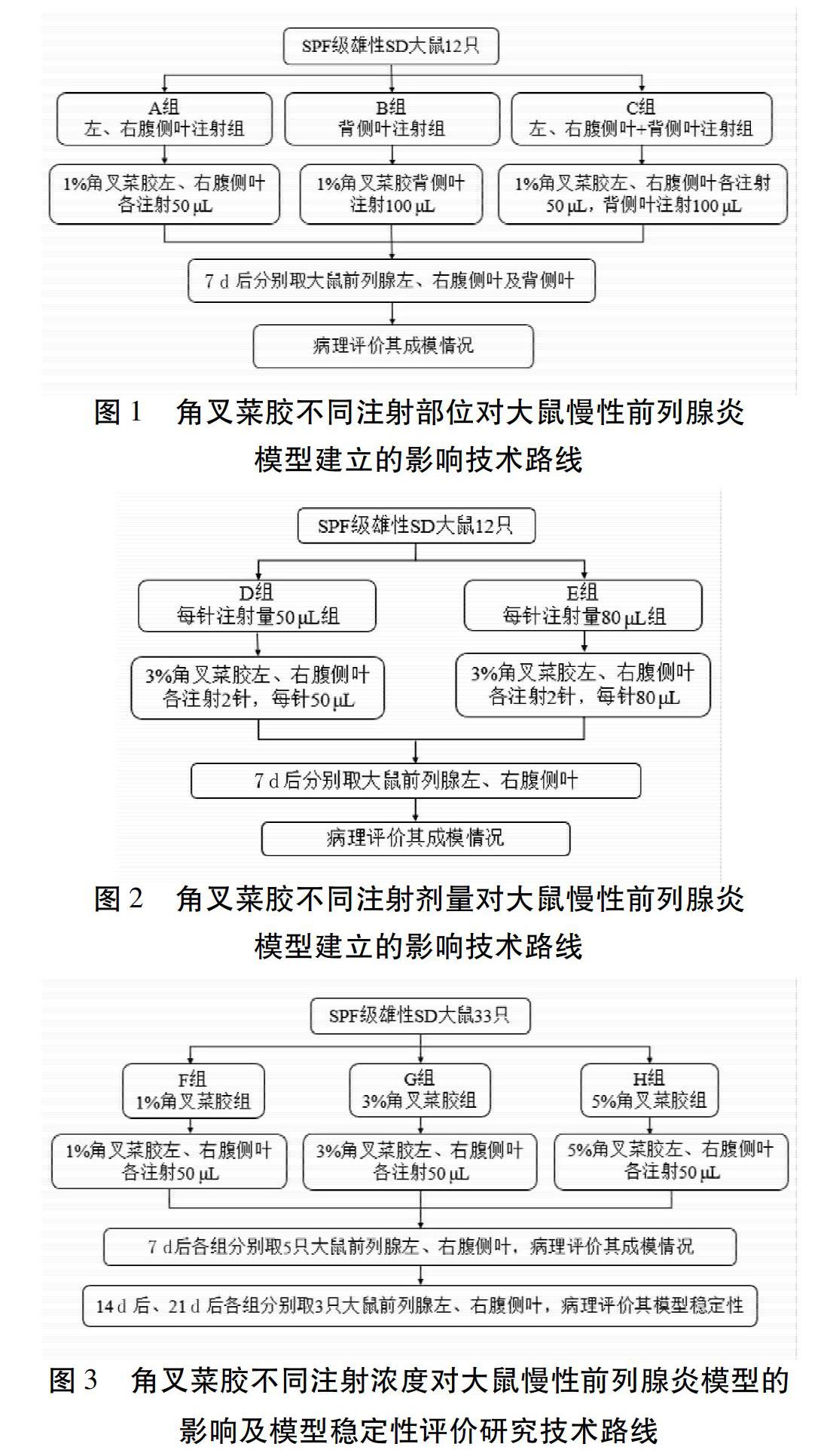
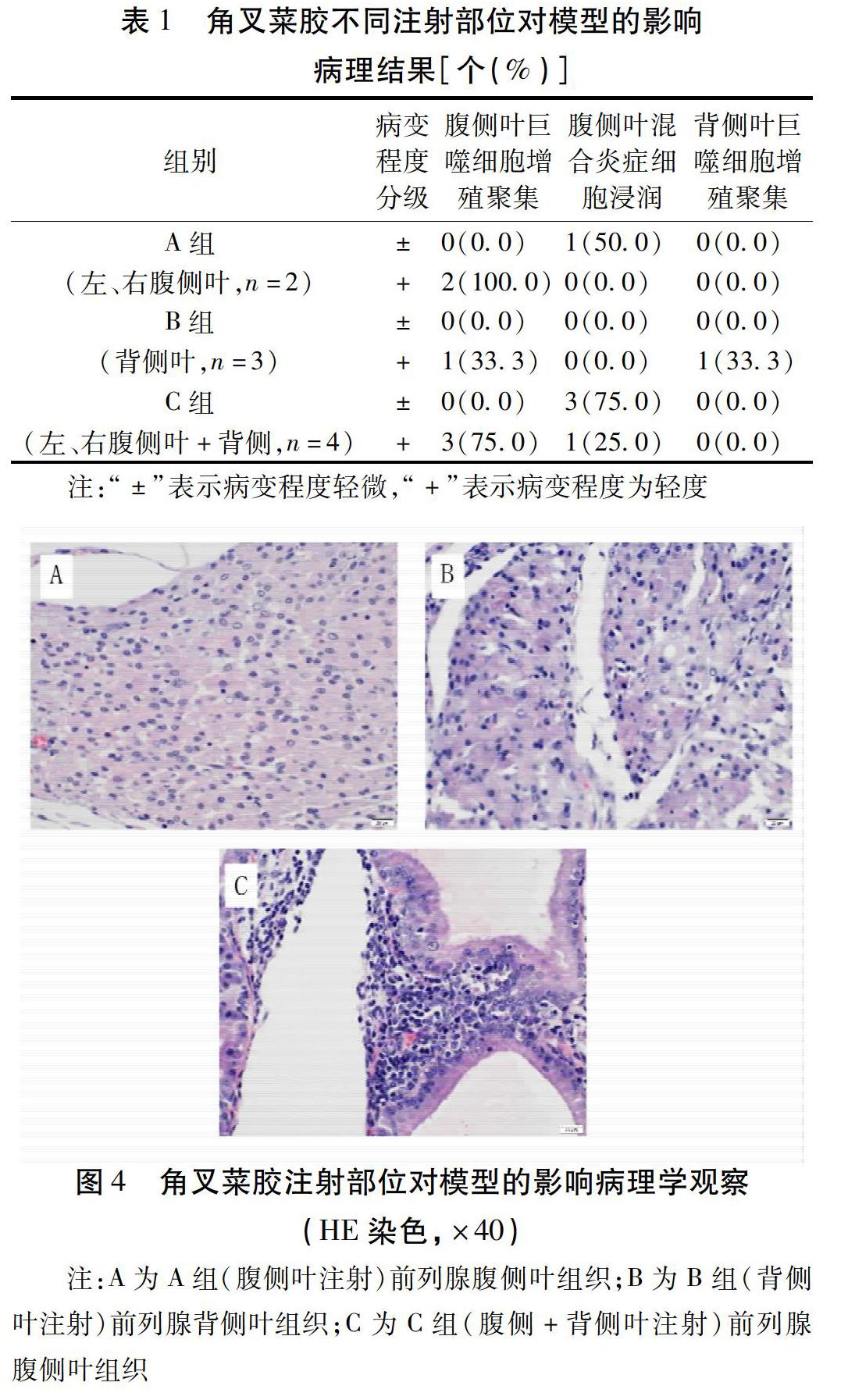
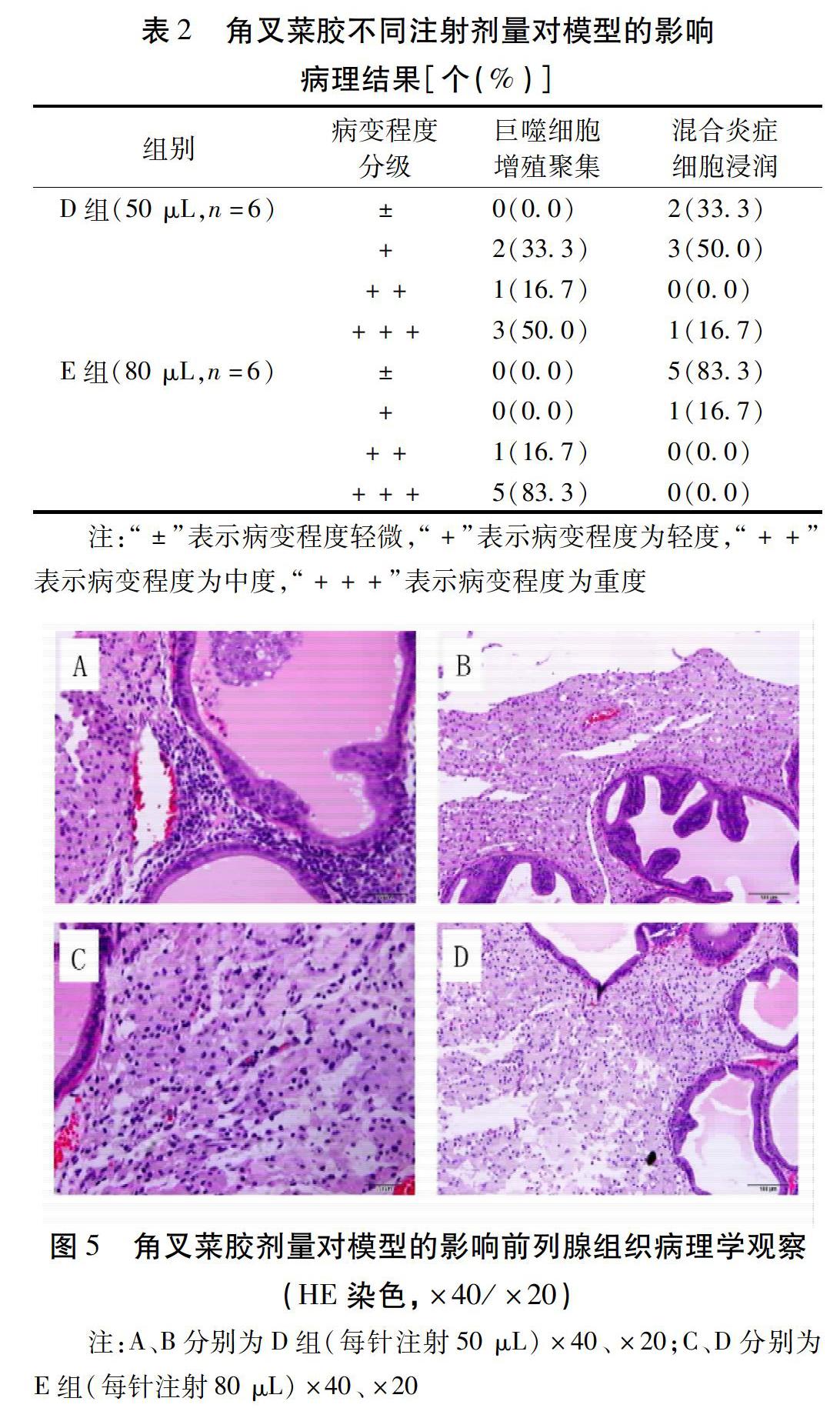
1.2.1 分组与模型制备 1)角叉菜胶生理盐水溶液的配制与模型制备方法。将0.1 g角叉菜胶定容于10 mL生理盐水中,配制成1%角叉菜胶生理盐水溶液。同理配置其他浓度角叉菜胶生理盐水溶液。溶液全程在洁净工作台上配置并储存于无菌离心管中。参考Yang等[5]的造模方法,用1%戊巴比妥钠溶液腹腔注射(剂量:50 mg/kg)麻醉大鼠,用剃毛器剔除大鼠下腹部被毛。在无菌条件下,用聚维酮碘消毒大鼠腹部皮肤,于下腹部正中开约2 cm的纵切口,逐层打开后找到膀胱,将膀胱轻轻挑起,用1 mL无菌注射器将角叉菜胶生理盐水溶液注入前列腺中。注射完毕后将脏器归位,在伤口处滴适量抗生素以预防感染,逐层缝合肌肉、皮肤,用聚维酮碘消毒伤口并将伤口周围的血迹擦净,再将大鼠放回笼内,并对大鼠手术伤口和整体状态进行密切观察。2)角叉菜胶不同注射部位对模型的影响实验分组。将12只大鼠采用随机数字表法按体质量随机分为A、B、C3个不同注射部位组,均采用文献报道最小浓度即1%角叉菜胶生理盐水进行注射。A组:前列腺左、右腹侧叶各注射50 μL。B组:前列腺背侧叶注射100 μL。C组:前列腺左、右腹侧叶各注射50 μL,背侧叶注射100 μL。在注射7 d后取材观察病理指标,技术路线见图1。3)角叉菜胶不同注射剂量对模型的影响实验分组。将12只大鼠采用随机数字表法按体质量随机分为D、E 2个不同注射剂量组,根据“角叉菜胶不同注射部位对模型的影响实验”结果,选取A组方案作为注射部位使用方案,同时提升注射浓度为3%并增加注射点为每侧2针,其中,D组每针注射量为50 μL;E组每针注射量为80 μL。注射7 d后取材观察病理指标,技术路线见图2。4)角叉菜胶不同注射浓度对模型的影响及模型稳定性评价实验分组。综合上述2个实验的研究结果,将33只大鼠采用随机数字表法按体质量随机分为F、G、H3组,分别给予1%、3%、5%角叉菜胶生理盐水溶液,于前列腺左、右腹侧叶各注射角叉菜胶溶液50 μL。在注射7 d后进行模型评价,并观察注射后第21天、第35天的模型稳定性,技术路线见图3。
1.2.2 检测指标与方法 大鼠麻醉后取下前列腺组织,放入组织固定液固定24 h,根据HE染色标准化操作流程,进行乙醇梯度脱水、二甲苯透明、浸蜡,石蜡包埋,制成3~5 mm切片,HE染色后在光学显微镜下观察前列腺组织病理形态。
1.3 统计学方法 对病理结果进行频数和百分比统计。
2 结果
2.1 角叉菜胶不同注射部位对模型的影响 由于手术造成动物死亡,12只大鼠取材后共获得合格样本9个。其中,左、右腹侧叶注射组(A组)100%出现了腹侧叶巨噬细胞增殖聚集改变,同时50%的大鼠出现腹侧叶混合炎症细胞浸润;仅注射背侧叶组(B组)有33.3%出现背侧叶巨噬细胞增殖聚集现象,亦有33.3%的巨噬细胞增殖聚集现象出现于腹侧叶;左、右腹侧叶及背侧叶同时注射组(C组)仅在腹侧叶出现了巨噬細胞增殖聚集和混合炎症细胞浸润,但3组的病理表现均为轻微或轻度。见表1、图4。由此可见,A组方案即左、右腹侧叶注射组病理一致性较好,但由于注射浓度及剂量较小,故病变程度较轻。
2.2 角叉菜胶不同注射剂量对模型的影响 当每针注射50 μL时(D组),大鼠前列腺同时出现巨噬细胞增殖聚集及混合炎症细胞病理改变,且分布相对均衡;每针注射80 μL时(E组),有83.3%的大鼠出现了重度巨噬细胞增殖聚集及轻微的混合炎症细胞浸润。见表2、图5。因此,每针注射50 μL更能体现慢性前列腺炎的炎症状态。
2.3 角叉菜胶不同注射浓度对模型的影响及模型稳定性评价结果 造模7 d后,G组1只因前列腺组织与腹腔粘连,未取获取合格组织样本;H组在造模手术后死亡1只,故最终纳入合格大鼠13只。其中,注射1%角叉菜胶(F组)的病理改变最轻,注射3%角叉菜胶(G组)和5%角叉菜胶(H组)的病理改变均大于1%角叉菜胶组,且以3%角叉菜胶注射组(G组)的模型一致性较好。见表3、图6。对各组模型稳定性进行评价,研究结果可知,在注射角叉菜胶21 d后,不同浓度组病理改变基本相当;在注射角叉菜胶35 d后,各组均有一定程度的病理改变,其中注射3%角叉菜胶组病理改变的持续性最好。故该模型在造模21 d后和35 d后仍具有稳定性,且注射3%角叉菜胶组(G组)的模型稳定性最佳。见表4、图7。
3 讨论
3.1 角叉菜胶致大鼠CP常用制备方案 目前虽然有较多研究在使用角叉菜胶致大鼠CP模型,但其中具体的实验参数却不尽相同。由于大鼠前列腺分为腹侧叶(左右各一)及背侧叶,故注射部位及取材部位的选择尤为重要,同时,不同文献报道了不同的注射剂量和注射浓度以及不同的成模周期和稳定性[5-16]。因此,经查阅相关文献,将常用的角叉菜胶致大鼠CP模型制备方法及观察内容进行总结。见表5。并在此基础上设计并开展了本项研究工作。
3.2 角叉菜胶不同注射部位、剂量、浓度对CP模型的影响 通过研究可以看出,角叉菜胶不同注射部位、不同注射剂量以及不同注射浓度对大鼠慢性前列腺炎模型的最终形成均存在一定程度的影响。
在注射部位的选择上,因大鼠前列腺有左、右腹侧叶与背侧叶之分,不仅需要考虑注射角叉菜胶后病理改变的一致性,实验操作流程的便捷性和规范性也值得关注。从本实验可以看出,腹侧叶是角叉菜胶注射的理想位置。由于腹侧叶靠近膀胱两侧,大鼠开腹后视野暴露良好,相较背侧叶操作简便,能够有效避免因翻转膀胱寻找背侧叶所致的腹腔脏器牵拉,同时在病理表现上,单纯注射腹侧叶时各鼠病理改变相对一致。在实验中还发现,无论是巨噬细胞增殖聚集,还是混合炎症细胞浸润,前列腺组织病理改变往往发生在角叉菜胶的注射部位附近,不易在全部前列腺中扩散,因此在实际操作过程中,左、右两腹侧叶侧注射时位置应相对对称,在进行模型评价及药物干预研究中,也应选取注射部位附近的前列腺组织进行观察,以保证实验结果的真实性和可靠性。
在角叉菜胶注射剂量的选择上,文献报道中常见总注射剂量介于20~200 μL之间,腹侧叶总的注射量为100 μL,发现引起的炎症反应很轻,造成的模型难以评价药效,故选择了总注射量为200 μL(每针50 μL)。我们还对更高剂量(即总共320 μL,每针80 μL)进行了探究,前期预试发现若每针大于100 μL则可能导致溶液渗出,故选取了每针50 μL和100 μL中间的一个量,即80 μL。为了让角叉菜胶更均匀地分布于前列腺组织,本研究优化了注射方法,运用了多点注射法,分别于左、右腹侧叶各注射2针,在每侧叶上1/3处和下1/3处进针,针尖朝向该叶中部进行注射,由于大鼠前列腺组织有一定的韧性,故在操作时应当平稳进针、缓慢推注,以免造成角叉菜胶漏出或对前列腺组织造成损害。操作流程规范化后,角叉菜胶能够均匀注入大鼠前列腺组织中,且不会产生渗漏,保证了注射量的稳定性。通过比较每针50 μL和80 μL对模型的影响,我们可以看到,每叶各注射50 μL时,大鼠的病理表现更为均衡,也更能体现慢性前列腺炎的炎症状态。因此,我们最终确立了在左、右腹侧叶各注射2针,每针50 μL,合计200 μL的注射方法。
在角叉菜胶注射浓度的选择上,文献报道中多为1%和3%,我们对更高浓度5%也进行了探究,故设计了1%、3%、5%3个浓度组,研究结果显示3%的病理结果一致性较好。1%浓度的角叉菜胶造成的炎症反应较轻,在后续的药物干预实验中,不便于评价药物的疗效;5%浓度的角叉菜胶比较黏稠,容易出现抽取到注射器时较困难和溶解度不佳的问题,最终影响了模型的病理评价。
关于模型的成模时间及稳定性,文献报道中以注射后7 d成模为多,观察节点最迟在注射后30 d。我们在实验中对此进行了验证,发现在注射7 d后能成功制作该模型,模型在注射后第21天和注射后第35天仍有较好的稳定性,故得出该模型成模后至少能维持4周,在药物干预实验中能满足给药4周以内的要求。
综合研究结果,应用角叉菜胶诱导的大鼠CP模型时,最优方案为用3%角叉菜胶生理盐水向前列腺左、右腹侧叶各注射两针,每针50 μL,手术7 d后能制作成较稳定的CP模型,且该模型能维持至少4周。
3.3 CP模型制备中的其他关键因素 本研究除了考察角叉菜胶注射部位、剂量、浓度及模型稳定性因素之外,对于影响CP模型制备的其他关键因素也进行了总结和思考。首先,在大鼠种属选择上,虽然SD大鼠、Wistar大鼠、Lewis大鼠、Wistar大鼠、Copenhagen大鼠均有报道用以制備CP模型,但本研究最终选取SD大鼠,是因为相较其他4种大鼠,其自发CP的概率较低,能够避免自发性CP发生对模型建立的影响[17],且SD大鼠具有较好的适应性和抗病能力,能够更好地耐受手术创伤。其次,在CP临床患者观察中,其病理表现主要为混合炎症细胞浸润[18-19],而角叉菜胶诱导所致的CP大鼠模型则表现为以巨噬细胞增殖聚集为主,伴有散在混合炎症细胞浸润的病理改变,存在一定的物种差异。这是由于慢性前列腺炎为非特异性慢性炎症,又以单核巨噬细胞系统的激活作为重要特征[20],由于混合炎症细胞浸润直接反映机体对损伤的持续炎症反应,故在临床中为慢性前列腺炎的典型病理表现。而混合炎症细胞包含单核细胞、淋巴细胞、浆细胞,单核巨噬细胞系统包括血液中的单核细胞和组织中的巨噬细胞,故在大鼠CP模型中,出现了以巨噬细胞增殖聚集为主,伴有散在混合炎症细胞浸润的现象,因此在评价大鼠CP病理表现时,不能简单地与临床CP病理表现相对应,需加以区别应用。与此同时,病理观察时显微镜物镜的放大倍数对于观察大鼠前列腺组织的炎症表现也存在一定的影响,我们初期根据常规观测倍数采用物镜放大40倍进行观察,但视野偏小,后期通过调整发现,物镜放大倍数为20倍时即可清晰观察病变部位,且视野更广,更便于病理结果的评价,故采用物镜放大倍数为20倍较为适宜。
本研究所采用的角叉菜胶是从红藻中提取而得到的一种多糖,含有多个重复的D-半乳糖与3,6-无水-D-半乳糖,平均分子量大于100 kDa[21],是诱导非特异性炎症的经典试剂。除应用角叉菜胶进行CP诱导之外,还有以下几种CP模型的常用建立方法。1)化学性诱导CP模型:如Lang等[22]使用化学刺激物(乙醇和二硝基苯磺酸)来去除前列腺黏膜内表面的屏障作用,诱导大鼠无菌性前列腺炎的发生;2)自发性CP模型:如Naslund等[23]研究发现,Lewis大鼠和Wistar大鼠均可自发CP,且前者的发病率高于后者;3)去势结合雌激素诱导CP模型:Wilson等[24]和Kamijo等[25]采用大鼠去势加雌二醇诱导CP发生;4)自身免疫反应诱导CP模型:如Jackson等[26]利用不同鼠种研究探索自身免疫性建模方式在不同群种鼠类上的特异性等。此4种模型分别针对CP不同的发病原因和发病机制而设,在特殊类型的CP模型構建中常被使用。由于角叉菜胶诱导的化学性CP模型造模方法较简单,建模成本低,成模时间短,仅需7 d,受其他因素的干扰较少,故在实验中更为常用[27]。
此外值得注意的是,在造模手术中,应严格执行无菌操作,注意避免脏器牵拉,不要损伤膀胱等重要脏器,缝合前应将各脏器归回原位。手术用纵切口比横切口能减少出血量,手术缝合完毕后,应该用聚维酮碘仔细消毒,并将血迹擦干净,防止大鼠嗅到气味后,咬断缝合线。如果手术中损伤了膀胱等脏器,或出血较多,或血迹未擦干净等均会增加大鼠感染和死亡的概率,因此,熟练的操作技术和对细节的把控对于角叉菜胶致CP模型的成功制备具有重要意义。
CP作为临床常见疾病,积极开展基础研究,探寻其发病机制、寻找有效治疗手段具有重要的临床意义和研究价值。动物模型是开展基础研究的前提,本研究针对角叉菜胶致大鼠CP模型制备中的关键因素进行了探索,明确了角叉菜胶注射部位、剂量、浓度等对CP模型的影响,并在最优因素组合基础上评价了模型的稳定性,同时针对CP大鼠模型制备中的难点问题进行了思考,为CP整体动物水平的研究提供简便、可靠、易于推广应用的动物模型。在未来的研究中,我们将进一步关注角叉菜胶致大鼠CP模型的宏观、微观指标变化,通过对比临床CP患者与大鼠CP模型的异同点找到可能的干预靶标,为CP的发病机制研究及新药研发提供更多实验室依据和数据支撑。
参考文献
[1]Schaeffer EM.Re:Contemporary Management of Chronic Prostatitis/Chronic Pelvic Pain Syndrome[J].J Urol,2017,197(5):1275-1276.
[2]米华,陈凯,莫曾南.中国慢性前列腺炎的流行病学特征[J].中华男科学杂志,2012,18(7):579-582.
[3]Pontari MA,Ruggieri MR.Mechanisms in prostatitis/chronic pelvic pain syndrome[J].J Urol,2004,172(3):839-845.
[4]张斌斌,白安胜.慢性前列腺炎的病因、发病机制及治疗新进展[J].新医学,2014,45(2):83-87.
[5]Yang X,Yuan L,Chen J,et al.Multitargeted protective effect of Abacopteris penangiana against carrageenan-induced chronic prostatitis in rats[J].J Ethnopharmacol,2014,151(1):343-351.
[6]Hajighorbani M,Ahmadi-Hamedani M,Shahab E,et al.Evaluation of the protective effect of pentoxifylline on carrageenan-induced chronic non-bacterial prostatitis in rats[J].Inflammopharmacology,2017,25(3):343-350.
[7]Chen RZ,Cui L,Guo YJ,et al.In vivo study of four preparative extracts of Clematis terniflora DC.for antinociceptive activity and anti-inflammatory activity in rat model of carrageenan-induced chronic non-bacterial prostatitis[J].J Ethnopharmacol,2011,134(3):1018-1023.
[8]Wang W,Chen R,Wang J.Procyanidin B2 ameliorates carrageenan-induced chronic nonbacterial prostatitis in rats via anti-inflammatory and activation of the Nrf2 pathway[J].Biochem Biophys Res Commun,2017,493(1):794-799.
[9]Zhang K,Zeng X,Chen Y,et al.Therapeutic effects of Qian-Yu decoction and its three extracts on carrageenan-induced chronic prostatitis/chronic pelvic pain syndrome in rats[J].BMC Complement Altern Med,2017,17(1):75.
[10]Zeng F,Chen H,Yang J,et al.Development and validation of an animal model of prostate inflammation-induced chronic pelvic pain:evaluating from inflammation of the prostate to pain behavioral modifications[J].PLoS One,2014,9(5):e96824.
[11]utulovi'c N,Gruba ,uvakov S,et al.Chronic prostatitis/chronic pelvic pain syndrome increases susceptibility to seizures in rats and alters brain levels of IL-1β and IL-6[J].Epilepsy Res,2019,153:19-27.
[12]Chen CS,Chang PJ,Lin WY,et al.Evidences of the inflammasome pathway in chronic prostatitis and chronic pelvic pain syndrome in an animal model[J].Prostate,2013,73(4):391-397.
[13]Radhakrishnan R,Nallu RS.Development and characterisation of a novel animal model of prostate inflammation-induced chronic pelvic pain[J].Inflammopharmacology,2009,17(1):23-28.
[14]侯巧燕,杨成芳,张均智,等.茅莓对大鼠前列腺炎模型病理改变的影响[J].中国老年学杂志,2009,29(24):3217-3218.
[15]黄宝星,曹万里,黄欣,等.大鼠慢性前列腺炎模型中TRPA1及相关炎症介质的表达[J].中华男科学杂志,2015,21(1):23-30.
[16]戴苏林,朱进,魏秀德,等.前列腺康栓对大鼠实验性非菌性前列腺炎的抑制作用[J].中成药,1990,12(8):27-28.
[17]Vykhovanets EV,Resnick MI,MacLennan GT,et al.Experimental rodent models of prostatitis:limitations and potential[J].Prostate Cancer Prostatic Dis,2007,10(1):15-29.
[18]王強,薛德彬.前列腺病理活检解读[M].5版.北京:北京科学技术出版社,2018:9.
[19]郭应禄,李宏军.前列腺炎[M].北京:人民军医出版社,2007:204-206.
[20]步宏,李一雷.病理学[M].9版.北京:人民卫生出版社,2018:79-80.
[21]韩冬,孙良杏.百精抗痨颗粒药效学研究[J].中国药物经济学,2014,9(1):39-40.
[22]Lang MD,Nickel JC,Olson ME,et al.Rat model of experimentally induced abacterial prostatitis[J].Prostate,2000,45(3):201-206.
[23]Naslund MJ,Strandberg JD,Coffey DS.The role of androgens and estrogens in the pathogenesis of experimental nonbacterial prostatitis[J].J Urol,1988,140(5):1049-1053.
[24]Wilson MJ,Woodson M,Wiehr C,et al.Matrix metalloproteinases in the pathogenesis of estradiol-induced nonbacterial prostatitis in the lateral prostate lobe of the Wistar rat[J].Exp Mol Pathol,2004,77(1):7-17.
[25]Kamijo T,Sato S,Kitamura T.Effect of cernitin pollen-extract on experimental nonbacterial prostatitis in rats[J].Prostate,2001,49(2):122-131.
[26]Jackson CM,Flies DB,Mosse CA,et al.Strain-specific induction of experimental autoimmune prostatitis(EAP) in mice[J].Prostate,2013,73(6):651-656.
[27]于宜平,张艳,李红,等.黄芩苷对角叉菜胶致热大鼠解热作用的PK-PD模型研究[J].中草药,2014,45(4):527-531.
(2020-08-31收稿 责任编辑:张雄杰)

