多孢木霉HZ-31菌株对藜的生理生化特性的影响
蔺泽荣,朱海霞
(青海省农林科学院,农业部西宁作物有害生物科学观测实验站,青海省农业有害生物综合治理重点实验室,青海 西宁 810016)
藜(Chenopodiumalbum)为一年生草本植物,广泛分布于田间,生长速度快,生命力顽强,种子数量大,与作物争夺营养物质,且是某些土壤害虫的寄主[1-2],是危害作物正常生长的主要杂草之一.
从自然感病的大刺儿菜中分离得到的菌株HZ-31发酵液对阔叶杂草有较好的除草效果[20].木霉属真菌种类众多、分布广泛,在农业、工业和环境修复领域应用广泛[3],由于其具有显著的生物防治效果和重要的生物应用价值,被公认为是一种可取代化学药品的农作物保护剂.杨榕等[4]的研究结果表明,长枝木霉MF-2对黄瓜幼苗有促生作用.王腾等[5]的研究结果表明,板栗外生菌根真菌螺旋木霉和钩状木霉有拮抗13种以上病原菌的作用,具有广谱性,可选为生物菌剂的潜力菌种.木霉次生代谢产物的化学多样性是其有效生物防治潜力的来源[6-7].本试验中多孢木霉HZ-31作为大刺儿菜的病原真菌,应用于田间杂草有广谱的除草作用,具有生防除草的潜力[8-9].
在植物代谢过程中,叶绿体、线粒体和质膜上的电子传递都可能产生活性氧(ROS),如超氧阴离子(O2-)、羟自由基(OH·)、过氧化氢(H2O2)等[10-20].植物受到寒冷、干旱、盐害和病原物侵染等危害时,植物体内会产生活性氧,但是过量或者缺乏活性氧含量都会影响植物的生理变化,而病原物侵入植物的反应是以酶含量的变化或中间产物的介入来实现的.El Alaoui-Talibi等[12,21]研究表明,多酚氧化酶(PPO)和过氧化物酶(POD)是重要的抗性催化合成酶,不仅可加速酚类化合物质量的氧化,而且参与植物的抗病性.在植物正常生命活动代谢中,植物体内的防御酶类系统都会产生清除活性氧的酶类,避免由活性氧的积累破坏植物膜系统而影响植物正常生长[11].
本研究以青海省常见的田间杂草藜作为研究对象,菌株HZ-31作为致病因子,探究病原物在对寄主的致病过程中寄主植物体内的生理酶和蛋白酶的变化,借此来探索除草机理.通过测定防御蛋白酶POD、过氧化氢酶(CAT)、PPO、苯丙氨酸解氨酶(PAL)和超氧化物歧化酶(SOD)变化,探究接种病原物后植物体内产生酚类物质和氧化物对病原物的抵抗或抑制作用;通过测定叶绿素含量和可溶性糖含量的变化来观察植物受病原物刺激后表现出的抗性和生长现象;通过测定丙二醛(MDA)含量变化来反应植物受病原物入侵后其细胞膜的受损情况.
1 材料与方法
1.1 供试菌株
多孢木霉HZ-31由青海省农科院植保所有害生物综合防治实验室,从自然感病的大刺儿菜上分离得到,并保存于该实验室[5].
1.2 试验方法
1.2.1 HZ-31发酵液制备 将实验室保存的多孢木霉HZ-31接种于PDA培养基中活化,25 ℃条件下培养箱培养5 d,用打孔器(Φ=8 mm)打菌饼接于PDB中,每250 mL三角瓶接5个菌饼,每个处理重复3次,在25 ℃的摇床中昼夜交替培养7 d,待用.
1.2.2 HZ-31发酵液接种藜试验 将青海省农林科学院试验地(E 101.74°,N 36.56°)田间生长6~12叶期,叶色正常的藜(灰藜)幼苗移栽于直径15 cm花盆中,于实验室内培养一周.将HZ-31发酵液稀释成浓度为1.0×108个/mL的孢子悬浮液,加入适量0.05%吐温-20作为润湿剂,喷雾接种到移栽的健康藜植株上,接种量为30 mL/盆.接种后于100%的相对湿度下保持24 h,随后自然培养,接种无菌PDB的植株作为空白对照.分别在接种后1~7 d取样,随机挑选两株,每株采取3片叶片,每个处理重复3次,置于-80 ℃冰箱冷冻.
1.2.3 HZ-31菌株对藜植株生理机制的影响 按照酶活试剂盒(南京建成生物工程研究所生产)步骤,进行HZ-31菌株接种藜后植株体内丙二醛(MDA)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活力、多酚氧化酶(PPO)活力、苯丙氨酸解氨酶(PAL)活力、超氧化物歧化酶(SOD)活力、可溶性糖含量和叶绿素含量的测定.
1.2.4 数据处理 运用Excel 2010和SPSS 19.0进行统计分析,采用Duncan新复极差法进行差异显著性分析.
2 结果与分析
2.1 多孢木霉HZ-31菌株侵染对藜生长的影响
多孢木霉HZ-31菌株侵染对藜生长具有显著的影响,接种HZ-31菌株3 d后,藜植株出现轻度萎蔫(图1-A);接种5 d后,萎蔫程度加重,叶片侵染部位失绿变白(图1-B),7 d后受侵染植株叶片失绿变白程度加重(图1-C).
2.2 藜的生理机制变化
2.2.1 丙二醛(MDA)含量的变化 多孢木霉HZ-31侵染藜后,对照组藜MDA含量呈“M”型变化,最大为1.74 nmol/mg;处理组MDA含量先上升至最大4.62 nmol/mg,1~4 d内处理组藜MDA含量高于对照组然后开始下降,最大增幅67.91%.
2.2.2 过氧化氢酶(CAT)活力的变化 多孢木霉HZ-31侵染藜后,对照组藜CAT活力呈“升-降-升-降-升-降-升”的变化趋势,最高达6.23 U/mg;处理组藜CAT活力第1天开始缓慢上升,至最大5.70 U/mg,比对照增加81.88%;第5天开始呈“V”型变化趋势,前4 a内处理组藜CAT活力低于对照组,4天后处理组藜CAT活力显著高于对照组.

A:藜接种3 d后的生长状况;B:藜接种5 d后的生长状况;C:藜接种7 d后的生长状况.A:Growth status of Chenopodium album at 3 days after inoculation;B:Growth status of Chenopodium album at 5 days after inoculation;C:Growth status of Chenopodium album at 7 days after inoculation.图1 藜接种HZ-31发酵液后的生长状况Figure 1 Growth status of Chenopodium album inoculated with HZ-31 fermentation broth

图2 多孢木霉HZ-31处理后藜的丙二醛含量变化Figure 2 Changes of malondialdehyde content of Chenopodium album after Trichoderma polysporum HZ-31 treatment
2.2.3 过氧化物酶(POD)活力的变化 多孢木霉HZ-31侵染藜后,对照组和处理组藜POD活力处于平稳变化状态,且处理组始终高于对照组,最大增加46.44%,第7天后开始下降.
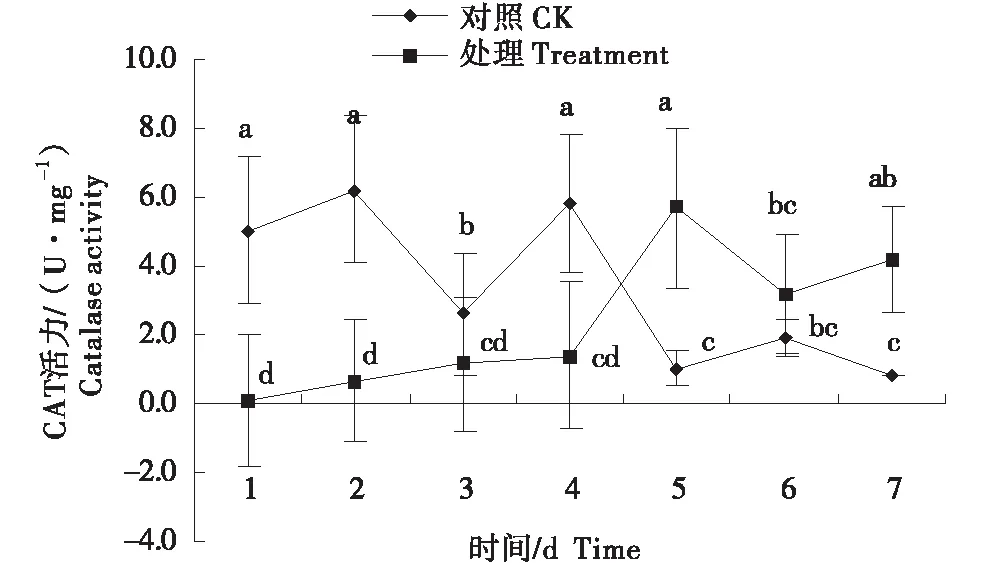
图3 多孢木霉HZ-31处理后藜的过氧化氢酶活力的变化Figure 3 Changes of catalase activity of Chenopodium album after Trichoderma polysporum HZ-31 treatment

图4 多孢木霉HZ-31处理后藜的过氧化物酶活力变化Figure 4 Changes of peroxidase activity of Chenopodium album after Trichoderma polysporum HZ-31 treatment
2.2.4 多酚氧化酶(PPO)活力的变化 图5显示,接种菌株HZ-31后,对照组藜PPO活力呈“N”型变化趋势,第3天达到最大峰值,为2.61 U/g;处理组藜PPO活力变化趋势和对照组相似,比对照显著增加,迅速达到酶活性峰值,为2.78 U/g,第3天开始缓慢下降,第6天后又呈现出上升趋势,处理组始终高于对照组,最大增幅37.68%.

图5 多孢木霉HZ-31处理后藜的多酚氧化酶活力的变化Figure 5 Changes of polyphenol oxidase activity of Chenopodium album after Trichoderma polysporum HZ-31 treatment
2.2.5 苯丙氨酸解氨酶(PAL)活力的变化 图6显示,接种菌株HZ-31后,对照组和处理组藜PAL活力在1~3 d内变化平稳,且变化趋势相似,从第1天开始处理组藜的PAL活力高于对照组,第4天达到最大值72.21 U/g,且处理组PAL活力显著增加,最大增幅为78.62%.
2.2.6 可溶性糖含量的变化 图7显示,藜接种菌株HZ-31后,对照组藜的可溶性糖含量呈“倒N”型变化,第5天达到峰值,为21.74 mg/g;处理组藜可溶性糖含量呈上升趋势,第4天达到峰值,为26.30 mg/g,第4天后开始下降;处理组始终高于对照组,最大增幅为69.37%.

图6 多孢木霉HZ-31处理后藜的苯丙氨酸解氨酶活力变化Figure 6 Changes of phenylalanine ammonia lyase activity of Chenopodium album after Trichoderma Polysporum HZ-31 Treatment

图7 多孢木霉HZ-31处理后藜的可溶性糖含量的变化Figure 7 Changes of soluble sugar content of Chenopodium album after Trichoderma polysporum HZ-31 treatment
2.2.7 叶绿素含量的变化 图8显示,藜接种菌株HZ-31后,对照组藜叶绿素含量变化幅度大,第4天达到峰值,为6.98 mg/g.处理组藜叶绿素含量变化较平稳,呈现下降趋势,3~6 d内处理组叶绿素含量低于对照组,最大降幅68.04%.
2.2.8 超氧化物歧化酶(SOD)活力的变化 图9显示,多孢木霉HZ-31侵染藜后,第3天开始对照组和处理组藜SOD活力均呈“W”型变化,处理组在第3天达到峰值,为220.86 U/mg,且处理组SOD活力高于对照组,最大增加8.12%.藜受菌株HZ-31刺激后SOD迅速增强,保护酶浓度升高,第6天后对照组与处理组均呈现增长趋势,且对照组变化快于处理组.

图8 多孢木霉HZ-31处理后藜的叶绿素含量变化Figure 8 Changes of chlorophyll content of Chenopodium album after Trichoderma polysporum HZ-31 treatment

图9 多孢木霉HZ-31处理后藜的超氧化物歧化酶活力变化Figure 9 Changes of superoxide dismutase activity of Chenopodium album after Trichoderma polysporum HZ-31 treatment
3 讨论与结论
接种HZ-31菌株后,迫使藜体内的生理系统发生变化,随着接种时间的增长,变化趋势显著.各处理的MDA含量和PPO活性均显著高于对照,且最大分别提高了67.91%和37.68%,说明防御系统产生抗性机制抵御外界刺激的伤害;叶绿素第3天后低于对照,说明藜被侵染后逐渐失绿而不能正常生长;PAL呈先升高后下降的变化,且始终高于对照,表明藜始终受体内PAL的保护,浓度越高效果越好.藜的细胞组织被破坏,叶片逐渐黄化,最终枯萎死亡.本研究中MDA 含量受刺激后逐渐降低,这与赵戴军等[19]的研究结果相符合.SOD主要是与POD和CAT等协同作用的,由CAT通过乙醛酸循环体、线粒体和过氧化物酶体将H2O2进一步氧化成H2O和O2,清除病原物侵染植物后所产生的活性氧.本研究中,各处理CAT活力显著高于对照,这与李培玲等[15]的研究结果一致.POD含量平稳变化且始终高于对照,而SOD呈“W”变化且显著高于对照,这与陆建英等[16]研究结果一致,刺激能增加POD酶和SOD酶的含量.本研究中,藜叶片受HZ-31菌株刺激后,PPO酶的活性呈现先增加后降低,然后再增加的变化趋势,这与张艺萍等[22]研究中报道的防御酶活性提高,增强了植物抵抗逆境的能力的论点略有差异,可能与取样的时间和地点有一定的关系.藜可溶性糖含量呈先增加后降低再增加的变化趋势,但处理始终高于对照,这与李张等[18]的研究结果相反,这可能是因为菌液的浓度较高引起的差异.
多孢木霉HZ-31菌株侵染藜后,其生理机制防御酶变化如下:过氧化物酶(POD)活力、苯丙氨酸解氨酶(PAL)活力、超氧化物歧化酶(SOD)活力和可溶性糖含量一直高于对照组,分别增加46.44%、72.21%、8.12%和69.37%.随着防御酶活性升高,防御能力也逐渐增强.过氧化氢酶(CAT)活力、多酚氧化酶(PPO)活力和丙二醛(MDA)含量先升高后降低,说明藜受菌株HZ-31侵染后防御酶被激活,增强了对侵染的防御能力,随着侵染程度的增强,防御酶活含量降低,活力减弱,细胞膜损害程度加重,植物体对外界的抵抗力减弱.叶绿素含量持续降低,说明藜被侵染后光合作用受到抑制,导致叶片失绿.

