玉米-豆粕型饲料非淀粉多糖酶谱及酶解条件优化研究
刘志云,杨叶梅,官小凤,黄 萍,周晓容
(1重庆市畜牧科学院,重庆 荣昌 402460;2农业农村部养猪科学重点实验室,重庆 荣昌402460)
非淀粉多糖(non-starch polysaccharide,NSP)是指植物中所含的除淀粉之外的多糖类物质,主要包括纤维素、半纤维素和果胶等,是植物性饲料的主要抗营养因子之一。研究表明,添加NSP酶可特异性地降解饲料中的NSP,提高饲料养分利用率、改善动物肠道健康、提高动物生产性能、降低养殖成本、改善养殖环境[1-4]。除上述作用外,采用特定NSP酶对植物源饲料原料进行适度酶解,还能够产生对致病菌有抑制作用的低聚糖及其他未知产物,NSP酶的酶谱组成、酶解条件及饲料酶解程度决定了酶解产物类别及其抑菌作用的强弱。桂玲等[5]用半纤维素酶对大豆膳食纤维进行酶解,发现大豆膳食纤维的酶解液对大肠杆菌、假单孢菌、金黄色葡萄球菌均具有明显的抑菌效果。贺阳洋[6]研究发现,果胶经90 min酶解,酶解率达到71%时,酶解液的抑菌活性最强,继续酶解至120 min时抑菌效果消失,表明不同程度的酶解产物性质具有很大差异性。Chimtong等[7]以糖棕榈皮渣、苹果皮渣、茶叶渣、咖啡渣、啤酒糟、椰子粕、稻秸等农副资源作为酶解底物,用木聚糖酶、淀粉酶、β-葡聚糖酶、纤维素酶、甘露聚糖酶和果胶酶组成的复合酶制剂制备低聚糖,所获得的产物对乳杆菌具有促生长作用,对大肠杆菌具有抑制作用。用NSP酶降解饲料时,日粮组成、NSP酶活性及酶谱组成都与降解效果有很大关系[8]。玉米-豆粕型日粮是我国生猪、肉鸡等养殖中最常见的日粮类型,由木聚糖酶、β-葡聚糖酶、纤维素酶、果胶酶、β-甘露聚糖酶组成的复合酶在玉米-豆粕型日粮中的应用较为常见。何科林等[8]的研究表明,由木聚糖酶、β-葡聚糖酶、纤维素酶、果胶酶、β-甘露聚糖酶组成的NSP复合酶,可以提高玉米-豆粕型日粮的离体消化能。刘胜利等[9]研究表明,木聚糖酶、β-葡聚糖酶、纤维素酶、β-甘露聚糖酶、α-半乳糖苷酶、果胶酶可以显著提高肉鸡玉米-豆粕-杂粕型日粮中的还原糖释放量和干物质消化率。然而利用NSP酶对畜禽生产中的混合饲料进行适当酶解,在降低饲料中NSP含量、提高体外消化率的基础上,提高饲料抑菌活性的研究较为少见。为此,本试验以纤维素酶、果胶酶、木聚糖酶、葡聚糖酶和甘露聚糖酶为供试酶,以玉米-豆粕型饲料为底物,在探讨其酶谱组成的基础上,以低聚糖含量、抑菌效果以及酶解饲料的体外干物质消化率为指标对酶解条件进行了优化,以期为研发玉米-豆粕型酶解饲料提供理论依据。
1 材料与方法
1.1 材 料
玉米-豆粕型饲料的原料玉米、豆粕、麦麸来源于重庆市畜牧科学院科研基地,饲料组成为m(玉米)∶m(豆粕)∶m(麦麸)=67.6∶28.9∶3.5,原料粉碎后过孔径0.85 mm筛,按照料(kg)水(L)比为1∶3的比例加水,搅拌均匀后用于酶解试验。
纤维素酶,购自上海易恩化学技术有限公司,实测酶活为8 660 U/g;木聚糖酶、果胶酶、β-葡聚糖酶,购自和氏璧生物技术有限公司,实测酶活分别为18 670, 41 330和16 670 U/g;β-甘露聚糖酶,购自卡迈舒(上海)生物科技有限公司,实测酶活为3 670 U/g。
供试菌种有大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonella)、植物乳杆菌(Lactobacillusplantarum)、蜡样芽胞杆菌(Bacilluscereus),均由重庆市畜牧科学院养猪科学重点实验室分离保存。
防霉剂,购自黑龙江康泰生物科技开发有限公司,主要成分为双乙酸钠和丙酸钙。
1.2 玉米-豆粕型饲料的NSP酶谱筛选
采用L18(37)表进行正交试验设计,以还原糖含量为评价指标,筛选纤维素酶(A)、木聚糖酶(B)、果胶酶(C)、β-葡聚糖酶(D)和β-甘露聚糖酶(E)降解玉米-豆粕型饲料的最佳酶谱。正交试验因素及水平见表1。各处理组的酶解条件均为37 ℃封口静置培养24 h。
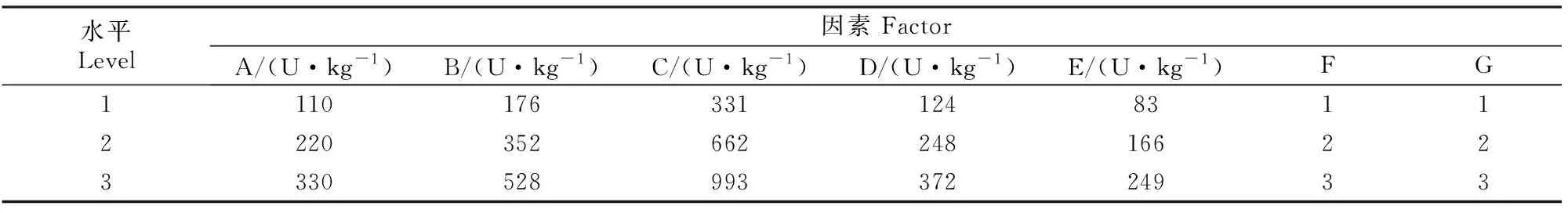
表1 NSP酶谱筛选L18(37)正交试验设计的因素与水平Table 1 Factors and levels of enzymatic pattern screening L18(37) orthogonal test for non-starch polysaccharide enzymes
1.3 酶解温度对酶解效果的影响
将上述试验筛选出的最佳酶谱与酶解底物充分混匀,分别在35,45,55和65 ℃酶解1 h后,取样测定酶解样品中的还原糖含量。每个温度设3个重复。
1.4 酶解时间对酶解效果的影响
在最适的酶解温度下,用筛选的NSP酶酶谱对饲料进行酶解,分别于0(CK),3,6,9,12,15,18,21和24 h时迅速取样,每个时间点设3个重复,冷冻干燥后测定酶解饲料样中的可溶性糖、还原糖、低聚糖含量及体外干物质消化率(IVDMD)。测定不同酶解时间样品对大肠杆菌的抑制能力,确定对大肠杆菌抑菌能力最强的酶解时间,并测定该时间点酶解饲料样品对沙门氏菌、植物乳杆菌和蜡样芽孢杆菌的抑制能力。
1.5 酶解饲料与添加防霉剂饲料贮存期限对比
按优化后的酶解条件制备酶解饲料。分别取普通饲料、酶解饲料以及添加质量分数0.05%和0.10%防霉剂的饲料各20 g放置于锥形瓶中,按料(g)水(mL)比为1∶3的比例加入蒸馏水,混合均匀,敞口放置于恒温(25 ℃)恒湿(65%)培养箱中,每天记录饲料的气味、腐败变质情况,放置2 d后取样测定其霉菌、大肠杆菌和细菌总菌落数,同时测定贮存前普通饲料的菌落数。
1.6 指标测定
1.6.1 还原糖、可溶性糖和低聚糖含量的测定 准确称取5 g酶解饲料样品,加入适量蒸馏水充分振荡混合30 min,过滤收集滤液,并用蒸馏水冲洗滤渣,将滤液和滤渣冲洗液一起定容至100 mL,即得饲料酶解原液。取5 mL饲料酶解原液,用DNS比色法测定还原糖含量,用蒽酮比色法测定可溶性糖含量。低聚糖含量测定参照李燕[10]的方法并作修改:取30 mL饲料酶解原液放置于2 KD透析袋内,于蒸馏水中低温(4 ℃)透析48 h,中间换水3~4次,收集袋内溶液定容至50 mL,采用蒽酮比色法测定透析袋内溶液的糖含量,用下式计算低聚糖含量:低聚糖含量=可溶性糖平均含量-还原糖平均含量-透析袋内糖平均含量。
1.6.2 抑菌能力的测定 按照上述方法制备饲料酶解原液100 mL,4 ℃浓缩至5 mL,备用。大肠杆菌经斜面培养后,用无菌水配成细菌含量为107CFU/mL的菌悬液,备用。采用牛津杯法测定饲料酶解液对大肠杆菌的抑菌能力:吸取100 μL大肠杆菌菌悬液均匀涂布于琼脂培养基平板上,然后打孔,在孔中加入100 μL的饲料酶解浓缩液,将平板放入4 ℃冰箱过夜,随后放置于37 ℃培养箱中培养24 h,测定饲料酶解液对供试菌种的抑菌圈直径,以未经酶解的饲料样品浓缩液作为对照(CK)。取对大肠杆菌抑菌能力最强的时间点的酶解产物,测定其对沙门氏菌、植物乳杆菌、蜡样芽孢杆菌的抑菌圈直径,测定方法同上。
1.6.3 IVDMD的测定 采用胃蛋白酶-胰蛋白酶两步法对酶解饲料进行离体消化,参考侯小锋[11]的方法测定酶解饲料的IVDMD。
1.6.4 菌落计数 在超净工作台中称取不同饲料样品各1 g,与等量无菌生理盐水充分振荡混合,静置20 min后,取上清进行10倍梯度稀释。取0.1 mL稀释液置于无菌平皿中,然后在不同平皿中分别倾注15~20 mL的营养琼脂、麦康凯琼脂和孟加拉红琼脂培养基,每个稀释度设置3个重复。待琼脂凝固后,将营养琼脂培养基和麦康凯琼脂培养基放置于培养箱内37 ℃培养48 h,用于细菌总数、大肠杆菌计数;将孟加拉红琼脂培养基放置于培养箱内28 ℃培养5 d,用于霉菌计数。选取菌落数在25~250的适宜稀释度的平皿进行菌落计数,根据稀释度换算每g饲料样品的菌落数(CFU),结果取平均值。
1.7 数据处理
采用SPSS 19.0软件对试验数据进行单因素方差分析,用Duncan’s法进行多重比较检验,以P<0.05为差异显著。
2 结果与分析
2.1 玉米-豆粕型饲料的NSP酶谱筛选
玉米-豆粕型饲料NSP酶酶解L18(37)正交试验结果见表2。由表2中极差(R)值可知,5种NSP酶对饲料还原糖含量的影响从大到小依次为果胶酶、β-葡聚糖酶、纤维素酶、木聚糖酶、β-甘露聚糖酶。最佳酶组合为A1B3C3D3E3,即纤维素酶110 U/kg,木聚糖酶528 U/kg,果胶酶993 U/kg,β-葡聚糖酶372 U/kg,β-甘露聚糖酶249 U/kg。
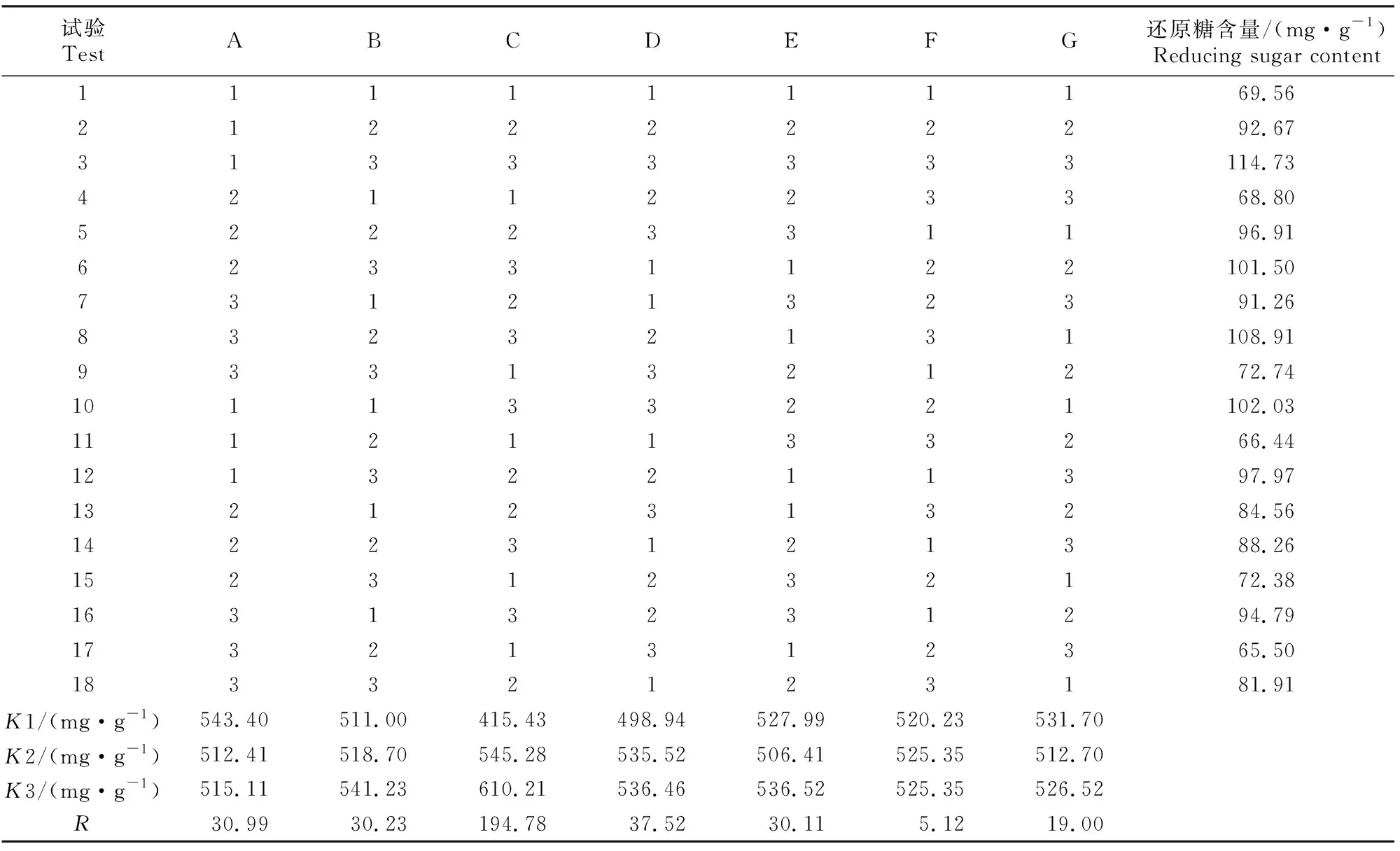
表2 玉米-豆粕型饲料NSP酶酶解L18(37)正交试验结果Table 2 The L18(37) orthogonal test result of NSP enzyme hydrolysis of corn-soybean feed
2.2 酶解温度对饲料酶解效果的影响
NSP酶解温度对玉米-豆粕型饲料中还原糖含量的影响如表3所示。由表3可知,温度对饲料中NSP的酶解效果有显著影响(P<0.05),随着温度的升高,饲料中还原糖的含量呈现先升高后降低的趋势,当处理温度为55 ℃时,酶解样中还原糖含量最高(17.98 mg/g)。因此,在后续试验中选择55 ℃为最优的酶解温度。
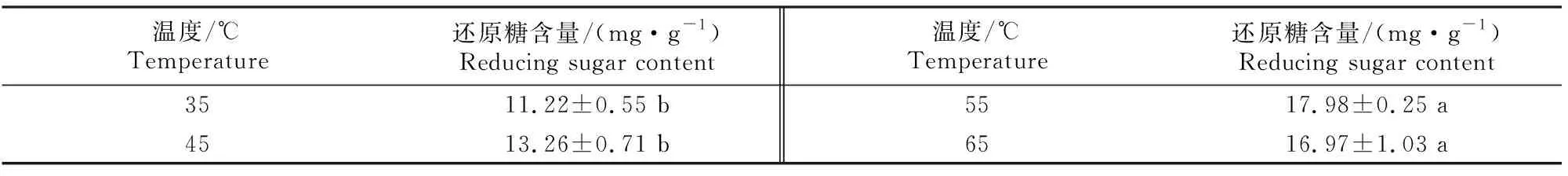
表3 NSP酶解温度对玉米-豆粕型饲料中还原糖含量的影响Table 3 Effect of NSP enzyme hydrolysis temperature on reducing sugar content in corn-soybean feed
2.3 酶解时间对饲料酶解效果的影响
2.3.1 不同糖组分含量 NSP酶解时间对玉米-豆粕型饲料中不同糖组分含量的影响如表4所示。由表4可知,在55 ℃下酶解9 h以内时,饲料酶解液中的可溶性糖、还原糖和低聚糖含量均呈明显的增加趋势,在酶解9 h之后可溶性糖和还原糖含量仍持续增加,但低聚糖含量降低并维持在一定的区间内。
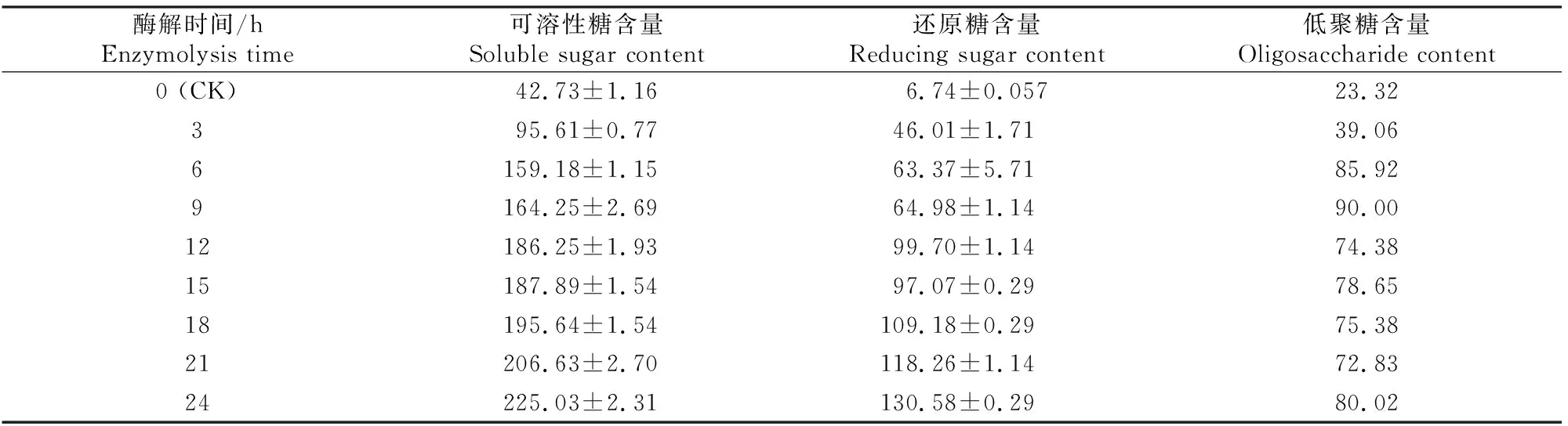
表4 NSP酶解时间对玉米-豆粕型饲料中不同糖组分含量的影响Table 4 Effects of NSP enzyme hydrolysis time on sugar composition in corn-soybean feed mg/g
2.3.2 抑菌效果 玉米-豆粕型饲料用NSP酶解不同时间的酶解液对大肠杆菌的抑制效果如表5所示。由表5可以看出,NSP酶解0~9 h时饲料对大肠杆菌无明显抑制作用,酶解12 h时开始产生抑菌效果,酶解15 h时的抑制效果最优,之后抑菌效果开始逐渐下降。酶解15 h的饲料对沙门氏菌、植物乳杆菌、蜡样芽胞杆菌也表现出了不同程度的抑制效果,抑菌圈直径分别为33.62,38.54和42.68 mm。

表5 玉米-豆粕型饲料用NSP酶解不同时间的酶解液对大肠杆菌的抑制效果Table 5 Inhibitory effect of corn-soybean feed NSP hydrolysates at different enzymolysis times on Escherichia coli
2.3.3 酶解饲料的IVDMD 由图1可知,随着酶解时间的延长,饲料的IVDMD呈升高趋势,酶解15 h时饲料的IVDMD显著高于CK(P<0.05),由CK的49.52%提高至54.23%;酶解18~24 h时,IVDMD进一步升高,但与酶解15 h时无显著差异。结合2.3.1和2.3.2节结果综合分析认为,NSP酶解的最佳时间为15 h。
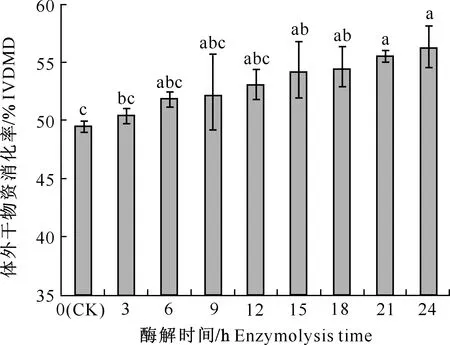
柱上标不同字母表示处理间差异显著(P<0.05)Different letters indicate significant differences between treatments (P<0.05)图1 酶解时间对饲料体外干物质消化率(IVDMD)的影响 Fig.1 Effects of enzymolysis time on in vitro dry matter digestibility (IVDMD)
2.4 酶解饲料与添加防霉剂饲料贮存期限的比较
将普通饲料、酶解饲料及添加质量分数0.05%和0.10%防霉剂的饲料加入一定比例蒸馏水后于室温环境中贮存,贮存起始添加防霉剂的饲料略微有丙酸的刺激性味道,酶解饲料则具有淡淡的饴糖甜味。贮存2 d后,普通饲料开始局部变黑,产生酸腐味,呈现粥糊样(图2-A);酶解饲料未出现明显的腐败变质现象,上清液澄清(图2-B);添加0.05%防霉剂饲料也有少量变黑并发出酸腐味,呈现粥糊样(图2-C);添加0.10%防霉剂饲料未出现明显腐败变质现象(图2-D)。
酶解饲料和添加防霉剂饲料的菌落计数结果如表6所示,由表6可知,酶解饲料中的细菌总数和大肠杆菌数均明显低于普通饲料和添加防霉剂饲料;酶解饲料中检出了霉菌,且从菌丝形态初步判断主要为青霉菌,而普通饲料和添加防霉剂饲料均未检出霉菌。普通饲料未检出霉菌的原因可能是:细菌生长周期短、繁殖速度快,因而能够很快成为优势菌,从而暂时抑制了霉菌的生长。
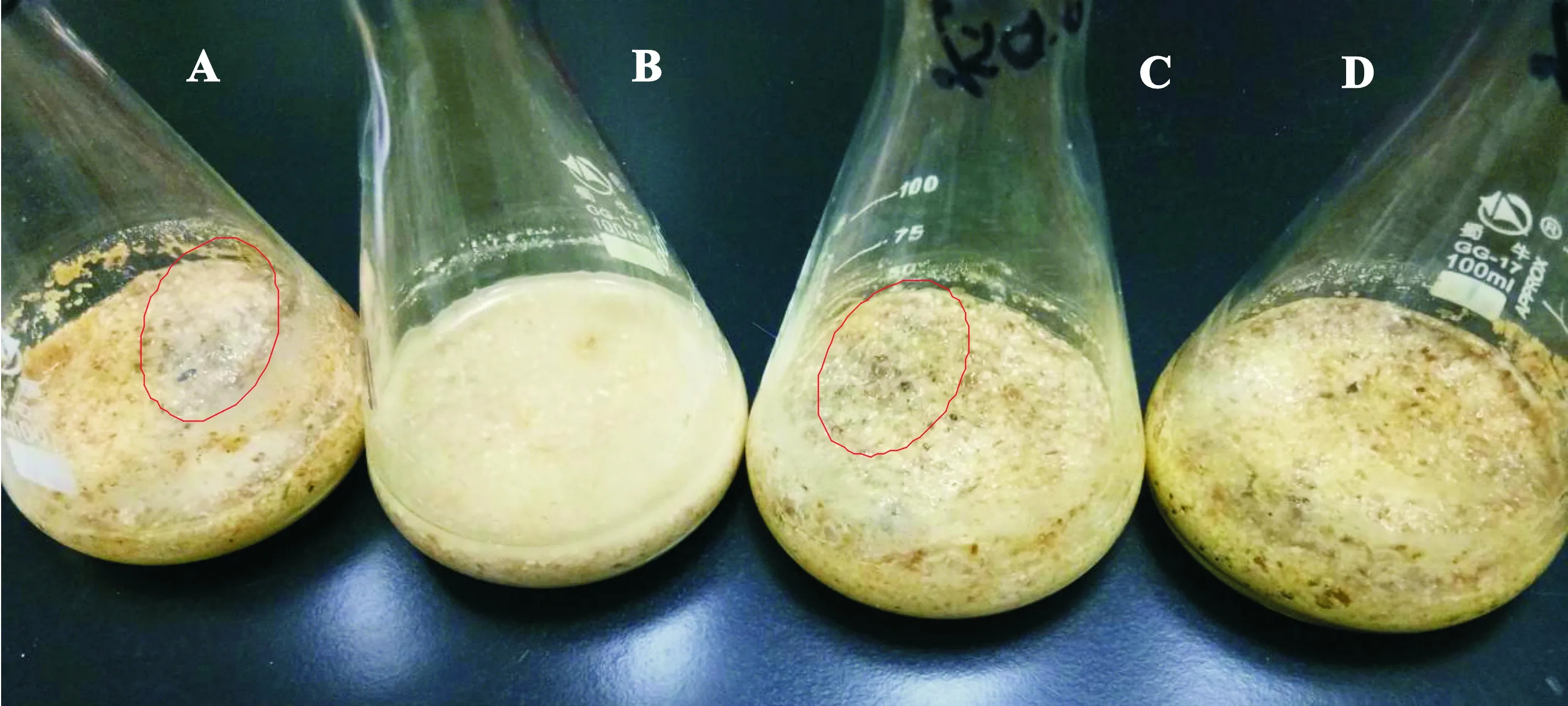
A.普通饲料;B.酶解饲料;C.添加0.05%防霉剂饲料;D.添加0.10%防霉剂饲料A.Ordinary feed;B.Enzymatic hydrolyzed feed;C.Feed with 0.05% Antiseptic;D.Feed with 0.10% Antiseptic图2 不同处理饲料在室温下放置2 d后的表观特征Fig.2 Apparent traits of feed in different treatments for 2 days at room temperature
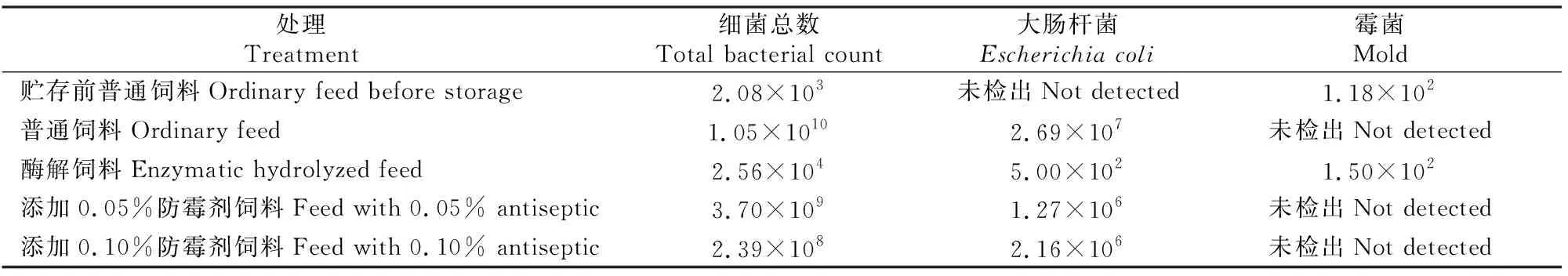
表6 NSP酶酶解与防霉剂抑菌效果的比较Table 6 Comparison of antibacterial effect of enzymolysis products and antiseptic CFU/g
3 讨 论
NSP是植物源饲料原料的重要组成部分,可溶性NSP会导致猪和家禽表现出明显的抗营养作用,且由NSP造成的能量损失也不容小觑。饲料中添加NSP酶能特异性降解NSP,提高饲料养分利用率,降低NSP的抗营养作用。但如果酶的选择不适宜或者酶解程度较低,则会造成生产成本高和资源浪费;若酶解过度,饲料中的NSP被大量降解成单糖,则有利于大肠杆菌和沙门菌等有害菌群的生长,对饲料的营养价值提升和保存并无裨益。因此,针对不同的饲料组成筛选适宜的NSP酶谱,同时控制酶解程度,以获得特定功能的酶解产物,对于开发饲料新功能、提升饲料自身潜力有重要意义。
目前,关于NSP酶在玉米-豆粕型饲料上的离体试验研究主要集中在提高饲料干物质体外消化率[9,12-13]、离体消化能[8,14]、还原糖含量[9,15]以及降低消化液相对黏度[15]等方面,而往往忽视了NSP酶解中间增值产物的变化规律及其生物学功能。本试验以玉米、豆粕、麦麸(质量比为67.6∶28.9∶3.5)组成的混合饲料原料作为NSP酶的底物,筛选出了最佳的NSP酶谱,即纤维素酶110 U/kg,木聚糖酶528 U/kg,果胶酶993 U/kg,β-葡聚糖酶372 U/kg,β-甘露聚糖酶249 U/kg,酶解后的饲料还原糖含量显著提高。在此基础上又重点研究了不同酶解时间对饲料酶解产物中不同糖组分含量的影响,结果表明,在酶解过程中,可溶性糖和还原糖含量随着酶解时间的增加始终呈增加趋势,而低聚糖含量则随酶解时间的延长呈先升高后略降低并趋于稳定的变化规律(本研究采用的低聚糖测定方法不能严格代表低聚糖的真实含量,但可体现其变化趋势)。酶解饲料的抑菌活性变化规律与低聚糖含量的变化基本一致,即饲料酶解12 h时开始对大肠杆菌表现出抑制作用,15 h时抑菌圈直径最大,此后随酶解的进一步进行,抑菌作用不再增强。李学红等[16]研究表明,酶解到一定程度的果胶具有良好的抑菌活性,推测其有效抑菌成分为一些低分子量的聚半乳糖醛酸。章银军等[17]研究发现,不同酶解时间获得的柑橘果胶低聚糖的抑菌活性不同,认为只有酶解到一定程度的果胶低聚糖才能表现出很好的抑菌活性。王晓华[18]采用超高压结合木聚糖酶法处理麦麸膳食纤维,得到麦麸低聚糖酶解液,通过抑菌试验发现,麦麸低聚糖对大肠杆菌、金黄色葡萄球菌及枯草芽孢杆菌具有抑菌效果。据此推测,本研究中饲料酶解产物的抑菌作用主要与NSP酶解产生的低聚糖和低分子多糖有关。为了进一步验证酶解饲料的抑菌特性,本试验还对酶解饲料与添加防霉剂饲料的贮存效果进行了比较研究,结果表明饲料经本方法酶解处理后细菌总数和大肠杆菌数明显下降,抑菌效果优于添加防霉剂组;但贮存2 d的酶解饲料中检测出少量青霉菌,而普通饲料和防霉剂饲料均未检出霉菌。
除了上述体外抑菌作用,饲料的NSP酶解产物在动物上也表现出对肠道致病菌的抑制作用,进而促进动物生长。Kiarie等[19-20]研究表明,豆粕、菜籽粕、小麦麸以及亚麻籽粕NSP复合酶(果胶酶、纤维素酶、甘露聚糖酶、木聚糖酶、葡聚糖酶、半乳聚糖酶)酶解饲料上清液冻干粉,在体外可以维持产肠毒性大肠杆菌(ETEC)感染仔猪的体液平衡,有利于控制ETEC引起的仔猪肠道感染性腹泻,并认为酶解产物中发挥此功能的物质主要是低聚糖和低分子质量的多糖。在后续试验中,Kiarie等[21-22]将麦麸、豆粕、菜籽粕和亚麻籽粕(质量比为4∶4∶1∶1)组成的混合饲料经NSP酶解后制备酶解产物冻干粉,用该冻干粉饲喂21 d断奶仔猪,结果发现冻干粉可以促进仔猪采食,提高平均日增重,降低血清结合珠蛋白水平,缓解ETEC(k88)攻毒引起的仔猪急性时相反应,降低肠道pH值,提高回肠黏膜附着乳酸菌数,改善胃肠道发酵特性和形态特征。Jia等[23]研究表明,在含亚麻籽的肉鸡日粮中添加复合NSP酶制剂,可以促进产气荚膜梭菌感染肉鸡的病后代偿性生长,这可能是由于添加复合NSP酶提高了亚麻籽粕中的水溶性NSP酶解产物含量所致。本研究结果仅为NSP酶解饲料的体外试验效果,其在动物体内的功效尚需进一步研究。
4 结 论
筛选出玉米-豆粕型饲料的适宜酶谱为:纤维素酶110 U/kg,木聚糖酶528 U/kg,果胶酶993 U/kg,β-葡聚糖酶372 U/kg,β-甘露聚糖酶249 U/kg。最佳酶解条件为:酶解温度为55 ℃,酶解15 h。在此条件下制得的酶解饲料具有较高的低聚糖含量(78.65 mg/g),对大肠杆菌、沙门氏菌、蜡样芽孢杆菌、植物乳杆菌均有较好的抑制效果,IVDMD基本达到平稳状态;贮存过程中,酶解饲料的细菌抑制能力较普通饲料和加入防霉剂的饲料明显提高。

