乌鲁木齐市售畜禽肉源大肠杆菌的耐药性分析
唐雪林,佟盼盼,张萌萌,张 凌,马晓玉,马 蕊,谢金鑫,苏战强
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
大肠杆菌(Escherichiacoli)是国际上公认的水体和食品卫生检测指示菌,也是反映革兰氏阴性菌对抗菌药物敏感性的指标菌。大肠杆菌本质上对所有抗生素敏感,但临床治疗和畜禽养殖过程中抗菌药物的滥用,导致大肠杆菌产生了严重的耐药性,已成为全球公共卫生问题之一[1-2]。大肠杆菌既可以通过自身染色体突变获得耐药基因,也可以通过质粒、整合子、转座子和基因盒等遗传元件水平转移获得耐药基因[3]。
食源性动物是大肠杆菌耐药菌的储存库,作为载体大肠杆菌可以将耐药基因传递给其他致病菌或通过食物链传给人类[4-5]。针对β-内酰胺类、喹诺酮类、氨基糖苷类、磺胺类以及四环素类药物的耐药基因均可由质粒介导传播,并可以通过质粒进行积累[6]。已有研究表明,与其他食源性大肠杆菌的耐药率相比,畜禽肉源分离株的耐药率普遍偏高[7-8]。国外研究人员对食源性大肠杆菌进行耐药表型测定发现,大肠杆菌多呈多重耐药表型,且对四环素和氨苄西林表现出较高的耐药率,对阿米卡星、头孢他啶、庆大霉素和环丙沙星等表现出低耐药率[9]。研究还发现,不同来源大肠杆菌的耐药率存在差异,且来自家禽肉和猪肉的大肠杆菌耐药率更高[10]。
目前关于新疆畜禽肉源大肠杆菌的耐药性研究相对较少。因此,本研究对乌鲁木齐市售畜禽肉品中大肠杆菌的耐药性及耐药基因的流行特点进行了分析,旨在为当地肉类食品的耐药性及耐药基因监测和防控提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 样品来源 2019年6-8月,从乌鲁木齐市沙依巴克区、水磨沟区、新市区等19家超市共采集动物肌肉样品353份,其中鸡肉90份、猪肉90份、牛肉84份、羊肉89份。
1.1.2 培养基与质控菌 EC肉汤(E.coliBroth)、麦康凯琼脂培养基(MAC)、LB琼脂培养基(Luria-Bertani Agar)、水解酪蛋白肉汤(MH Broth),均购自青岛高科技工业园海博生物技术有限公司;科玛嘉尿道菌群定位显色培养基,购自上海欣中生物工程有限公司;质控菌株大肠杆菌ATCC25922和肺炎克雷伯菌ATCC700603由本实验室保存。
1.1.3 试 剂 TaKaRaTaq、dNTP Mixture及2 000 DL Marker,均购自宝生物工程(大连)有限公司;Gelred核酸染料购自美国Biotium公司;乙二胺四乙酸、Tris碱、氯化钠、氢氧化钠、冰醋酸、丙三醇、无水乙醇等,购自广州化学试剂厂;氨苄西林、阿莫西林-克拉维酸、头孢噻肟、头孢他啶、头孢吡肟、哌拉西林-他唑巴坦、氨曲南、庆大霉素、氨苄西林-舒巴坦、阿米卡星、左氧氟沙星、环丙沙星、四环素、复方新诺明、氯霉素、多粘菌素B、链霉素和哌拉西林药敏纸片,购自杭州滨和微生物试剂有限责任公司。
1.2 大肠杆菌的分离和鉴定
根据采样地点的具体情况,在超市的生鲜产品摊位采集3~5份畜禽肉,分别置于无菌密封袋中,低温运送至实验室。采用无菌操作的方法取2 g肉接种到10 mL无菌EP管中,加入5 mL灭菌EC肉汤,37 ℃恒温摇床培养过夜;将培养后菌液划线于MAC平板,14~16 h后挑取红色、圆形、表面光滑的单菌落划线科玛嘉尿道菌群定位显色培养基;37 ℃恒温培养14~16 h,挑取桃红色单菌落划线接种于LB平板上,进行菌种鉴定等后续试验。利用大肠杆菌16S rDNA特异性引物进行PCR鉴定[11],引物序列见表1。PCR反应体系(25 μL):10×rTaqbuffer 2.5 μL,dNTP mixture 2.0 μL,上、下游引物各1 μL,rTaq酶0.125 μL,模板1 μL,加超纯水至25 μL。PCR反应程序:95 ℃预变性3 min;98 ℃变性10 s,52 ℃退火5 s,72 ℃延伸1 min,循环30次;72 ℃终延伸10 min。取5 μL PCR扩增产物经1.2%琼脂糖凝胶电泳检测,通过凝胶成像系统拍照分析。阳性菌置于质量分数20%甘油的生理盐水中,于-80 ℃保存备用。
1.3 大肠杆菌的系统发育分群分析
1.3.1 细菌DNA模板制备 采用加热煮沸法提取菌株DNA,将大肠杆菌在LB平板上培养12 h,取少量细菌加入含0.5 mL 1×TE的1.5 mL EP管中混匀,隔水煮沸裂解10 min,冰浴5 min,10 000 r/min离心2 min,取上清为模板,-20 ℃保存备用。
1.3.2 引物合成 根据文献[12],选择适用于大肠杆菌系统发育分群的基因arpA、chuA、yjaA、TspE4.C2、ArpAgpE、trpAgpC和trpBA进行扩增,相应地将大肠杆菌分为A、B1、C、E、D、F和clade Ⅰ群。各基因引物序列见表1,由上海生工生物工程有限公司合成。
1.3.3 四重PCR扩增 四重PCR反应(arpA、chuA、yjaA、TspE4.C2)体系25 μL:10×rTaqbuffer 2.5 μL,dNTP mixture 2.0 μL,上、下游引物各0.5 μL,rTaq酶0.125 μL,模板1 μL,加超纯水至25 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,循环30次;72 ℃终延伸10 min。取5 μL PCR扩增产物经1.2%琼脂糖凝胶电泳检测,通过凝胶成像系统拍照分析。在四重PCR中若arpA和yjaA扩增结果同时为阳性,则继续用trpAgpC基因筛选大肠杆菌所属群;若arpA和chuA,arpA、chuA和TspE4.C2,arpA、chuA和yjaA扩增结果均为阳性,则继续用ArpAgpE基因筛选大肠杆菌所属群;同时扩增trpBA作为内部对照,根据文献[12]方法判定结果。

表1 大肠杆菌16S rDNA和系统发育分群基因的引物序列Table 1 Primers sequences of E. coli 16S-rDNA and phylogenetic grouping genes
1.4 大肠杆菌的耐药表型检测
1.4.1 药敏试验 根据CLSI-2016版执行标准,采用K-B(Kirby-Bauer)纸片琼脂扩散法对大肠杆菌进行耐药表型检测。将菌株分为耐药(resistance,R)、中介(intermediate,I)和敏感(susceptible,S)[13]3类。
1.4.2 超广谱β-内酰胺酶(ESBLs)表型确认 采取双纸片协同试验检测产ESBLs菌株:同时使用头孢他啶(30 μg)和头孢他啶/克拉维酸(30/10 μg)及头孢噻肟(30 μg)和头孢噻肟/克拉维酸(30/10 μg)2对药敏纸片,当头孢他啶和头孢噻肟中有任何一个抑菌环直径与加克拉维酸的抑菌环差值≥5 mm时,即判定为产ESBLs[13]。以大肠杆菌ATCC25922和肺炎克雷伯菌ATCC700603为质控菌。
1.5 大肠杆菌耐药基因的检测
1.5.1 引物合成 对具有耐药表型的菌株进行耐药基因检测,所检测的耐药基因包括抗β-内酰胺类药物的基因(blaCTX-M、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9、blaTEM和blaSHV)、抗四环素类药物的基因(tetA、tetG和tetE)、抗氨基糖苷类药物的基因(aac和aadA1)、抗磺胺类药物的基因(sul1)和抗氯霉素类药物的基因(cml1),其引物序列见表2,由上海生工生物工程股份有限公司合成。
1.5.2 PCR扩增 PCR反应体系与1.2节相同,PCR反应程序:94 ℃预变性4 min;94 ℃变性30 s,54~69 ℃(具体退火温度依引物而定,见表2)退火30 s,72 ℃延伸45 s,循环30次;72 ℃终延伸10 min。取5 μL PCR 扩增产物经1%琼脂糖凝胶电泳检测,用凝胶成像分析系统观察结果,阳性产物送至上海生工生物工程有限责任公司进行测序,测序结果进行BLAST对比分析确定基因型亚型。
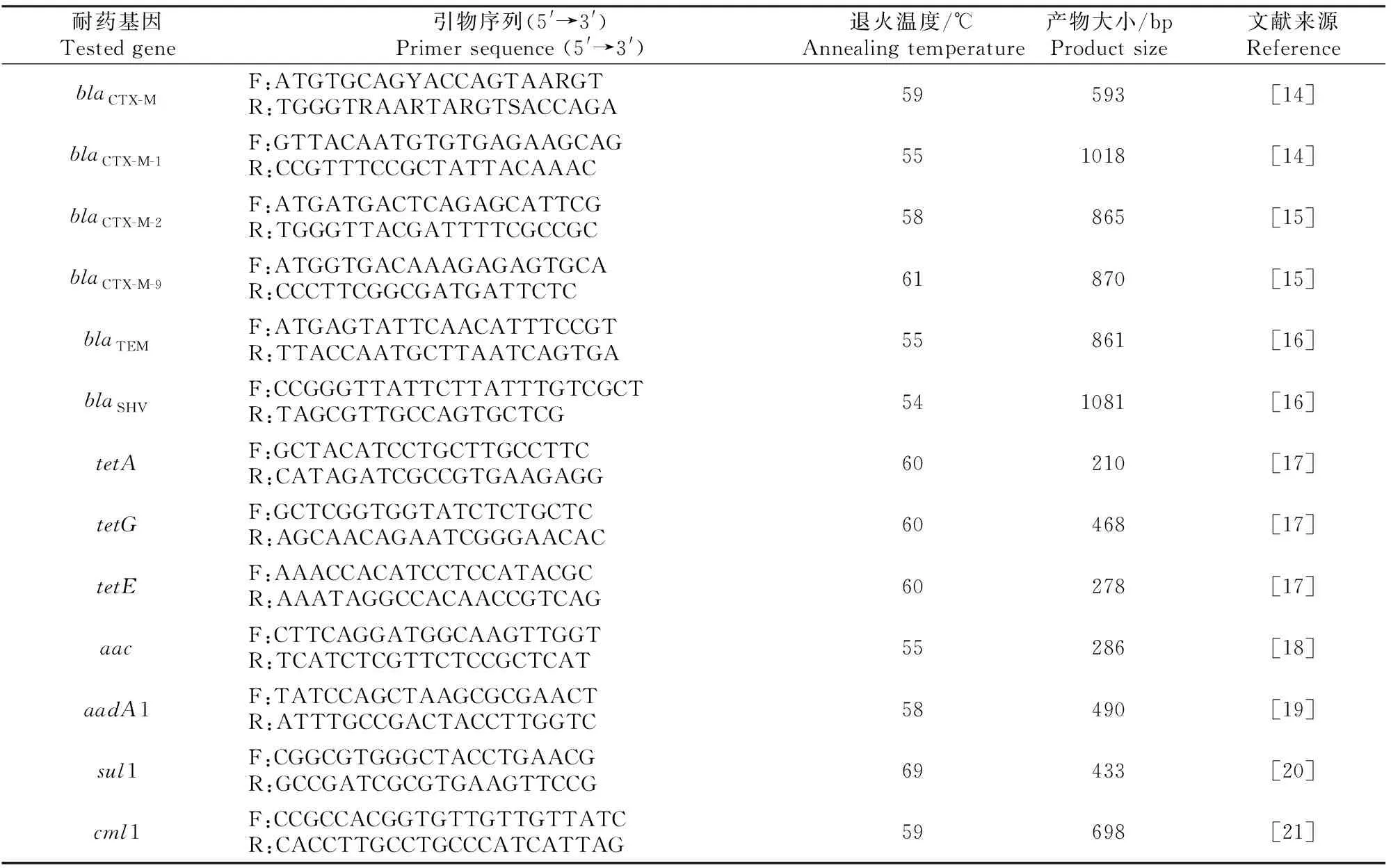
表2 试验检测的耐药基因及其引物序列Table 2 Tested genes and there primer sequences
2 结果与分析
2.1 乌鲁木齐畜禽肉源大肠杆菌的分离鉴定
从乌鲁木齐市7区19家超市采集的353份新鲜畜禽肉样中,分离鉴定得到252株大肠杆菌,具体分离结果如表3所示。由表3可知,天山区超市采集的畜禽肉样品中大肠杆菌的分离率最高(90.9%),经济开发区超市采集的畜禽肉样品中大肠杆菌的分离率最低(50.0%);不同畜禽肉源的大肠杆菌分离率也不同,羊肉源大肠杆菌分离率最高(76.4%),其次是猪肉源(72.6%)、鸡肉源(66.7%),牛肉源大肠杆菌的分离率最低(65.5%)。

表3 乌鲁木齐畜禽肉源大肠杆菌的分离结果Table 3 Isolation of Escherichia coli from livestock and chicken meat in supermarkets in Urumqi
2.2 乌鲁木齐畜禽肉源大肠杆菌的系统发育分群
通过多重PCR对252株大肠杆菌进行系统发育分群,结果(图1)显示,有240株可归属为A、B1、D、E和F群,12株为未知分群组。且以A群占优势(79.4%),B1群次之(12.3%),而D、E和F群相对较少。此外,B1群在牛肉分离株中的分布数量最多,猪肉分离株中未知分群组的菌株最多。
2.3 乌鲁木齐畜禽肉源大肠杆菌耐药表型和ESBLs表型确认
耐药表型测定结果(图2)显示,鸡肉分离株以1耐和3耐为主,猪肉分离株以3耐和4耐为主,牛肉分离株以5耐为主,羊肉分离株以3耐为主。
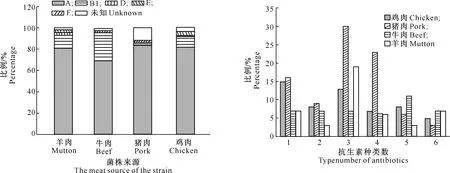
图1 乌鲁木齐畜禽肉源大肠杆菌分离株的系统进化分群Fig.1 Phylogenetic grouping of E. coli isolates from livestock and chicken meat in supermarkets in Urumqi
由表4可知,252株受试菌株对四环素(49.6%)、氨苄西林(41.6%)、复方新诺明(30.9%)和氯霉素(26.6%)的耐药率较高;对哌拉西林、庆大霉素和链霉素的耐药率分别是20.6%,16.7%,15.5%;对头孢噻肟、环丙沙星、阿莫西林-克拉维酸、左氧氟沙星、氨曲南和头孢他啶的耐药率分别是7.9%,7.9%,5.9%,5.5%,4.4%和3.9%;对阿米卡星(1.9%)、多粘菌素B(0.8%)和氨苄西林-舒巴坦(0.4%)的耐药率较低;对第四代头孢菌素头孢吡肟和哌拉西林-他唑巴坦敏感。39株菌为产ESBLs菌株。

表4 乌鲁木齐畜禽肉肉源大肠杆菌分离株对18种抗菌药物耐药表型的检测结果Table 4 Phenotype test of E. coli isolates from livestock and chicken meat sources in Urumqi supermarkets against 18 antimicrobial drugs
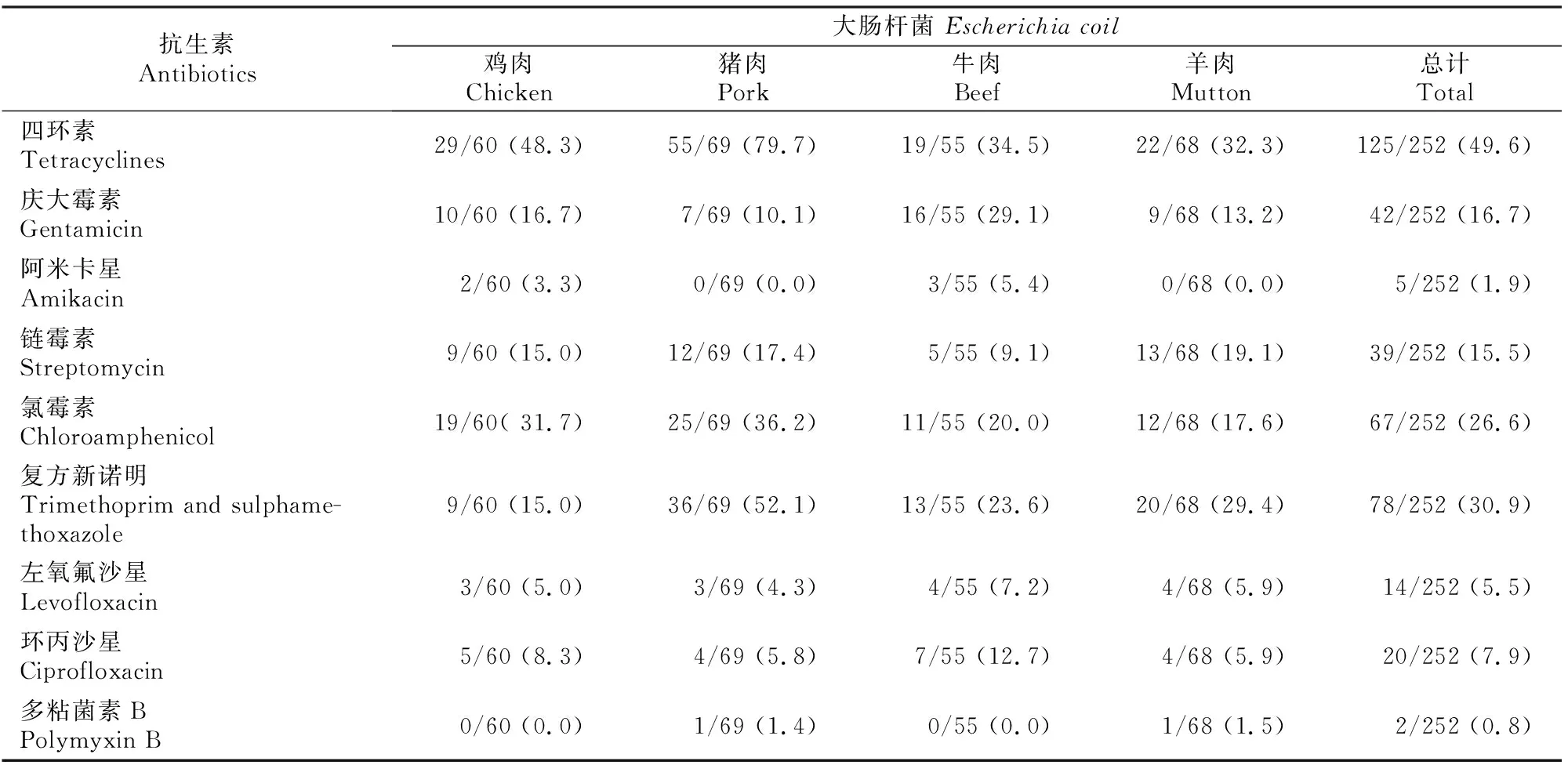
表4(续) Continued table 4
2.4 乌鲁木齐畜禽源大肠杆菌耐药基因的检测
乌鲁木齐畜禽肉源大肠杆菌耐药基因检测结果见表5。由表5可见,125株四环素类耐药菌中有113株携带tetA基因,其中羊肉源分离株检出率高达95.4%,未检测到tetE和tetG基因。抗β内酰胺类药物的基因中以blaTEM基因为主(32.1%),且均为blaTEM-1;blaCTX-M基因的检出率为9.2%;blaCTX-M-1基因的检出率为6.4%,其中有5株亚型为blaCTX-M-55,1株亚型为blaCTX-M-15,1株亚型为blaCTX-M-64;blaCTX-M-9基因的检出率为3.7%,其亚型均为blaCTX-M-65,其中1株鸡源分离株同时携带blaCTX-M-55和blaCTX-M-65;未检测到blaSHV基因。氨基糖苷类耐药基因中aadA1检出率(27.4%)高于aac(14.5%),有4株菌同时携带aadA1和aac。cml1和sul1的检出率分别为31.3%和12.8%。牛肉源分离株均呈aadA1、cml1和sul1阴性;猪肉源分离株均呈blaCTX-M阴性。

表5 乌鲁木齐畜禽肉源大肠杆菌耐药基因检测结果Table 5 Genes with E. coli resistance from livestock and chicken meat in Urumqi
3 讨论与结论
3.1 乌鲁木齐市不同畜禽肉源大肠杆菌的系统发育分群
本研究从乌鲁木齐市353份畜禽肉中分离得到252株大肠杆菌,分离率为71.4%,与Zhang等[22]和于庆华[23]研究中畜禽肉源大肠杆菌的分离率接近,提示零售肉受大肠杆菌污染严重,而畜禽在养殖、屠宰加工、运输和销售各个环节都有可能受大肠杆菌污染。A群和B1群主要为共生性大肠杆菌,B2和D群主要为致病性大肠杆菌[24]。Barilli等[25]研究发现,在零售肉源大肠杆菌中B2群或D群占总分离菌的39.7%。本研究中零售畜禽肉源大肠杆菌以A群为主,未检测出B2群,但检测出少量的D群菌株,这与曾莉[26]的研究结果相似,表明零售肉可能受到潜在致病性菌株污染。因此,在生产实践中应加强肉类食品安全的监督工作,减少畜禽肉从养殖场到餐桌过程中大肠杆菌的污染,从而降低食源性疾病爆发的概率。
3.2 乌鲁木齐市不同畜禽肉源大肠杆菌的耐药性
长期使用抗生素可使大肠杆菌产生耐药性,耐药大肠杆菌可在畜禽与周围环境之间传播,并可通过畜禽的皮毛或者肠道内容物在屠宰场中进一步传播,导致畜禽源大肠杆菌的耐药率较高。本研究中,所有受试菌株对四环素类药物的耐药率(49.6%)最高,这可能与四环素长时间使用、价格低廉及常作为促生长素与饲料饮水混饲、混饮有一定关系,亚抑菌浓度抗生素使细菌更容易产生抗性;其次是β-内酰胺类的氨苄西林(41.6%)和磺胺类的复方新诺明(30.9%),但耐药率均低于国内外的其他报道[22,27]。
在分割、包装和运输中,工作人员操作不当或者在售卖过程中可能形成的交叉污染,导致耐药菌株在畜产品中不断积累,从而对人类健康以及畜产品安全造成危害。作为广谱抗生素,β-内酰胺类药物在人医和兽医临床治疗中常作为首选抑菌药物,产生β-内酰胺酶是细菌对β-内酰胺类药物产生耐药性的主要原因。本研究中大肠杆菌分离株对哌拉西林-他唑巴坦的耐药率(0.0%)<氨苄西林-舒巴坦(0.4%)<阿莫西林-克拉维酸(5.9%)<哌拉西林(20.6%)<氨苄西林(41.6%),作为β-内酰胺酶抑制剂,他唑巴坦、舒巴坦和克拉维酸能够抑制β-内酰胺酶并显著增加抗菌药物的活力。Badi等[28]发现,大肠杆菌对阿莫西林-克拉维酸表现出更高的耐药性,这意味着A群菌株β-内酰胺酶可能正在发生突变或增加亚型多样性,β-内酰胺酶抑制剂的效果逐渐弱化。因此,针对产ESBL大肠杆菌,可将新的β-内酰胺复合类药物(如头孢他啶-他唑巴坦)与传统药物交替使用,降低其对此类药物的耐药性[29]。
氯霉素对人或动物的造血系统可造成不可逆的破坏,因此,我国和大多数国家已禁止在兽医临床上应用氯霉素。本研究中分离菌株对氯霉素的耐药率为26.6%,高于Ali等[2]的调查结果,这可能是因为养殖户对禁氯霉素的执行力度不够;也可能是氯霉素的耐药基因与其他耐药基因存在基因连锁现象,在此情况下即使没有氯霉素的选择压力,大肠杆菌仍然能够表现出氯霉素耐药表型;还可能是养殖场环境较差,其他抗氯霉素细菌通过水平转移将抗性基因转移至大肠杆菌中。
研究表明,猪肉与鸡肉源大肠杆菌的高耐药率更为常见[6]。本研究中猪肉源、鸡肉源、羊肉源和牛肉源分离株的耐药率依次降低。值得注意的是,本研究中羊肉和牛肉源大肠杆菌的耐药率均高于澳大利亚的羊肉源(2%)和牛肉源(8%)[30]。鸡、猪源分离株的高耐药率与畜禽的养殖方式密不可分,因为新疆地区的鸡、猪以集约化养殖为主,养殖过程中抗生素应用频率更高,而且在极高的养殖密度下活畜禽体表携带耐药大肠杆菌的概率更大。新疆是肉产品消耗大省,从2008起肉类食品消耗量呈稳步上升状态,市场需求大于供给意味着新疆畜禽养殖将会朝着集约化发展,逐渐形成完整的养殖、加工、销售产业链模式,但这种模式会加剧抗生素滥用情况,导致耐药菌株在生产加工链中的传播更难控制。
细菌耐药可分为固有耐药和获得性耐药。耐药基因的水平转移是细菌获得耐药性的主要方式之一[31],本研究通过PCR对耐药基因进行检测发现,乌鲁木齐市畜禽肉源大肠杆菌污染情况严重,58.7%的分离株对抗菌药物产生不同程度的抗性,耐药基因污染情况严重;其中有23株具有耐药表型但不携带耐药基因,可能是该类菌株携带了不在检测范围的其他耐药基因;84.4%的菌株至少携带1种耐药基因,说明零售畜禽肉可能作为大肠杆菌耐药基因“储存库”,将耐药基因传播给其他致病菌或者共生菌。tetA的检出率最高,说明大肠杆菌对四环素耐药主要依靠主动外排泵;编码ESBL酶的耐药基因以blaTEM为主,这与国内对零售肉源耐药性调查结果[32]一致,但在欧州国家blaCTX-M更为流行,且存在地区差异[33]。与TEM型的ESBLs酶不同,CTX-M对头孢噻肟有较强的水解活性,携带blaCTX-M的菌株同时携带其他耐药基因的概率更高,且菌株表现为多重耐药,这可能是因为介导氨基糖苷类、四环素类、磺胺类等抗生素的耐药基因常和blaCTX-M位于同一质粒上,菌株通过耐药基因连锁反应而获得耐药性,这种共同选择的现象使多重耐药菌出现概率增高,应引起人们的重视。

