我国医药产品创新性与可及性的利益平衡及制度建构——以专利链接制度为例
韩欣悦 聂洪涛
中圖分类号 R95;G306 文献标志码 A 文章编号 1001-0408(2021)18-2177-07
DOI 10.6039/j.issn.1001-0408.2021.18.01
摘 要 目的:为我国构建与国际接轨的专利链接制度、平衡原研药企业与仿制药企业之间的利益冲突提供参考。方法:介绍美国专利链接相关配套制度,结合国内外药品专利保护的发展现状和有关制度,分析我国药品专利管理制度中存在的问题,并提出完善建议。结果与结论:美国专利链接制度包括桔皮书制度、仿制药专利声明制度、仿制药审批等待期以及首仿药市场独占期制度等内容。医药产品领域创新性与可及性面临着“公地悲剧”与“反公地悲剧”两难困境。我国药品专利保护存在着研发创新能力不足制约着医药产业发展、法律法规不完善不利于医药专利纠纷的解决等诸多问题。建议我国可采取建立专利药品数字化信息库、规范现有的仿制药专利声明制度、促进专利诉讼周期与审批等待期的相互协调、增加医药产业自主创新能力等措施,促进医药创新与药品可及性的相互协调,共同推动药品知识产权立法的完善和医疗卫生事业的发展。
关键词 药品专利;创新性;可及性;利益平衡;原研药;仿制药;专利链接制度
Benefit Balance and System Construction of Innovation and Accessibility of Pharmaceutical Products in China:Taking the Patent Linking System as an Example
HAN Xinyue,NIE Hongtao(School of Law, Xian University of Finance and Economics, Xian 710100, China)
ABSTRACT OBJECTIVE: To provide reference for constructing a patent linking system in line with international standards and balancing the interest conflict between original drug enterprises and generic drug enterprises. METHODS:The relevant supporting systems of patent link in the United States were introduced; combined with the development status and relevant systems of drug patent protection at home and abroad, the existing problems of Chinas drug patent management system were analyzed to put forward suggestions for improvement. RESULTS & CONCLUSIONS:The United States patent linking system included Orange book system, generic drug patent declaration system, generic drug approval waiting period and market monopoly period system of the first generic drug. The innovation and accessibility in the field of pharmaceutical products were facing the dilemma of “commons tragedy” and “anti commons tragedy”. There were many problems in Chinas drug patent protection, such as insufficient R&D and innovation ability inhibited the development of the pharmaceutical industry, imperfect laws and regulations were not conducive to the settlement of medical professional disputes. It is suggested to establish a digital information database of patented drugs, standardize the existing generic drug patent declaration system, promote the coordination between patent litigation cycle and approval waiting period, increase the independent innovation ability of the pharmaceutical industry, promote the coordination between pharmaceutical innovation and drug accessibility, and jointly promote the improvement of intellectual property legislation and the development of medical and health undertakings.
KEYWORDS Drug patent; Innovation; Accessibility; Interest balance; Original drugs; Generic drugs; Patent linking system
随着全球化进程的深入推进,国际间人口、贸易的流动更加频繁,公共健康危机的波及范围也越来越广[1]。近年来,严重急性呼吸综合征(SARS)、禽流感、甲型H1N1流感、新型冠状病毒肺炎等流行性疾病相继出现,给人们的生命和财产造成严重损害,阻碍了人们生产生活的正常进行。药品作为解决流行性疾病的关键,引起了社会各界的广泛关注,关于药品专利权和生命健康权的矛盾也日渐显现[2]。药品作为知识密集型产品,制药企业一直将专利保护视为生存发展的“生命线”。专利保护有助于制药企业研发新药、刺激医药行业的整体创新,但过度的专利保护将会增加公众的医疗成本[3]。技术进步给制药企业带来了丰厚的利润,但与此同时在许多国家也产生了由专利药品价格高昂引发的可及性危机,而在全球公共健康危机的背景下,医药产品创新与保障可及性的矛盾更加突出[4],引发了学者对药品专利制度的反思和对相关措施完善的探讨。药品专利链接制度是指仿制药上市批准与创新药品专利期满相“链接”,即仿制药注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利侵权。本文通过介绍美国专利链接相关配套制度,分析我国药品专利管理制度中存在的问题,以期为我国构建与国际接轨的专利链接制度、平衡原研药企业与仿制药企业之间的利益冲突提供参考。
1 医药产业“专利集群”与专利链接制度的产生
自第二次世界大战结束以来,大量制药企业利用自身的垄断地位进行市场扩张,医药产业进入了发展的“黄金时代”[5]。原研药企业希望通过专利制度为专利药品提供高强度、长时间的专利保护。而到近几年,制药业创新进入瓶颈期,跨国药企仍在进一步扩张专利申请,巩固自身的竞争优势,在专利审查体系和保护机制系统性失灵的情況下,药品专利的大量扩张对于制药业市场竞争的阻碍已成必然。
在专利授权阶段,专利审查机构的审查能力难以与跨国药企的专利策略相匹配,跨国药企在全球范围内高筑技术壁垒,专利审查机构的角色和功能也在悄然变化:审查机构的收入主要来自于审查费用,故其依赖专利权人缴纳的费用来维持运营,越来越将大型制药企业和跨国药企“奉为上宾”,在政策上更加倾向于专利授权,无意与跨国药企的专利策略相对抗。此外,医药产品本身的复杂性也使专利审查存在困难,故专利审查难以兼顾竞争者利益与社会公共利益,跨国药企可以轻易筑起专利壁垒,使传统的市场竞争机制和公共利益保护机制失灵,进一步加剧了跨国药企的“专利霸权”[6]。
在专利诉讼中,大量的药品专利增加了仿制药进入市场的成本和不确定性,漫长的诉讼过程又进一步延长了仿制药的上市时间,加上诉讼结果本身具有不确定性,在专利数量大幅增长的情况下,诉讼成本和时间成本不断升高,资金实力不足的仿制药企业无力与大型跨国药企相抗衡,市场竞争的不平等和市场进入的壁垒不断加大。大量药品专利的“集群”现象阻碍了其他竞争者尤其是中小企业进入市场,许多大型制药企业在其基本专利的外围再不断衍生出新的专利,使得专利和专利相互交叠、环环相套,其他制药企业无法轻易避开,最终导致制药业的创新越来越少[7]。
在全球范围内,“专利集群”成为了制药业发展面临的突出问题,对“仿创竞争”产生了实质阻碍[8]。如今,跨国药企正不断将专利制度打造成为自身利益服务的工具,故要防止大型制药企业对药品专利权的滥用,就需要将相对松散的利益相关主体联合起来,形成与大型制药企业对等的力量进行制衡。专利链接作为一种平衡机制,在制度设计中,以美国Hatch-Waxman法案确立的桔皮书制度、仿制药专利声明制度、仿制药审批等待期以及首仿药市场独占期为基础[9],对以大型跨国药企为代表的原研药利益集团进行制约和抗衡,经过长期的适应性调整和实践探索,在一定程度上消解了专利数量增长给市场竞争带来的阻碍。
1.1 专利信息公示与桔皮书制度
在美国,专利药在申请上市时,专利药企业需要向FDA提供药品的相关专利信息,FDA会将相关信息登记在桔皮书中,方便仿制药企业在注册过程中查询。桔皮书即《经过治疗等效性评价批准的药品》(Approved Drug Products with Therapeutic Equivalence Evaluations),其收录了经由FDA审批的全部药品,详细完整地列出了在《食品、药品和化妆品法》指导下历年来批准的所有药品,并明确列出了新药所涉及的所有专利以及市场专营保护信息。桔皮书对专利信息的公示明确了原研药企业的权利范围,帮助了仿制药企业有针对性地确定仿制时机、进行专利规避设计,高效地进行生产和研发管理;同时,在先的权利登记也限制了专利权行使的界限,防止了专利权的滥用。
1.2 仿制药专利声明制度
在进行简化新药申请(abbreviated new drug application,ANDA)时,仿制药企业需要核对原研药企业登记在桔皮书上的专利信息,并向FDA作出下列4项声明之一——“桔皮书所列专利无效或并未侵权”“没有相关专利登记在桔皮书上”“登记的专利已过期”“承诺在所列专利到期后才开始制造和销售仿制药”[10]。由于ANDA不需要提交全部的临床试验数据,仅需证明仿制药与原研药的等效性,故大大缩短了仿制药研发和审批的时间,也降低了权利人防范侵权的成本,为仿制药与原研药的公平竞争提供了条件。仿制药企业作出所列专利无效或并未侵权的“专利挑战”,有效消解了大型制药企业专利数量不断增多、专利保护期限不断延长的问题。自Hatch-Waxman法案实施以来,美国通过“专利挑战”上市的药品逐年增加,其构建的市场主体内部的公平竞争机制有效削减了大型制药企业为了延长其核心药品的专利期或者市场独占期而采取的法律和商业措施(俗称“专利常青”,目的在于阻碍相关仿制药进入市场,维持其较高的市场价格),为避免专利权的滥用提供了有效补充[11]。
1.3 仿制药审批等待期
根据药品专利链接制度的要求,仿制药注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利侵权。在专利链接制度下,仿制药上市审批以不侵犯他人专利权为前提,在可能涉及他人专利时应当发起“专利挑战”,在法院确认不侵权之前FDA不得批准仿制药上市。对于桔皮书上没有登记相关专利或登记专利已过期药品的仿制药申请,FDA将在符合安全性、有效性的前提下直接批准。对于承诺在所列专利到期后才开始制造和销售仿制药的申请,FDA将等到专利到期后予以批准。对于提出未侵权或桔皮书所列专利无效的“专利挑战”,仿制药企业应向FDA提供其未侵权或专利无效的相关证明材料,并在20 d内通知专利权人,专利权人可在获得通知后45 d内提起侵权诉讼,FDA将停止仿制药的上市批准,等待法院作出判决,或在30个月的等待期届满时批准[12]。法院宣告原研药专利无效、通过司法判决确认并未侵权或等待期届满后,仿制药获得上市审批,即“挑战成功”。与欧盟上市审批后通过“临时禁令”保护的模式相比,美国专利链接制度将专利侵权的审查与仿制药安全性、有效性的审查同步进行,避免药品上市后提起专利诉讼对仿制药上市造成不必要的延缓[13]。为了避免诉讼期过长,美国专利链接制度设定了审批等待期,超过等待期上限则可直接批准仿制药上市,避免了申请人的权益长期处于不确定的状态。
1.4 首仿药市场独占期
为了鼓励仿制药企业挑战原研药的专利权,Hatch-Waxman法案规定,第1家提交ANDA的仿制药企业,在专利权属状态声明送达原研药企业的45 d内,原研药企业未提起侵权诉讼或者法院判决仿制药企业胜诉时,该仿制药企业可获得180 d的市场独占期,在180 d内FDA不会再批准其他仿制药企业的上市申请。一些原研药企业为了保证其专利药的垄断地位,与获得180 d市场独占期的仿制药企业达成协议,支付一定金额使仿制药企业在独占期内不上市仿制药或不申请市场独占期。为防止上述不正当竞争,美国规定了签订此类协议10 d内必须通知联邦贸易委员会及司法部,否则可能面临高额罚款。传统模式只能通过上市后的專利诉讼和“临时禁令”延缓仿制药的上市,而专利链接模式则进行了系统的内部成本优化,首仿药的市场独占期制度为仿制药企业进行二次创新提供了动力,促使整个仿制药行业共同对已登记的专利进行检验,共同分担高额的确权成本,有助于仿制药企业进行规避设计,以保护药品制造工艺、新配方或新的活性成分形式[14]。
2 医药产品创新性与可及性的矛盾
如今,人类面临的公共性问题与日俱增,美国人类生态学家Hardin将其归结为“公地条件下资源被过度使用导致的悲剧”[15]。从“公地悲剧”理论来看,若不予以专利保护,药品发明完成即进入公有领域,将会严重破坏专利权人的创新积极性,阻碍新研发的投入,也会使得专利药品的更新周期延长或中断,使药品供给能力落后于市场需求,最终导致药品根源性短缺消费困境的出现。相较于其他专利产品,药品更容易通过反向工程被模仿,如果仿制药企业可以不受限制地仿制专利药,只需要通过等效性检验和药监部门的审批即可上市,则相当于为分割专利药市场的“搭便车”行为被披上了合法外衣。省去的研发成本将会带来大幅的降价空间,致使制药企业研发新药和产业投资的热情受挫,最终社会可能面临“无药可用”的根源性危机。
巴西在21世纪初期曾通过广泛实施强制许可来解决国内的艾滋病危机[16]。与我国同为仿制药大国的印度,由于国内的政策倾向,仿制药产业也一度空前繁荣[17]。与发达国家主导的高标准专利保护条款相比,印度对可授予专利的范围进行了较为严格的限制,对于既存产品或方法的新形式、新用途通常不予专利保护[18]。这种规定大幅抑制了原研药企业为变相延长专利保护期而形成的“专利常青”现象,为仿制药的发展创造了宽松的立法与政策环境。印度、巴西等国没有专利链接制度,也不承认数据独占权,其强制许可制度已发展得较为完善,并被广泛应用于仿制药产业;同时,印度允许平行进口,即在满足国内需求、缓解公共健康危机的同时,在较大范围内允许药品进出口贸易,这使得印度药品可以走向国际,形成了独具特色的医药发展模式,且在应对平行进口商与专利权人之间的侵权诉讼时,印度司法机关为了保护本国仿制药产业的发展往往会作出不利于专利权人的判决[19]。印度等国对药品专利的“弱保护”模式在保障公共健康的同时,也陷入了“公地悲剧”的发展困境。
原研药通过大量的前期投入和严格的临床试验,审批合格后才被予以上市,而仿制药因与原研药在适应证、药效方面一致,且由于研发投入较低,其价格往往低于原研药,有助于实现药品的可及性。但非专利药品在价格低廉的同时也可能存在质量隐患,印度药品就曾多次因质量问题被其他国家禁止进口,美国FDA也曾将印度的部分药品列入“黑名单”[20]。宽松的专利制度和强制许可虽在短期内维护了印度国民的生命健康权,但这种模式长期发展只会使仿制药企业的数量增加而使原研药企业发展受阻。原研药需要投入大量的时间与资金,缺乏创新激励将会导致仿制药主导、原研药不足的局面。同时,仿制药企业的生存也依赖于境外的原研药企业,消极的专利保护会降低境外原研药企业的输入率,随着境内患者的增加,境外原研药企业对投资环境感到失望,境内的仿制药企业也会遭遇发展困境,使得公众的生命健康失去有力保障,进入恶性循环。
基于“公地悲剧”的思维定势,人们对带有公地性质之物避犹不及,主张通过私有化的方式实现“去公地化”,以避免悲剧的发生[21]。“公地悲剧”的起因在于排他性产权的缺失,故而产权通常被认为划分得越彻底越好[22]。但事实上,仅仅做到产权清晰是不够的,产权被过度分割,排他性过强,资源配置低效,将会造成新的问题——“反公地悲剧”。美国学者Heller指出,“反公地悲剧是公地悲剧在镜子中的影像”[23]。排他性过强将导致产权破碎化,无法充分实现资源的价值,甚至使得稀缺资源无法得到利用[24]。譬如,美国自20世纪中期以来对基因工程领域进行了许多私人投资,为了保障投资者的利益,美国专利及商标局为其授予了专利,但由于基因工程涉及面广,加之前期专利审批不严,出现了大量的碎片化专利。基因工程研究需将已有成果有序整合,以此开发出新的药品和疗法,实现其应用价值。由于整合碎片化的基因专利成本高昂,随着研发成本的日益增加,新的发明不断萎缩,许多基因领域的创新被扼杀在摇篮之中[25]。
知识产权兼具私权与人权属性,保障权利人享有智力成果的同时保障社会公众分享该智力创造的利益,是知识产权制度的内在要求[26]。为避免知识产权落入“公地悲剧”与“反公地悲剧”的境地,相关部门必须协调好药品专利保护“度”的问题。创新药品申请专利带来垄断利益,随之而来的就是高昂的药品价格,而消费者往往是利益冲突结果的直接承担者。仿制药能够以相对低廉的价格实现药品可及性的提升,但政策如果向仿制药倾斜,新药研发的成本和风险将无人承担,创新药企业就会失去研发积极性,而没有了新药,仿制药也无药可仿,消费者也无药可用,最终将会出现恶性循环,从根源上损害公众健康。
3 我国药品专利保护面临的突出问题
3.1 研发创新能力不足制约着医药产业的发展
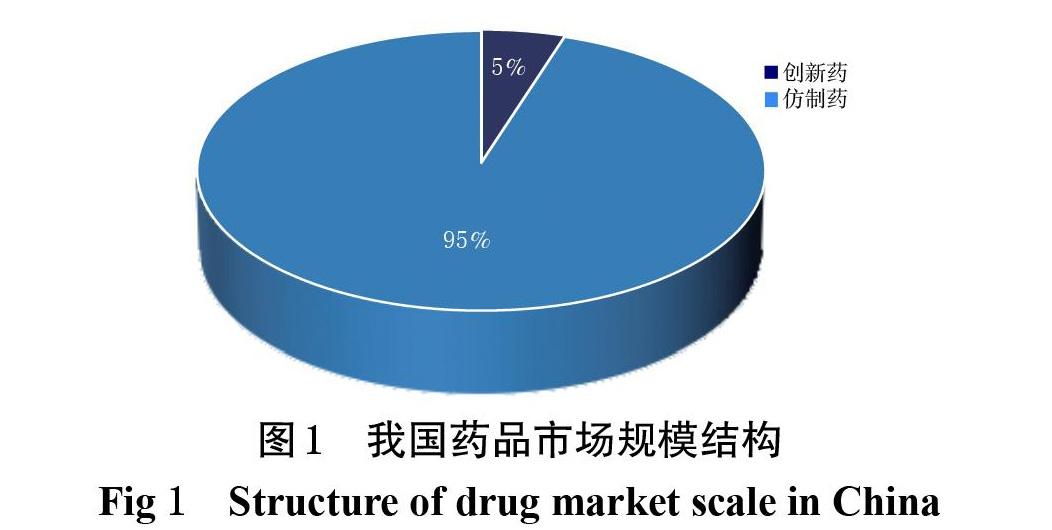
在我国,仿制药占药品市场总规模的95%[27](图1)。当前,仿制药和原研药面临着不同的发展瓶颈:一方面,原研药上市数量难以满足市场需求;另一方面,低端仿制药产能过剩,高端仿制药市场却严重短缺。由于国内医药企业研发和创新能力不足,我國自主新药的数量与发达国家存在显著差距,而国外专利药在我国的上市时间晚,数量也较少,导致我国高端市场专利药的供给明显不足。此外,国内仿制药企业集中在资金准入门槛和研发水平较低的廉价药市场,由于仿制能力有所不足,高端仿制药领域缺乏有效竞争,仿制药上市数量少,以致于高端原研药专利到期后药品价格依然居高不下[28]。限于我国本土制药企业的研发能力,高端市场的药品可及性问题并未得到缓解。而大型跨国药企的目标为追求全球范围内的利润最大化,由于发展中国家的药品价格低于发达国家,高端市场的境外药品往往延迟或不愿进入我国市场,故我国解决药品可及性问题的核心在于增强国内制药企业的研发和仿制能力,积极争取进入高端药品市场。
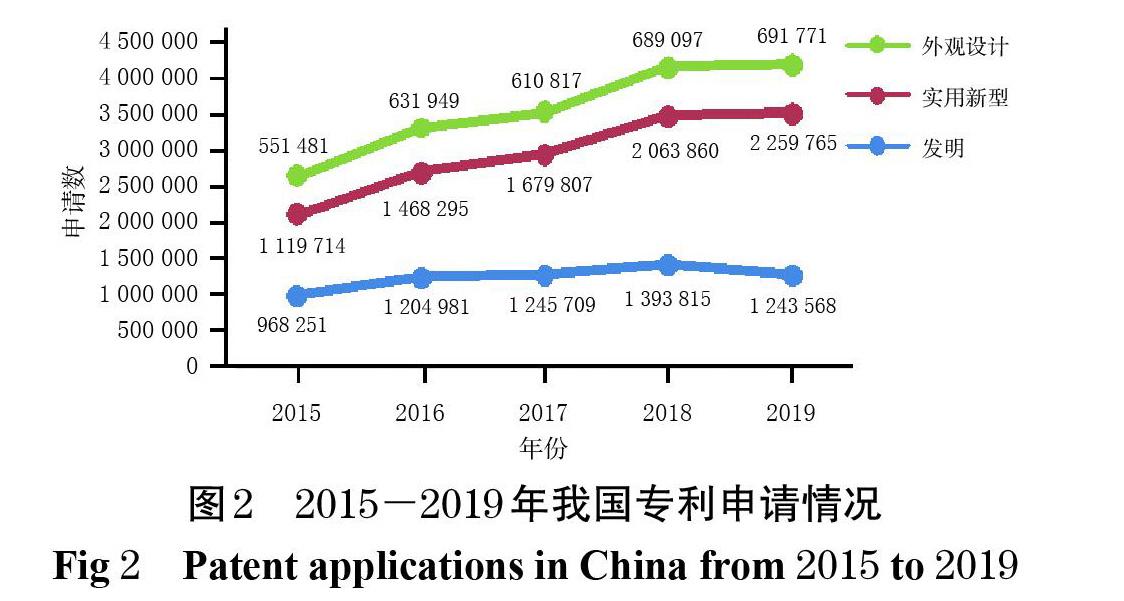
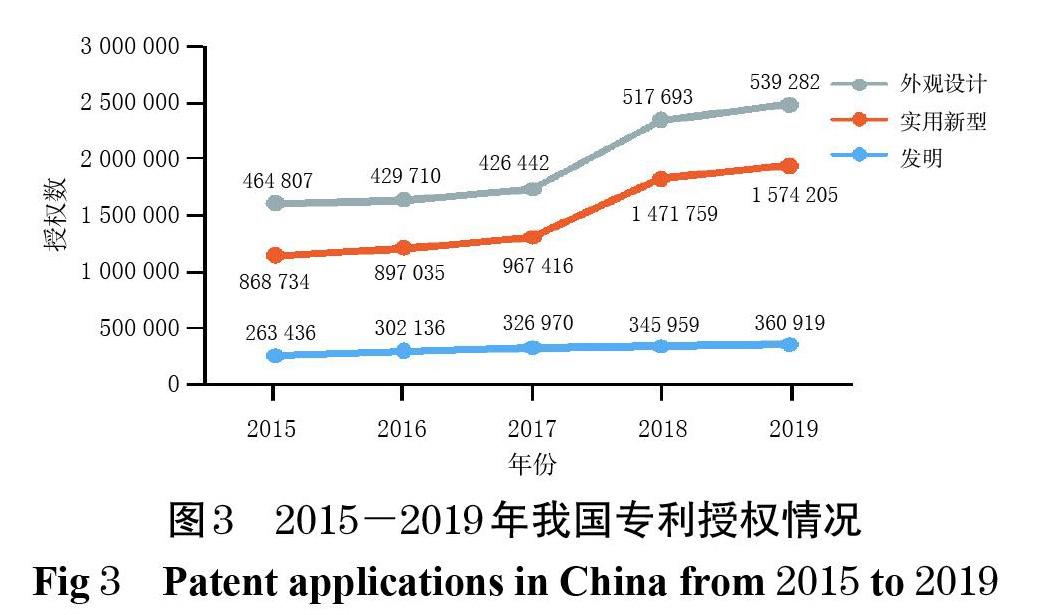
从国家知识产权局收录的我国近5年的专利申请和授权情况来看(图2、图3),我国专利数量正经历着一次史无前例的大规模扩张,“专利泡沫”问题也随之而来[29]。从全球市场布局来看,我国与美国、欧盟在药品领域面临的问题具有一定的相似性:我国作为发展中国家虽然并非跨国药企的主要市场,但跨国药企依然同步进行着其专利策略和专利布局,以维持竞争优势。经美国FDA审批上市的药品,无论是否在我国上市,大多也都在我国申请了专利,大量效力不确定的专利对拟进入市场的仿制药造成了潜在阻碍。原研药企业通过专利诉讼延缓仿制药上市,同时专利保护与药品可及性之间的矛盾已经初现端倪[30]。保护医药产业创新投资,同时避免大型跨国药企筑起专利壁垒,为仿制药企业进入市场扫清障碍,保障药品的可及性以维护公众健康,已成为当前我国药品专利制度发展的主要目标。
3.2 法律法规不完善不利于专利纠纷的解决
2020年10月17日,全国人民代表大会常务委员会通过了《专利法》的第四次修改,修改后的《专利法》于2021年6月1日生效,其中第42条和第76条分别对药品专利补偿及专利链接作出了原则性规定[31]。第42条规定,为补偿新药上市审评审批所占用的时间,对在中国获得上市许可的新药发明专利,国家专利行政部门可以应专利权人的请求给予期限补偿。第76条规定,药品上市审评审批过程中,申请人与有关专利权人或者利害关系人,因申请注册产生专利权纠纷的,相关当事人可以向人民法院起诉,请求就相关技术方案是否落入他人专利权保护范围作出判决。药监部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。这是我国专利法中首次出现药品专利有效期补偿及建立药品专利链接制度的法律条文,为我国逐步建立药品专利链接及配套制度迈出了重要的一步。
但是,《专利法》新增条款中仅明确了药品注册过程中专利纠纷的解决途径,对于纠纷解决过程中可能产生的实际问题还需要进一步探讨。如,仿制药的审批等待期设定为9个月是否妥当,如何确定提起诉讼及行政裁决45 d时效的起算点,法院应如何采取措施加速该类案件的审理等。专利链接制度包含着仿制药企业发起的“专利挑战”和原研药企业的侵权诉讼两条主线,就我国的现状来看,“专利挑战”和侵权诉讼之间并未形成相互衔接的有效机制,行政与司法机关之间亦缺乏分工与配合。
在专利链接制度的运行机制中,原研药企业研发专利药并申请上市,国家药品监督管理局对其提交的相关数据予以保护,并在上市药品目录中记录其专利信息,在此期间内,未经许可的申请人不得擅自使用该数据。之后,仿制药企业提出简化上市申请,只需证明具有相同的成分、作用和生物等效性,而不需要提供全面的临床试验数据。仿制药企业还应当对申请的药品提出专利权属状态的声明,若挑战原研药专利应作出不侵权声明并通知原研药专利权人,原研药企业接到“专利挑战”后,应向法院提起侵权诉讼并告知国家药品监督管理局,国家药品监督管理局据此设置审批等待期,根据法院的判决决定是否批准该药品上市。2020年《药品注册管理办法》提出了“建立药品加快上市注册制度”,但其规定的“突破性治疗药物”“附条件批准”“优先审评审批”等标准,难以适用于仿制药申请[32]。可见,我国针对仿制药的“简化新药申请”制度尚未建立,关于仿制药专利声明的规定也不够详细,对于申请人提交的不侵权声明也未进行实质性的审查。
目前来看,虽然修改后的《专利法》规定了专利公示、声明、通知等规则,但对于构成药品专利链接制度基石的“拟制侵权规则”“药监部门、知识产权部门、司法机关三部门程序性链接规则”并未落到实处[33]。因此,有的仿制药已经获批上市,却还是被原研药专利权利人提起侵权之诉,信息的不对称和严重滞后不利于发现和处理专利纠纷,在仿制药上市销售后,引发的专利纠纷案件显著增多[34]。而在美国,仿制药企业提交专利声明必须同时送达专利权人,专利权人可在45 d内对声明作出回应,或向法院提起诉讼并获得FDA对仿制药的停审期。美国法院可直接判断无效或侵权案件中的专利效力,不需要发回行政部门,节省了国家资源和企业成本,避免了司法机关与行政机关的相互推诿[35]。但赋予法院对专利效力直接裁判的权力,对法官队伍提出了很高的要求,有学者认为,我国应对现有体制进行改革,增设法院与专利复审委员会之间的联动机制,使审查员以技术调查官等身份参与专利有效性审查[36]。但事实上,人员调整和体系变革所带来的社会成本也不容忽视。
4 建议
印度等国通过滞后专利法的发展来追求短期社会效益并不是确保公众生命健康的长久之计。我国在加入世界贸易组织的过渡期内,并没有像印度一样,为给本国仿制药发展提供宽松的环境而放缓对专利权的保护,而是将对药品专利的保护与发达国家保持一致。我国药品市场长期以仿制药为主,各界学者都希望转变医药产业的发展模式,探索建立具有自主知识产权、以原研药为主的产业结构[36]。但就目前来看,如果盲目加大专利保护的力度,实际受益的将是发达国家的大型跨国药企;如果实施弱保护,又不利于激励我国专利药的创新和研发,对医药产业的长足发展将产生不利影响。原研药与仿制药之间的矛盾是法律制度与现实发展脱节的结果,面对发达国家高标准的专利保护条款,我国要根据具体国情,开辟出一条适于我国医药产业的发展路径。
4.1 建立专利药品数字化信息库
实践中,申请人要提交专利信息非常容易,但要检索他人的专利信息则存在障碍。由于他人的专利信息只能通过检索方式获取,信息检索结果缺乏準确性,将不利于注册审批程序的顺利进行。我国《药品注册管理办法》第18条规定,国家药品监督管理局应建立批准上市以及通过仿制药质量和药效一致性评价的化学药品目录集[32]。在此基础上,我国还应尽快完善专利信息公示制度,可以把上市药品专利信息登记平台与上市药品目录集的相关功能进行整合,建立药品专利信息检索数据库,使药品目录集成为中国化的“桔皮书”,为首仿日的确定和“专利挑战”提供依据。在公开专利信息、保护专利权人的基础上,为仿制药申请人提供一个参考标准,制药企业可据此进行仿制药研发与生产,提前规避专利侵权。为避免专利权的滥用,对已登记的专利,可以赋予第三人提出异议删除的权利,也可以设置一定数额的罚金,防止原研药企业以效力不明确的专利高筑专利壁垒,阻碍仿制药的上市。
4.2 规范仿制药专利声明制度
我国是仿制药生产大国,专利药市场往往被大型跨国药企占据。跨国药企时常以仿制药侵权为由提起专利诉讼,致使仿制药企业频繁卷入专利纠纷。规范仿制药专利声明制度,提前解决专利纠纷,能够在保护专利权的基础上,平衡原研药企业与仿制药企业的利益,促使仿制药顺利进入市场。美国仿制药专利声明制度分类较为详细,对仿制药申请人可以提出的4类专利声明均有明确规定。我国国家药品监督管理局、国家知识产权局在《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》中,初步划分了仿制药申请人提交专利声明的种类,包括专利信息未公布在药品信息公示平台、专利无效或已过有效期、仿制药未落入相关专利权保护范围,或承诺在专利有效期届满后上市[37]。仿制药企业应根据所仿制专利药的不同情况,有针对性地提交专利声明及相应证明材料,以便药监部门快速确认专利状态并进行药品上市审批。
仿制药专利声明制度与专利信息公示制度相辅相成,是药品专利链接制度的关键所在。我国《药品注册管理办法》对仿制药专利声明作出的规定存在权属状态不明晰、内容过于宽泛等问题。为此,笔者建议应对“专利权属状态”的含义进行进一步明确,“权属状态”不仅包括权利的归属,而且还包括权利的效力,应详细列明申请人提交专利声明应当涉及的具体内容。同时,建议药监部门应对仿制药专利声明进行形式审查,将符合形式要件的材料移送至专利审批部门进行实质审查,既能保证仿制药专利声明的真实有效,也能防止上市后引起的专利纠纷,鼓励仿制药企业积极进行研发与生产。在仿制药申请人作出专利声明时,应当将声明同时送达专利权人,保证专利权人及时获得救济。
4.3 促进专利诉讼周期与审批等待期的相互协调
“专利挑战”提供了一种药品上市前的纠纷解决机制,避免了药品上市后引起的侵权诉讼,也杜绝了专利权人在仿制药上市后利用诉讼手段延长仿制药上市期限的行为。为充分解决纠纷,避免权利人滥用权利,建议我国《专利法》应规定专利药企业必须在收到仿制药企业发出通知后的一定期限内提起诉讼,无正当理由未起诉的,不得在仿制药上市后再次主张权利。此外,仿制药审批时间也应与专利诉讼周期相适应,保证审评审批部门可在审查完成后直接依据法院判决确定是否批准仿制药上市。对于专利权人提出的侵权主张,仿制药企业通常会作出不侵权抗辩或向专利复审部门申请宣告专利无效。由于一审判决和无效决定的改判率都较低,可将一审判决和复审部门的决定作为批准上市的依据,以避免仿制药上市时间不必要的延迟。
为避免个案诉讼周期过长,我国还应设置较为合理的仿制药审批等待期。如以美国的药品审批周期为参照,可暂将审批等待期的上限设为24个月[38]。为保障药品审批与侵权纠纷的同步进行,我国应建立药品审批机关与司法机关的沟通机制,对专利侵权或无效案件设置相应审批时限。在完成药品审批后法院仍未作出判决的,可以催告法院加速审理。在危及公众健康的特殊时期,超过合理期限未作出判决的则可以直接批准上市。我国可借鉴美国、加拿大和我国台湾地区的司法实践,在“专利挑战”中设置诚实信用、防止权利滥用的一般条款,授权审批机关对恶意拖延行为酌情延长或缩短等待期[39]。
4.4 增强医药产业自主创新能力
专利效用的发挥源自其内在的创新激励机制。创新激励机制的运作基础主要在于通过市场运营获取利润[40]。我国进口原研药价格高昂的原因,除了进口原研药受专利保护外,更主要的是我国国内缺乏与进口原研药相竞争的替代品。要从根本上解决药品专利可能出现的问题,支持仿制药只能解燃眉之急,提高原研药的自主创新和市场占比才是最终目标。当前我国医药产业专利转化实施率偏低,缺乏高价值专利[41]。虽然贫穷患者有追求健康的权利,但健康权不应通过否定知识产权制度来实现。即便是药品专利发展水平较高的美国,也面临着原研药无法满足公众需求的矛盾。就我国的实际情况而言,应对仿制药企业进行有效整顿,提升行业水平,进一步完善专利链接制度,提高仿制药的质量,继而实现“仿创结合”的良性循环,在积累了一定资金和技术的基础上,加强专利成果转化,提高原研药的自主创新能力,顺应市场竞争机制,实现原研药与仿制药的平等对抗和良性互动,最终在医药产业实现高质量发展的基础上,利用自由竞争机制使药品价格降至公众可接受的范围。
5 结语
专利保护和公众健康权之间的平衡,不仅是制药企业之间对于利润的博弈,更是各国之间国家利益的博弈。个体性与社会性的冲突决定了药品专利需建立保护与限制并存的制衡架构。我国医药产业正突飞猛进地发展,制药企业也正积极融入国际科技创新的热潮,我国一贯十分重视知识产权保护与国际社会的接轨,一方面,进一步完善专利链接制度将有助于降低仿制药上市后的侵权风险,另一方面,借助药品专利链接的信息公示、“专利挑战”、审批等待期和首仿药独占期等手段,将有利于消解“专利集群”现象,促进仿创竞争,避免仿制药上市时间的不当延迟。当前我国原研药数量少、价格高,仿制药上市又极易侵犯原研药的专利权,故利益平衡理论在医药领域的适用,将更有助于解决药品专利保护不力、高质量药品紧缺和医药产品可及性不足的突出问题,促进我国医药企业“仿创结合”,逐步提高自身医药研发水平,进一步与国际专利保护标准接轨,保障医药资源优化配置,增强应对公共医疗问题的能力,促进医药创新与药品可及性的相互协调,共同推动药品知识产权立法的完善和医疗卫生事业的发展。
参考文献
[ 1 ] 疫情与变化的世界:对新冠肺炎疫情的十点观察与思考[EB/OL]. (2020-06-02)[2020-09-05]. https://www.sohu.
com/a/399325445_114986.
[ 2 ] 赵迎辉.药品专利权与生命健康权的平衡[EB/OL].(2018-07-30)[2020-05-03]. http://ip.people.com.cn/n1/2018/0730/c179663-30177805.html.
[ 3 ] 邱福恩.美国药品专利链接制度实践情况及其启示[J].知识产权,2018(12):87-93.
[ 4 ] 刘宇. TPP医药专利谈判最新发展及争议初探:以知识产权章节为中心[J].国际经贸探索,2014,30(12):81-92.
[ 5 ] 梁志文.美国自由贸易中药品TRIPS-plus保护[J].比较法研究,2014(1):125-140.
[ 6 ] CLARK A M,BERVEN H. The face of the patent is not the“whole story”:determining effective life of a pharmaceutical patent in the United States[J]. World Pat Inform,2004,26(4):283-295.
[ 7 ] 张晓东,李连达.我国药品注册管理法规体系的形成及现状思考[J].中国新药与临床杂志,2010,29(2):155-158.
[ 8 ] RAJI M A,OSTIR G V,MARKIDES K S,et al. Poten- tially inappropriate medication use by elderly Mexican Americans[J]. Ann Pharmacother,2015,37(9):1197-1202.
[ 9 ] FDA. Drug price competition and patent term restoration act of 1984[EB/OL].(2010-05-18)[2020-12-25]. https://www.docin.com/p-55259675.html.
[10] REED F B,JONATHAN J D,AARON S K. Patent term restoration for top-selling drugs in the United States[J].Drug Discov Today,2019,24(1):20-25.
[11] KELLY C. The balance between innovation and competition:the Hatch-Waxman act,the 2003 amendments,and beyond[J]. Food Drug Law J,2011,66(3):417-478,iii.
[12] Merk. Public policy statement:patent term extensions 2011
[EB/OL].(2016-07-21)[2020-12-02]. https://www.docin.com/p-1684011369.html.
[13] 陳果.临时禁令的德国法与欧盟法实践[EB/OL].(2011-12-
02)[2020-02-06]. http://blog.sina.com.cn/s/blog_74352f29-
01010fd9.html.
[14] 苏冬冬.药品专利链接制度的正当性及制度价值分析[J].电子知识产权,2019(3):4-11.
[15] 阳晓伟,杨春学.公地悲剧与反公地悲剧的比较研究[J].浙江社会科学,2019(3):4-12.
[16] 世界卫生组织支持巴西对治疗艾滋病药品专利实施强制许可的决定[EB/OL].(2005-07-01)[2020-05-05]. http://
finance.sina.com.cn/roll/20050701/0540168182.shtml?
from=wap.
[17] 邹瑞雪.印度世界药房简史:宽松政策缔造了印度仿制药的春天[EB/OL].(2018-07-11)[2020-07-01]. http://finance. sina.com.cn/china/2018-07-11/doc-ihfefkqp8736149.shtml.
[18] 余盛峰.仿制药:印度的知识产权谜题[EB/OL].(2018-07-
18)[2020-07-01]. http://www.xinhuanet.com/fortune/2018-
07/18/c_1123141259.htm.
[19] 吴久鸿,李洪.仿制药在美国和印度的生产及使用情况对中国的启示[J].中国药物经济学,2018,13(7):107-114.
[20] 叶霖.中国与印度制药业专利保护立法比较研究[D].北京:北京交通大学,2013.
[21] 陈欣,余翔.专利药品“反公地悲剧”探析[J].科研管理,2007,28(6):149-153.
[22] 公地悲剧与反公地悲剧的原因及对策[EB/OL].(2020-05-
17)[2020-07-11]. https://wenku.baidu.com/view/14f140b-
5961ea76e58fafab069dc5022aaea4607.html.
[23] 张烁.从“反公地悲剧”到《困局经济学》:赫勒“反公地悲剧”理论研究的脉络[J].北大法律评论,2013(1):159- 172.
[24] 李方,张胜,黄欢.专利资源碎片化、反公地悲剧与政府治理[J].科研管理,2019,40(5):212-221.
[25] 詹映.美国专利池反垄断政策的新发展及其对我国的影响[J].科研管理,2011,32(11):77-83.
[26] 王玫黎,谭畅.挑战与回应:我国药品专利制度的未来:以药品专利与健康权的关系为视角[J].知识产权,2017(2):41-47.
[27] 中国产业信息网.行业频道[EB/OL]. (2020-05-08)[2020-
12-17]. https://www.chyxx.com/industry/202005/860003. html.
[28] 中国仿制药的发展现状分析[EB/OL].(2018-09-28)[2020-
05-16]. https://www.lexology.com/library/detail.aspx?g=3fa29251-5a59-43b5-b771-6a4105aa65b7.
[29] 国家知识产权局. 2019年知识产权统计年报[EB/OL].(2020-03-09)[2020-12-05]. https://www.cnipa.gov.cn/col/col61/index.html.
[30] 丁锦希,刘阳阳,胡雪莹.中美仿制药上市准入制度比较研究[J].中国医药工业杂志,2014,45(2):190-198.
[31] 刘蕾.专利法第四次修改若干问题展望[EB/OL].(2020-03-30)[2020-09-11]. https://www.sohu.com/a/416-
864670_120756317.
[32] 国家市场监督管理总局.药品注册管理办法:国家市場监督管理总局令第27号[EB/OL]. (2020-09-01)[2020-12-
20]. https://www.nmpa.gov.cn/zhuanti/ypzhcglbf/index.html.
[33] 李洪江.药品专利链接制度在中国如何落地[EB/OL].(2020-03-11)[2020-11-05]. http://blog.sina.com.cn/s/blog_
542ce8570102yln6.html.
[34] 张清奎.浅析药品注册过程中的专利链接[J].中国新药杂志,2007,16(8):577-579.
[35] 牛炬钦.浅谈美国的专利无效制度[EB/OL].(2020-05-03)
[2020-12-07]. https://www.sohu.com/a/392712367_1206-
93751.
[36] 黄玉烨,李青文.知识产权审判中技术调查官的困境与出路:兼评《最高人民法院关于技术调查官参与知识产权案件诉讼活动的若干规定》[J].电子知识产权,2019(8):67-76.
[37] 国家药监局综合司.国家药监局综合司 国家知识产权局办公室公开征求《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》的意见[EB/OL].(2020-09-11)[2020-
10-01]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/
20200911175627186.html.
[38] 美国医药专利保护Hatch-Waxman法案[EB/OL].(2018-07-28)[2020-10-21]. https://max.book118.com/html/2018/0728/8061030053001116.shtm.
[39] JOEL L. Canadas Patented Medicine Notice of Comp- liance regulations:balancing the scales or tipping them?[J]. BMC Health Ser Res,2011,11:64-69.
[40] 许俊才,方宁涛.美国食品药品监督管理局百年发展历程带给我国药品监管体系的启示[J].药政管理,2008,29(7):25-27.
[41] 何志鹏.国际经济法治格局的研判与应对:兼论TPP的中国立场[J].当代法学,2016,30(1):51-52.
(收稿日期:2021-02-03 修回日期:2021-08-03)
(编辑:孙 冰)

