藏红花球茎腐烂病病原鉴定及防治药剂室内筛选
魏琳 段晓明 芦光新 常建萍 周孝娟 马海霞 祁鹤兴


摘要 球茎腐烂病是严重影响藏红花球茎品质和柱头产量的病害。为鉴定引起藏红花球茎腐烂病的病原菌及筛选防治该病害的有效杀菌剂,本研究基于形态学特征、rDNA-ITS和TEF-1α序列分析,对青海省藏红花球茎腐烂病的病原菌进行了鉴定,并利用菌丝生长速率法测定了10种杀菌剂对病原菌的抑菌作用。结果发现,引起藏红花球茎腐烂病的病原菌为尖孢镰刀菌Fusarium oxysporum和木贼镰刀菌F.equiseti,其中尖孢镰刀菌为优势病原菌。室内药剂试验表明70%甲基硫菌灵WP、 50%咯菌腈WP、 50%苯醚甲环唑SC和25%硅唑·咪鲜胺EW对两种镰刀菌均具有较好的抑制作用,EC50在0.574 0~1.808 6 mg/L之间,64%噁霜·锰锌WP、 30%噁霉灵AS和45%石硫合剂WP对2种镰刀菌的抑菌作用较差,EC50在2.134 4~7.915 3 mg/L之间。试验结果为生产上合理选用杀菌剂防治藏红花球茎腐烂病提供了科学依据。
关键词 藏红花球茎腐烂病; 尖孢镰刀菌; 木贼镰刀菌; 杀菌剂筛选
中图分类号: S 435.672
文献标识码: A
DOI: 10.16688/j.zwbh.2020521
Identification of saffron corm rot disease pathogen and laboratory screening of chemical agents
WEI Lin, DUAN Xiaoming, LU Guangxin, CHANG Jianping, ZHOU Xiaojuan, MA Haixia, QI Hexing*
(College of Agriculture and Animal Husbandry, Qinghai University, Xining 810016, China)
Abstract
Saffron corm rot disease has a strong impact on the quality of saffron corm and the yield of stigma. For identifying the pathogenic fungi of saffron corm rot disease and screening the effective fungicides for controlling this disease, this study aimed at identifying the pathogen based on morphological characteristics, rDNA-ITS and TEF-1α sequence analysis. The inhibition effects of ten fungicides on the pathogens were also determined by using mycelial growth rate method in this study. The results showed that Fusarium oxysporum and F.equiseti caused saffron corm rot disease, and F.oxysporum was the dominant pathogen. Laboratory fungicide experiments demonstrated that thiophanate-methyl 70% WP, fludioxonil 50% WP, difenoconazole 50% SC and flusilazole·prochloraz 25% EW had a strong inhibition effect on F.oxysporum and F.equiseti, with an EC50 value of 0.574 0-1.808 6 mg/L. The inhibition effect of oxadixyl·mancozeb 64% WP, hymexazol 30% AS and lime sulphur 45% WP was worse, with an EC50 value of 2.134 4-7.915 3 mg/L. The results provide a scientific basis for using fungicides to control saffron corm rot disease in saffron production.
Key words
saffron corm rot disease; Fusarium oxysporum; Fusarium equiseti; screening of fungicide
藏紅花Crocus sativus L.又名番红花,西红花,属鸢尾科Iridaceae,多年生,短日照草本植物[1]。主要分布在欧洲、地中海及中亚等地,最早在希腊人工栽培,汉朝时传入我国西藏,因此有藏红花、番红花之称[2]。藏红花以柱头入药,是一种名贵的中药材,具有祛瘀生新、活血通经、凉血解毒、解郁安神等功效[3-5]。此外,藏红花球茎又可做高档观赏花卉出售,因此,藏红花具有较高的经济价值[6]。我国从80年代初在上海引种成功后,随后在江苏、浙江、江西、福建、北京、湖南、新疆、河南、江西、广西和青海等22个省区市陆续引种[7-9]。目前藏红花的主产区在上海、江苏和浙江等地,并被作为高附加值经济作物进行种植,国内多数地区种植藏红花采用“大田培育大球茎,室内培育大花蕊”的二段式栽培模式或者露地栽培模式[1,10]。青海省地处青藏高原,境内各地区年平均气温在-5.1~9.0℃,在当地采用设施栽培模式种植藏红花。青海省主产区在西宁市大通县、海东群科、海西德令哈、海东市乐都区等地[9],2020年,青海省藏红花栽培面积约为2 hm2。
近十几年来市场对藏红花的需求日益增加,人工栽培面积逐年上升,藏红花球茎腐烂病已成为其生产上最严重的病害,在种球储存期和种植期病球率高达30%~70%,造成了很大的经济损失,严重影响了球茎、柱头的品质和产量[11]。青海省因种植地气候条件的不同,藏红花受该病害的影响也有所不同,如年平均气温为7.6℃的西宁地区藏红花发病较重,而年平均气温为-3.9℃的果洛地区藏红花发病较轻。藏红花球茎腐烂病由真菌引起,病原菌主要为巴西曲霉Aspergillus brasiliensis[12]、尖孢镰刀菌Fusarium oxysporum[13-14]、茄病镰刀菌F.solani[15]、丛花青霉Penicillium corymbiferum[16]和炭疽菌Anthracnose sp.等[6],且该病害在秋季发病率最高。目前,国内对上海、贵州和浙江等地的藏红花球茎腐烂病有过报道[6,11-12],但是对青海省藏红花球茎腐烂病病原尚未进行过鉴定和报道。
本研究从青海省西宁市城北区二十里铺镇玛可河林业局苗木培育基地采集藏红花病种球进行病原菌的分离、鉴定和室内药剂防治效果测定。在明确病原菌种类的前提下,筛选出能有效抑制病原菌生长的高效杀菌剂,旨在为后续开展大田防治提供理论依据和基础。
1 材料与方法
1.1 材料来源
2019年10月-12月从青海省西宁市城北区二十里铺镇玛可河林业局苗木培育基地(101°45′13″E,36°43′43″N;海拔:2 314 m)采集苗期病种球,并及时带回实验室分离病原菌。
1.2 培养基配制
马铃薯葡萄糖琼脂培养基(PDA)配制参照祁鹤兴等[17]的方法;2%水琼脂培养基(2%WA):琼脂20 g, 蒸馏水定容至1 L。CM固体培养基:酵母提取物6 g,酶水解干酪素3 g,酸水解干酪素3 g,蔗糖10 g溶于900 mL ddH2O中,混匀后定容至1 L,121℃高压蒸汽灭菌20 min,备用。
1.3 杀菌剂
99%高锰酸钾颗粒剂(GR),白银良友化学试剂有限公司;64%噁霜·锰锌可湿性粉剂(WP),先正达作物保护有限公司;50%多菌灵可湿性粉剂(WP),四川润尔科技有限公司;25%溴菌腈可湿性粉剂(WP),江苏托球农化股份有限公司;70%甲基硫菌灵可湿性粉剂(WP),济南泰禾化工有限公司;50%咯菌腈可湿性粉剂(WP),先正达作物保护有限公司;30%噁霉灵水剂(AS),江西禾益化工股份有限公司;50%苯醚甲环唑悬浮剂(SC),江苏云帆化工有限公司;25%硅唑·咪鲜胺水乳剂(EW),上海沪联生物药业股份有限公司;45%石硫合剂可湿性粉剂(WP),河北双吉化工有限公司。
1.4 病原菌的分离、纯化与保存
在病种球病健交界处切取小块组织,置于35%次氯酸钠溶液中消毒1 min,然后用无菌水冲洗3次,用无菌滤纸吸干,放在含0.1%氨苄青霉素的水琼脂平板上,置于26℃培养箱中培养36 h。用无菌水将长出的分生孢子洗下配成浓度为2×104个/mL 的孢子悬浮液,吸取200 μL孢子悬浮液于2%水琼脂平板上涂抹均匀,在超净工作台中吹干,于26℃培养箱中培养至孢子萌发,在体视显微镜下挑取萌发的单个分生孢子至PDA平板。将分离到的单孢菌株采用滤纸片保存法[18],置于-20℃冰箱长期保存。
1.5 病原菌的分类鉴定
1.5.1 菌株形态学鉴定
将分离得到的单孢菌株接种于CM平板上,置于25℃培养箱中光照培养7 d,挑取分生孢子制成临时玻片,在光学显微镜(40×)下观察分生孢子形态。菌株在CM平板上生长5 d后,用直径0.5 cm的打孔器打取菌饼放置在CM平板中。每株菌株3个重复,并且每皿培养基的厚度保持一致。放置于25℃培养箱培养6 d后观察菌落形态。
1.5.2 菌株基因组DNA的提取
采用CATB法提取基因组DNA[19],步骤如下:1)刮取在PDA平板上培养了5 d的病原菌菌落气生菌丝,置于离心管中,用细胞破碎仪破碎细胞。2)在离心管中加入 2×CTAB抽提液600 μL,混合均匀,65℃孵育30 min,每隔10 min颠倒混匀1次。3)孵育完成后,取出离心管,待其冷却至室温后,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),充分混匀后,12 000 r/min、4℃离心15 min。4)吸取500 μL上清液于1.5 mL灭菌离心管中,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),充分混匀后12 000 r/min、4℃、离心15 min。之后再吸取400 μL上清重复抽提1次。5)吸取上清300 μL,加入0.6倍体积的异丙醇,-20℃沉淀30 min。6)12 000 r/min、4℃、離心15 min。7)弃上清,70%乙醇洗沉淀2次,烘干,用25 μL TE/RNase溶解,-20℃保存。
1.5.3 菌株序列分析
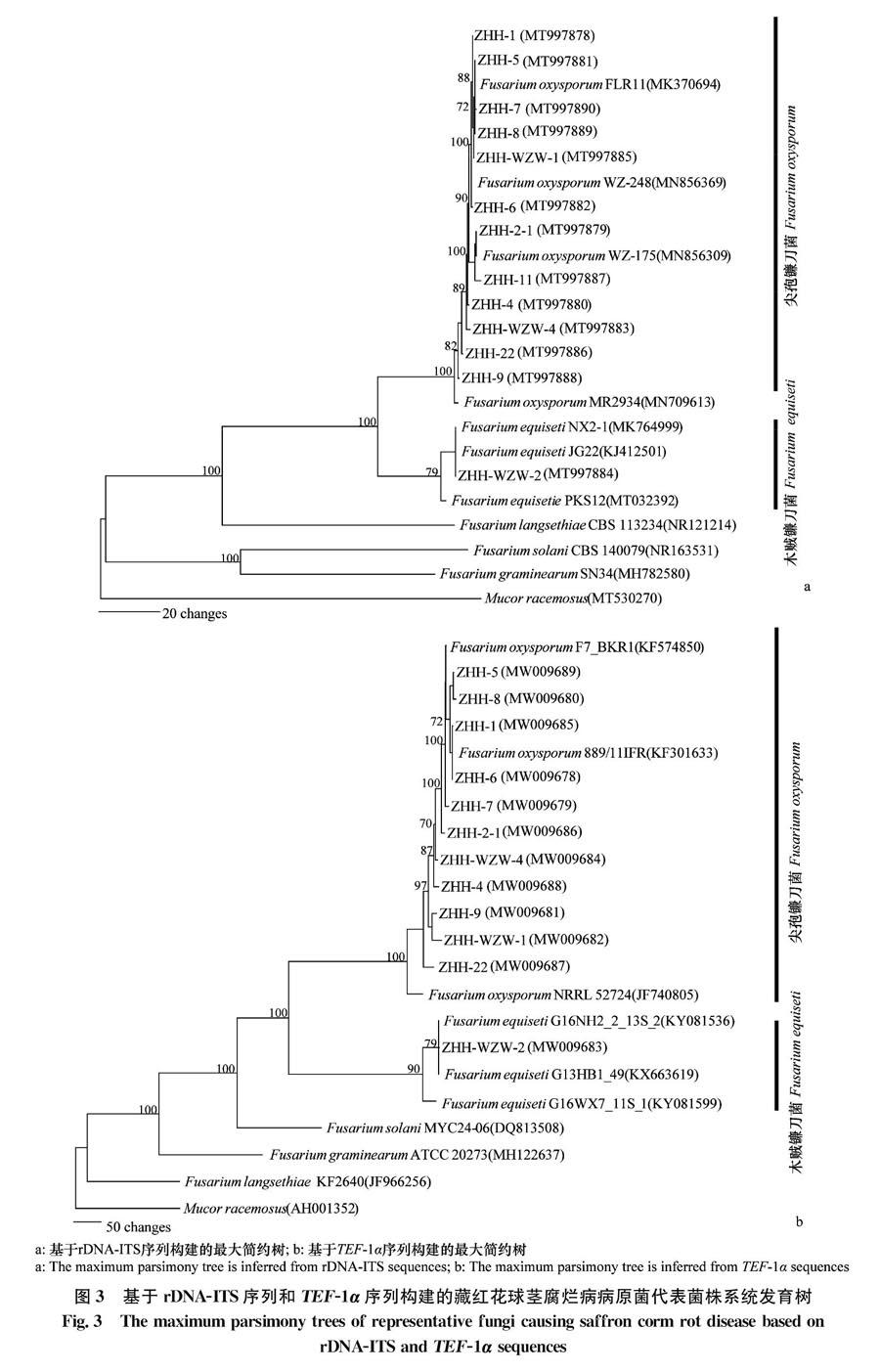
rDNA-ITS扩增引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[20],TEF-1α基因扩增引物:EF-1(5′-ATGGGTAAGGA(A/G)GACAAGAC-3′)和EF-2(5′-GGA(G/A)GTACCAGT(G/C)ATCATGTT-3′)[21-22]。反应体系(25 μL):2×PCR Mix(北京天根生物科技)12.5 μL;上下游引物各(25 pmol/L)1.0 μL,;模板DNA(30 μg/L)1.0 μL;双蒸水补足至25 μL。PCR反应程序:95℃,5 min;95℃,1 min,55℃,1 min,72℃,2 min,30个循环;72℃,10 min。用0.8%的琼脂糖凝胶电泳检测产物,PCR扩增产物纯化后由北京擎科新业生物技术公司进行双向测序。使用软件 MAFFT对正反向序列进行拼接,拼接序列在 MEGA 6.0.6 软件进行校正。使用 PAUP* v. 4.0 alpha 软件构建最大简约树,采用启发式算法(heuristic searches)进行运算。以总状毛霉Mucor racemosus (GenBank 登录号:MT530270和AH001352) 作为外群,运算重复 1 000次。参照菌株序列下载自NCBI 数据库。13株菌株rDNA-ITS序列GenBank登录号为MT997878~MT997890,12株菌株TEF-1α基因登录号为MW009678~MW009689。
1.6 病原菌回接试验
将菌株接种至PDA培养基平板,25℃培养 7 d,用0.025% Tween 20溶液洗下分生孢子并制备浓度为1×105个/mL的孢子悬浮液。在塑料盆底盛放一定量的水,中间放置间隔板,在间隔板上放置健康藏红花种球,孢子悬浮液点接于球茎表面,共4点每点接种10 μL,以接种无菌水为对照。置于25℃培养箱黑暗保湿培养24 h后进行光照培养。接种7 d后观察种球发病情況。
1.7 杀菌剂的抑菌作用测定
采用菌丝生长抑制法。用分析天平准确称量杀菌剂,分别放入5 mL EP管中,加入一定体积的二甲基亚砜(DMSO),振荡至药剂充分溶解,配制成105 mg/L的母液,4℃黑暗保存备用。之后用DMSO稀释,制成系列浓度梯度药液,加入CM培养基中,充分摇匀,制成含药平板(9 cm),以加入等量DMSO的CM培养基为对照。99%高锰酸钾GR设置7个浓度梯度,分别为:05、1、2、4、8、16、32 mg/L;25%溴菌腈WP、50%多菌灵WP、50%咯菌腈WP和45%石硫合剂WP设置6个浓度梯度,分别为:0.4、0.9、1.6、3.2、6.4 mg/L和12.8 mg/L;64%噁霜·锰锌WP和30%噁霉灵AS设置6个浓度梯度,分别为:0.5、1、2、4、8 mg/L和16 mg/L;70%甲基硫菌灵WP设置7个浓度梯度,分别为:0.3、09、1.2、2.4、4.8、9.6 mg/L和19.2 mg/L:50%苯醚甲环唑SC和25%硅唑·咪鲜胺EW设置7个浓度梯度,分别为:0.4、0.9、1.6、3.2、6.4、128 mg/L 和25.6 mg/L。
用灭菌的打孔器在菌落边缘打取直径5 mm的菌饼,接种到含药平板中央,每处理3次重复,25℃黑暗培养6 d后,用十字交叉法测量菌落直径,计算菌丝生长抑制率。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
使用SPSS 17.0数据处理软件,求得b值±标准误差、EC50、95%置信限、卡方值。
2 结果与分析
2.1 藏红花球茎腐烂病病原鉴定
从采集的藏红花球茎腐烂病病种球上共分离得到26株菌株,分离菌株经柯赫氏法则验证,对藏红花球茎均有致病性(图1)。经形态学鉴定26株病原菌均为镰刀菌,菌丝白色至淡粉红色。有的菌株菌落呈轮纹状,如菌株ZHH-7和ZHH-22,且菌株ZHH-22菌丝不发达,生长较慢(ZHH-22平均生长速率为127 cm/d,ZHH-7为1.41 cm/d)(图2)。25株菌株的大型分生孢子略弯曲,但菌株ZHH-WZW-2的大型分生孢子与其他菌株相比明显不同,该菌株大型分生孢子弯曲弧度较大,且气生菌丝呈棉絮状(图2)。
根据形态特征分析结果,选择13株代表病原菌进行分子生物学鉴定,将所测得代表菌株的rDNA-ITS序列和TEF-1α基因序列在GenBank中与已知序列进行BLAST相似性比较分析,以已在NCBI公布序列的菌株为参考菌株,构建系统发育树,以确定菌株的分类地位。
基于菌株rDNA-ITS序列构建系统发育树(图3a),发现菌株ZHH-WZW-2与木贼镰刀菌F. equiseti在同一发育分支上,亲缘关系最近,rDNA-ITS序列相似性为99.21%。ZHH-1、ZHH-7和ZHH-22等12株菌株与尖孢镰刀菌F.oxysporum聚为1个大分支,rDNA-ITS序列相似性均大于99%。基于菌株TEF-1α基因序列构建系统发育树(图3b),同样发现菌株ZHH-WZW-2与木贼镰刀菌在同一发育分支上,亲缘关系最近,TEF-1α基因序列相似性为99.69%。ZHH-1、ZHH-7和ZHH-22等11株菌株与尖孢镰刀菌聚为1个分支,亲缘关系最近,序列相似性均大于99%。
2.2 病原菌对杀菌剂的敏感性
通过测定10种杀菌剂对尖孢镰刀菌ZHH-1和木贼镰刀菌ZHH-WZW-2菌丝生长的抑制作用,发现其中4种杀菌剂70%甲基硫菌灵WP、50%咯菌腈WP、50%苯醚甲环唑SC和25%硅唑·咪鲜胺EW对2种镰刀菌均具有很强的抑制作用,EC50在0.574 0~1.808 6 mg/L之间。其中50%苯醚甲环唑SC对尖孢镰刀菌的EC50最低。64%噁霜·锰锌WP、30%噁霉灵AS和45%石硫合剂WP对2种镰刀菌的抑菌作用较差,EC50在2.134 4~7.915 3 mg/L之间。同一种杀菌剂对不同镰刀菌的抑制作用存在差异,99%高锰酸钾GR、25%溴菌腈WP、50%多菌灵WP、50%苯醚甲环唑SC、25%硅唑·咪鲜胺EW和45%石硫合剂WP对尖孢镰刀菌的抑制作用强于对木贼镰刀菌,即尖孢镰刀菌比木贼镰刀菌对这6种杀菌剂更为敏感。99%高锰酸钾GR、25%溴菌腈WP和50%多菌灵WP对尖孢镰刀菌都具有一定的抑制作用,但是这3种杀菌剂分别在0.5~320 mg/L、0.4~12.8 mg/L和0.4~12.8 mg/L供试浓度范围内对木贼镰刀菌没有抑制作用。64%噁霜·锰锌WP、70%甲基硫菌灵WP、50%咯菌腈WP和30%噁霉灵AS对木贼镰刀菌的抑制作用强于对尖孢镰刀菌,即木贼镰刀菌比尖孢镰刀菌对这4种杀菌剂更为敏感(表1)。
3 结论与讨论
镰刀菌属真菌可引起多种药用植物根部病害,国内外已有研究报道,引起藏红花根腐病的镰刀菌包括尖孢镰刀菌和茄病镰刀菌[13-15],本研究经形态学和系统发育分析发现,青海地区引起藏红花球茎腐烂病的镰刀菌有尖孢镰刀菌和木贼镰刀菌,其中尖孢镰刀菌为优势病原菌。玛可河林业局苗木培育基地藏红花种球引种自河南,病原菌有可能来源于产地,也有可能是土著病原菌。
藏红花染色体是三倍体,花粉败育高,开花后不结种子,生产上采用无性繁殖方法,且繁殖率较高。原产地一般采用种球连续多年重复种植方式,11月中旬露地开花[23-24]。在青海多数地区采用设施栽培模式种植藏红花,枯黄期(4月-5月)挖出种球在室内通风干燥保存,9月初陆续开始种植。
本研究通过测定10种杀菌剂对尖孢镰刀菌和木贼镰刀菌代表菌株菌丝生长的抑制作用,发现不同杀菌剂对这2种镰刀菌的抑制作用有所不同。如25%溴菌腈WP和50%多菌灵WP对尖孢镰刀菌有一定的抑制作用,但是在供试浓度范围内对木贼镰刀菌没有抑制作用。
张国辉等对贵州省藏红花球茎腐烂病病原菌镰刀菌进行室内药剂防治时,发现多菌灵的防治效果最好[6]。赵丽娟对上海藏红花致病菌尖孢镰刀菌进行药剂防治,发现溴菌腈的抑制效果最好[12]。本试验结果与文献报道结果有所差异,可能与菌株个体差异和地域差异有關。本研究还发现甲基硫菌灵、咯菌腈、苯醚甲环唑和硅唑·咪鲜胺对2种镰刀菌的抑制作用较好,周双等对浙江省藏红花腐烂病病原尖孢镰刀菌进行室内药剂防治,也发现咯菌腈对病原菌的抑制作用较好[11]。同一药剂对不同镰刀菌菌株敏感性差异极大的情况也有过类似报道,如许媛等通过测定不同杀菌剂对34株草莓枯萎病病原菌尖孢镰刀菌的抑制作用发现,咪鲜胺EC50范围为0.001 1~0.128 2 mg/L[25]。本试验结果为藏红花球茎腐烂病的化学防治提供了候选药剂,也为药剂的轮换使用提供了科学依据。
参考文献
[1] 顾立群,高凯娜,陈虹,等.藏红花栽培技术研究[J].现代园艺, 2019(5):42-44.
[2] 陈云章,李玉芳.西红花的高产栽培[J].广西农业科学, 2002(6):328-329.
[3] 李珅,胡绍玲,汪文成,等.藏红花资源及栽培技术研究概况[J].青海农林科技,2017(3):38-41.
[4] ABDULLAEV F I, ESPINOSAAGUIRRE J J. Biomedical properties of saffron and its potential use in cancer therapy and chemoprevention trials [J]. Cancer Detection Prevention, 2004,28(6):426-432.
[5] 邓颖,郭志刚,曾兆麟,等.藏红花的药理研究进展[J].中国中药杂志,2002,8(27):565-568.
[6] 张国辉,张西平,张年富,等.藏红花球茎腐烂病的病原鉴定及药剂预防[J].凯里学院学报,2009,27(3):47-49.
[7] 杨全.西红花中草药栽培技术Ⅱ[M].延吉:延边人民出版社,2002: 151-154.
[8] 姚宗凡,黄英姿,姚晓敏.西红花药用植株栽培手册[M].上海: 上海中医药大学出版社,2001: 333-339.
[9] 李玉,段晓明.青海不同区域番红花栽培研究[J].南方农机,2018,49(17):79-80.
[10]林东昊,茅人飞.国内外不同来源藏红花的品质评价[J].食品研究与开发,2019,40(13):178-182.
[11]周双,白洁,陈放.藏红花腐烂病病原真菌的分离鉴定及药剂防治[J].四川大学学报(自然科学版),2015, 52(4):911-916.
[12]赵丽娟.西红花致病菌的分离鉴定及其防治药物的筛选[D].上海: 上海师范大学, 2014.
[13]吴李芳.西红花球茎腐烂病的致病菌鉴定及其生防菌解淀粉芽孢杆菌C612的筛选和应用[D].杭州:浙江大学,2016.
[14]CAPPELLI C. Occurrence of Fusarium oxysporum f. sp. gladioli on saffron in Italy [J]. Phytopathologia Mediterranea, 1994,33:93.
[15]SUD A K, PAUL Y S, THAKUR B R. Corm rot of saffron and its management [J]. Journal of Mycology and Plant Pathology,1999,29(3):380.
[16]顾振芳,支月娥.番红花丛花青霉菌(Penicillium corymbiferum)的生物学特性[J].上海农业学报,1997,13(4):71-74.
[17]祁鹤兴,周星辰,胡美娟,等. 宁夏白芨滩自然保护区苦豆子内生放线菌多样性及其分布[J]. 微生物学通报, 2015,42(6):990-1000.
[18]VALENT B, CRAWFORD M S, WEAVER C G, et al. Genetic studies of fertility and pathogenicity in Magnaporthe grisea (Pyricularia oryzae) [J]. Iowa State Journal of Research, 1986, 60:569-594.
[19]ROGERS S O, BENDICH A J. Extraction of DNA from milligram amount of fresh, herbarium, and mummified plant tissue [J]. Plant Molecular Biology, 1985, 5(2):69-76.
[20]祁鹤兴,贾倩,高媛,等.宁夏枸杞果内生真菌多样性及其分布[J].北方园艺,2015(13):153-157.
[21]BOUHADIDA M, JENDOUBI W, GARGOURI S, et al. First report of Fusarium redolens causing Fusarium yellowing and wilt of chickpea in Tunisia [J].Phytopathology, 2017,101(1):1038.
[22]HERKERT P F, AL-HATMI A M S, SALVADOR G L D O, et al. Molecular characterization and antifungal susceptibility of clinical Fusarium species from Brazil [J/OL].Frontiers in Microbiology, 2019,10:737. DOI: 10.3389/fmicb.2019.00737.
[23]姚冲,刘兵兵,周桂芬,等.影响西红花产量和品质的诸因素研究进展[J].中药材,2017,40(3):738-743.
[24]AHRAZEM O, RUBIO-MORAGA A, NEBAUER S G, et al. Saffron: Its phytochemistry, developmental processes, and biotechnological prospects [J]. Journal of Agricultural and Food Chemistry, 2015,63(40):8751-8764.
[25]许媛, 成玮, 颜伟中, 等. 上海地区草莓枯萎病病菌的鉴定及对4类杀菌剂的敏感性[J].江苏农业科学,2020,48(4):115-121.
(责任编辑:杨明丽)

