烟粉虱细胞色素CYP6EM1基因的克隆及对吡虫啉抗性的作用
赵倩楠 黄明娇 危学高 杨静 杜田华 殷城 向文胜 杨鑫 张友军

摘要 烟粉虱是一种世界性农业害虫,其防治手段以化学防治为主,新烟碱类杀虫剂吡虫啉常年用于防治烟粉虱,田间烟粉虱已经形成严重的抗药性。本研究通过分析烟粉虱吡虫啉抗性和敏感种群,发现细胞色素CYP6EM1基因在吡虫啉抗性品系中上调了4.7倍,进而克隆了其全长基因,进行了荧光定量PCR分析,发现该基因在吡虫啉抗性烟粉虱3龄若虫期和雄虫成虫期过量表达,并且在抗性成虫胸部和腹部过量表达。最后通过RNA干扰的方法使成虫的CYP6EM1基因表达量下降了54.8%,之后发现当烟粉虱暴露于吡虫啉时死亡率显著升高了3965%,这表明CYP6EM1与烟粉虱对吡虫啉抗性的形成相关。研究结果对于揭示烟粉虱对吡虫啉产生抗性的机制有帮助,也为烟粉虱抗性水平田间监测及烟粉虱综合治理提供理论依据。
关键词 烟粉虱; 吡虫啉; 细胞色素P450; RNA干扰
中图分类号: S 481.4
文献标识码: A
DOI: 10.16688/j.zwbh.
2020279
Cloning of cytochrome P450 gene CYP6EM1 and its function in imidacloprid resistance in whitefly, Bemisia tabaci
ZHAO Qiannan1, HUANG Mingjiao2, WEI Xuegao2, YANG Jing2, DU Tianhua2,YIN Cheng2, XIANG Wensheng1, YANG Xin2, ZHANG Youjun1,2*
(1. College of Life Science, Northeast Agricultural University, Harbin 150030, China; 2. Institute of Vegetables
and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract
Whitefly, Bemisia tabaci, is a global harmful pest, and insecticides were widely used to control this pest. Imidacloprid, one of the neonicotinoid insecticides, has been used to control whitefly for many years. However, resistance to imidacloprid has been developed in field strains. In this study, the imidacloprid resistant and susceptible populations were compared, and a cytochrome P450 gene, CYP6EM1 was found to be over-expressed in resistant strain for 4.7 fold. The full length of CYP6EM1 was cloned and the mRNA expression level was analyzed by qRT-PCR. The results showed that CYP6EM1 was over-expressed in the third instar nymph and male adult of B.tabaci of imidacloprid resistance, and abound in thorax and abdomen of resistant adult. Moreover, the expression level of CYP6EM1 gene in adults was reduced by 54.8% by RNA interference. Then, it was found that the mortality of B.tabaci significantly increased by 39.65% when exposed to imidacloprid. This study is conducive to revealing the imidacloprid resistance mechanism of B.tabaci and provides a theoretical significance to determine the status of imidacloprid resistance in B.tabaci in the field and further establish the IPM strategies for whiteflies.
Key words
Bemisia tabaci; imidacloprid; cytochrome P450; RNA interference
烟粉虱Bemisia tabaci是一种世界性园艺害虫,寄主植物广泛,目前已经报道的寄主植物已经超过600多种,具有广泛的植物适应性[1]。烟粉虱为害主要有三种途径:直接吸食植物汁液使得植物生长缓慢,严重时萎蔫;分泌蜜露诱发煤污病影响植物光合作用;传播植物病毒,特别是植物双生病毒,导致大面积植株矮小,结实率降低甚至绝产,造成严重的经济危害[2-4]。
烟粉虱的防治以化学防治为主,由于烟粉虱是一种刺吸性小型蔬菜害虫,主要在植物叶片背部刺吸植物汁液,传统的触杀型杀虫剂很难防治烟粉虱,而具有植物内吸性的新烟碱类杀虫剂是防治烟粉虱等刺吸性害虫的首选药剂,对烟粉虱成虫及若虫均有很好的防效[5]。其中吡虫啉作为第一代新烟碱类杀虫剂广泛用于防治烟粉虱,但是随着吡虫啉长期、大量的施用,导致了严重的抗药性[5-8]。2007年在我国首次发现烟粉虱对吡虫啉产生抗药性;虽然北京和新疆的烟粉虱对吡虫啉敏感,但是浙江、江苏和湖北的烟粉虱对其产生了中到高水平的抗性,抗性倍数(抗性倍数=抗性种群的LC50/敏感参考种群的LC50)达到23~84倍[9]。2009年采集自江蘇省的烟粉虱对吡虫啉表现出极高的抗性,抗性倍数达1 900倍[10]。大量的田间烟粉虱抗性水平监测结果表明,自然环境中的烟粉虱对吡虫啉产生了严重的抗药性[11]。
害虫产生抗药性的机制主要有两种,分别为药物靶标不敏感导致的靶标抗性和解毒酶过量表达导致的解毒抗性。靶标抗性的典型研究为褐飞虱乙酰胆碱受体突变(Y151)导致吡虫啉在褐飞虱体内的结合能力减弱,从而形成抗药性[12];另外田间蚜虫乙酰胆碱受体突变(R81T)导致蚜虫对吡虫啉抗性水平显著升高[13]。烟粉虱产生抗药性的机制主要集中在解毒酶过量表达,尚未有靶标受体突变导致的抗药性相关报道。例如CYP6CX1显著高表达可能与福建省上街镇的田间烟粉虱对氰戊酸酯、毒死蜱和阿维菌素的抗性相关[14]。田间烟粉虱对吡虫啉产生抗性与2个细胞色素P450基因(CYP6CM1和CYP4C64)的表达量增加有关[15]。CYP6CM1基因过量表达,在B型烟粉虱和田间危害严重的Q型烟粉虱中形成抗药性,它能将吡虫啉代谢成毒力更低的羟基化吡虫啉[15-17]。
前期研究发现当室内饲养的烟粉虱暴露于吡虫啉时CYP6EM基因的表达水平提高[18],但是否能在烟粉虱种群形成抗药性尚不得知。基于烟粉虱基因组序列克隆获得烟粉虱CYP6EM1基因的全长序列,通过荧光定量PCR分析了该基因在烟粉虱不同发育龄期和组织中的表达量,并且分析该基因在烟粉虱吡虫啉抗敏品系中的表达量,最后通过RNA干扰技术研究了该基因在吡虫啉抗性中的作用。
1 材料与方法
1.1 供试烟粉虱
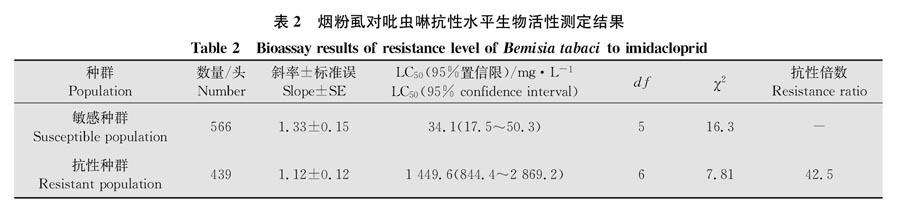
供试烟粉虱来自中国农业科学院蔬菜花卉研究所一直饲养的Q型烟粉虱种群,于温室内饲养在棉花Gossypium herbaceum‘DP99B上,其中吡虫啉敏感种群一直未接触任何杀虫剂,用吡虫啉汰选获得的抗性种群,其吡虫啉抗性倍数约为42.5倍(表2)。温室饲养条件为温度(25±1)℃、相对湿度(70±5)%、光周期L∥D=14 h∥10 h。
1.2 供试杀虫剂
70%吡虫啉水分散粒剂(WG),拜耳作物科学有限公司。
1.3 烟粉虱生物测定
烟粉虱成虫生物测定采用浸液法,具体操作參考Feng等[19]的方法。吡虫啉药剂配制6个浓度,分别是50、100、200、400、800、1 600 mg/L和1组空白对照,每个浓度设置4个生物学重复,在蒸馏水中加入0.01%曲拉通,便于药剂在叶片表面附着。指形管底部平铺2%的液态琼脂,待凝固后并且管壁水蒸气晾干,同时用直径22 mm的打孔器打取棉花叶片,每片浸药10 s,待晾干后轻放于指形管的琼脂上方,每管接入20~30头烟粉虱,用棉塞封口。将整个装置于培养箱(温度25℃,光周期L∥D=14 h∥10 h)中倒置,48 h后检测生测结果。
1.4 提取RNA及合成cDNA
用吸虫管从养虫笼中取50头烟粉虱成虫,液氮速冻5 min后用TRizol法提取RNA,利用分光光度计检测样品浓度以及琼脂糖凝胶电泳检测RNA质量,并且参照TaKaRa反转录合成试剂盒说明书合成cDNA。
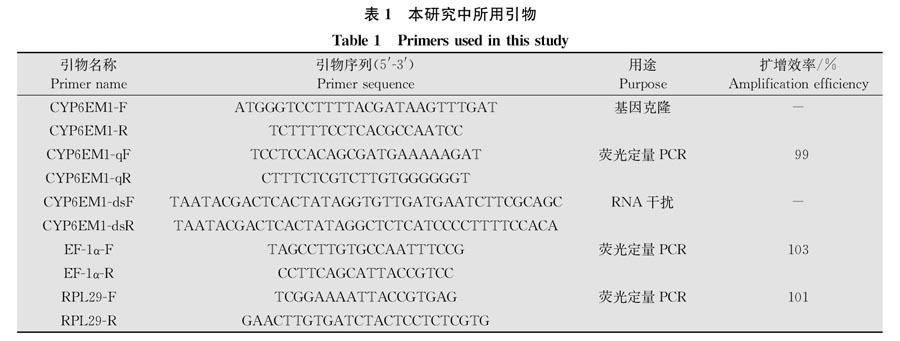
1.5 克隆CYP6EM1基因及序列分析
CYP6EM1(BTA005348.1)基因全长通过烟粉虱基因组序列获得,扩增引物CYP6EM1-F/R(表1)用Primer Premier 5.0 软件设计,由生工生物工程(上海)股份有限公司合成。以烟粉虱cDNA为模板,进行PCR反应,反应体系:1.0 μL cDNA,125 μL Taq酶 mix,10 μmol/L的上、下游引物各05 μL,105 μL ddH2O。PCR反应程序:95℃预变性 5 min;95℃变性 30 s,60℃退火1 min,72℃延伸2 min,共35个循环;72℃再延伸10 min。通过琼脂糖凝胶电泳检测PCR扩增产物后将目的条带切下,用DNA琼脂糖凝胶回收试剂盒(Promega)进行胶回收,连接回收产物到pEASY-T1克隆载体上,转化到DH5α感受态细胞,进行蓝白斑筛选,挑选阳性克隆,送北京擎科生物技术有限公司测序,在NCBI上比较分析测序结果。利用ExPASy翻译工具Translate (http:∥web.expasy.org/translate/) 推断蛋白序列。利用ExPASy蛋白组学工具Compute pI/Mw (http:∥ca.expasy.org/tools/pi_tool.html) 预测分子量(Mw) 和等电点(pI)。通过ClustalW[20]比对,利用MEGA 7.0的最大似然法,构建系统发育树,bootstrap重复取样次数为1 000,分析CYP6EM1基因在不同昆虫间的进化关系。
1.6 分析CYP6EM1基因表达量
分别收集烟粉虱卵、1~4龄若虫、雌性和雄性成虫,每个龄期收集3个生物学重复,卵的1个生物学重复收集700粒,各个龄期若虫的1个生物学重复收集100头,成虫的1个生物学重复收集50头。再分别收集烟粉虱成虫的头部、胸部和腹部,每个部位收集3个生物学重复,头的1个生物学重复收集500头,胸和腹的1个生物学重复收集150头。分别提取RNA,取1 μg总RNA反转录合成cDNA,用于研究CYP6EM1基因在吡虫啉抗性烟粉虱不同龄期和组织的表达量。对于吡虫啉抗性和敏感烟粉虱
种群,比较它们成虫阶段的差异。依据克隆获得的CYP6EM1基因全长序列,设计荧光定量PCR(qRT-PCR)引物CYP6EM1-qF/-qR(表1),烟粉虱核糖体蛋白L29(ribosomal protein L29, RPL29)和延伸因子(elongation factors-1α,EF-1α)作为内参基因。qRT-PCR采用SYBR Green I染料进行,20 μL反应体系:1.0 μL cDNA模板,10 μL 2×SuperReal PreMix Plus, 10 μmol/L上、下游引物各0.5 μL,7.6 μL RNase-free ddH2O,0.4 μL 50×ROX Reference Dye。反应条件:95℃预变性10 min;95℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。qRT-PCR引物的扩增效率通过3倍梯度稀释的cDNA模板的Ct值来计算。根据2-ΔΔCt法计算在烟粉虱不同发育龄期和组织,以及吡虫啉抗性和敏感种群之间CYP6EM1基因表达量的差异。
1.7 RNA干扰
通过设计合成dsCYP6EM1以及对照外源基因dsGFP,进行CYP6EM1的RNA干扰试验。采用饲喂法进行烟粉虱的RNA干扰试验[21]。48 h后取存活的烟粉虱进行qRT-PCR分析CYP6EM1基因的RNA干扰效率,确定该基因被干扰后进行吡虫啉抗性水平的测定。每个饲喂室加入dsRNA饲喂液100 μL,CYP6EM1基因的dsRNA浓度为0.5 μg/μL。每个饲喂室放置烟粉虱40头左右。每个处理有3个生物学重复,每生物学重复40头左右烟粉虱。
1.8 数据分析
采用SPSS 19.0对试验数据进行统计学分析,烟粉虱在不同发育龄期、不同组织和吡虫啉抗敏种群之间的表达量差异采用单因素方差分析,差异显著性分析应用Tukey法。通过POLO program PC PoloPlus对生物测定数据进行概率单位分析从而得到LC50值。
2 结果与分析
2.1 吡虫啉抗性和敏感种群烟粉虱的生物测定
对吡虫啉抗性和敏感种群的烟粉虱进行生物测定的结果如表2所示。
2.2 烟粉虱CYP6EM1基因的克隆及其序列分析
以烟粉虱cDNA作为模板,通过基因克隆获得CYP6EM1基因的全长ORF序列,长度为1 539 bp,与基因组序列一致(基因组登录号:BTA005348.1)。通过分析发现CYP6EM1基因可编码512个氨基酸,等电点为6.33,分子量为58.95 kD。该蛋白具有细胞色素P450基因的保守结构域:Heme-binding结构域(P449-A459),Helix-C WXXXR结构域(W189-R193),Oxygen-binding结构域(A317-V322),以及Meander PXXFXP结构域(P426-P431),属于典型的昆虫P450基因。CYP6EM1基因的系统发育树如图1所示,Q型烟粉虱CYP6EM1基因编码的氨基酸序列与烟粉虱P450家族CYP6亚家族基因聚类在一起。
2.3 在吡虫啉抗性烟粉虱不同发育龄期和组织中CYP6EM1基因的表达水平
CYP6EM1基因在烟粉虱不同发育龄期的表达量可以通过荧光定量PCR分析,从图2a可以看出,CYP6EM1基因在卵期表达量最低,在3龄若虫期表达量稍高,在成虫期的雄性成虫中表达量最高,表明该基因在雄性烟粉虱中发挥作用。不同组织中的表达量如图2b所示,该基因在烟粉虱头部表达很少,在胸部和腹部表达较多。
2.4 CYP6EM1基因在吡虫啉抗敏种群的表达量
通过qRT-PCR检测在室内饲养的Q型敏感种群和吡虫啉抗性种群中CYP6EM1基因表达量,发现该基因在吡虫啉抗性种群中过量表达4.7倍(图3a),差异极显著,表明该基因过量表达可能参与烟粉虱对吡虫啉的抗药性。
2.5 RNA干扰试验
由于CYP6EM1基因在烟粉虱吡虫啉抗性种群中过量表达(图3a),而对于该基因参与烟粉虱抗性形成的机制需要进一步的研究。通过饲喂0.5 μg/μL的dsCYP6EM1和dsGFP进行RNA干扰试验,48 h后用荧光定量PCR检测发现与饲喂dsGFP相比,饲喂dsCYP6EM1使得CYP6EM1基因在烟粉虱成虫体内表达量减少了54.8%(图3b)。进一步用100 mg/L的吡虫啉进行RNAi后的生物测定,24 h后发现与饲喂dsGFP相比,饲喂dsCYP6EM1后烟粉虱的死亡率显著增加(图3c)。结果表明RNA干扰降低CYP6EM1基因表达量能显著降低烟粉虱对吡虫啉的抗性。
3 讨论
20世纪90年代以来,烟粉虱开始入侵我国形成危害,特别是2003年发现的Q型烟粉虱入侵我国以后,造成了严重的危害,随之而来的番茄黄化曲叶病也大规模暴发,导致番茄等重要农作物大量减产,甚至绝产[22]。防治烟粉虱主要使用新烟碱类杀虫剂,第一代新烟碱类杀虫剂吡虫啉被广泛用于防治烟粉虱。但是严重的抗药性导致药物的使用量增加,防效显著降低,对于烟粉虱抗药性的研究显得十分重要。
前期研究报道表明细胞色素P450基因在烟粉虱对吡虫啉抗性中发挥重要作用,特别是关键基因CYP6CM1的克隆[15],功能解析[18],以及一系列的田间样品检测[17],发现该基因在烟粉虱对吡虫啉的抗性形成中发挥重要作用。最近关于该基因在烟粉虱体内的调控机制也得到揭示,研究结果表明转录因子CREB和MAPK信号通路参与了该基因的调控过程,也参与了吡蟲啉抗性的形成[23]。而除此之外,关于烟粉虱对于吡虫啉抗性的其他解毒酶机制报道很少,最新研究表明解毒代谢相关基因如谷胱甘肽转移酶基因,ABC家族基因也可能参与了烟粉虱对吡虫啉抗性的形成[24-25]。由细胞色素P450单加氧酶上调表达导致的代谢解毒能力增强是昆虫产生抗药性的重要机制。通过对转基因果蝇的研究发现,CYP6M2和CYP6P3的过表达与冈比亚按蚊Anopheles gambiae对噁虫威的抗性相关,CYP6P3表达的蛋白可以代谢噁虫威[26]。CYP6ER1的表达量上调(上调36.87倍)在褐飞虱Nilaparvata lugens对氟啶虫胺腈的抗性中发挥了重要作用[27]。与敏感品系相比,CYP346B1、CYP346B2和CYP346B3均在赤拟谷盗Tribolium castaneum磷化氢抗性品系中过表达,CYP346B亚家族基因与其对磷化氢抗性相关[28]。CYP6CY3过表达参与了桃蚜Myzus persicae对新烟碱类杀虫剂抗性的形成[29]。在果蝇中,CYP6G1的过表达增加了其对吡虫啉和DDT大约10倍的抗性[30]。在家蝇Musca domestica中,CYP6A1、CYP6D1和CYP6D3的过表达与其对新烟碱抗性相关[31]。
本研究通过对吡虫啉抗性和敏感种群的分析,发现一个新的P450基因CYP6EM1在烟粉虱吡虫啉抗性种群中过量表达,依托Q型烟粉虱基因组序列对该基因的全长进行了克隆分析,发现该基因属于昆虫P450基因家族。进一步分析CYP6EM1基因在烟粉虱不同发育龄期和组织的表达水平,发现该基因可能与烟粉虱雄性成虫的生理功能有关,并且是在胸部和腹部过量表达,表明该基因可能参与了烟粉虱中肠解毒过程。通过RNAi敲除该基因后,发现随着CYP6EM1基因表达量的降低,烟粉虱对吡虫啉的抗性水平也显著降低,表明该基因可能参与烟粉虱对吡虫啉抗药性的形成。下一步将解析该基因对吡虫啉的代谢能力,通过体外表达该基因的蛋白,进行体外代谢确定其代谢能力,从而阐明烟粉虱CYP6EM1基因在吡虫啉抗性中的作用。
關于烟粉虱对新烟碱类杀虫剂的抗性机制研究现在仍然处于大量挖掘抗性基因的阶段,特别是田间抗性形成机制复杂,一系列与烟粉虱抗药性相关的研究方向都需要从分子层面进行解析,所以通过抗药性机制的大量研究,为解决烟粉虱抗药性提供思路,也为高效防治烟粉虱提供理论依据。
参考文献
[1] BROWN J K, FROHLICH D R, ROSELL R C. The sweetpotato or silver leaf whiteflies: biotypes of Bemisia tabaci or a species complex?[J]. Annual Review of Entomology, 1995, 40(1): 511-534.
[2] JONES D R. Plant viruses transmitted by whiteflies [J]. European Journal of Plant Pathology, 2003, 109(3): 195 -219.
[3] DE BARRO P J, LIU Shusheng, BOYKIN L M, et al. Bemisia tabaci: a statement of species status [J]. Annual Review of Entomology, 2011, 56(1): 1-19.
[4] 褚栋, 张友军. 近10年我国烟粉虱发生为害及防治研究进展[J]. 植物保护, 2018, 44(5): 51-55.
[5] CASIDA J E. Neonicotinoids and other insect nicotinic receptor competitive modulators: progress and prospects [J]. Annual Review of Entomology, 2018, 63(1): 125-144.
[6] NAUEN R, DENHOLM I. Resistance of insect pests to neonicotinoid insecticides: current status and future prospects [J]. Archives of Insect Biochemistry and Physiology, 2005, 58(4): 200-215.
[7] ERDOGAN C, MOORES G D, GURKAN M O, et al. Insecticide resistance and biotype status of populations of the tobacco whitefly Bemisia tabaci (Hemiptera: Aleyrodidae) from Turkey [J]. Crop Protection, 2008, 27(3): 600-605.
[8] FENANDZ E, GRAVALOS C, HARO P J, et al. Insecticide resistance status of Bemisia tabaci Q-biotype in south-eastern Spain [J]. Pest Management Science, 2009, 65(8): 885-891.
[9] LUO Chen, JONES C M, DEVINE G, et al. Insecticide resistance in Bemisia tabaci biotype Q (Hemiptera: Aleyrodidae) from China [J]. Crop Protection, 2010, 29(5): 429-434.
[10]WANG Zhenyu, YAN Haifei, YANG Yihua, et al. Biotype and insecticide resistance status of the white fly Bemisia tabaci from China [J]. Pest Management Science, 2010, 66(12): 1360-1366.
[11]WANG Ran, CHE Wunan, WANG Jinda, et al. Monitoring insecticide resistance and diagnostics of resistance mechanisms in Bemisia tabaci Mediterranean (Q biotype) in China [J]. Pesticide Biochemistry and Physiology, 2019, 163: 117-122.
[12]LIU Zewen, WILLIAMSON M S, LANSDELL S J, et al. A nicotinic acetylcholine receptor mutation conferring target-site resistance to imidacloprid in Nilaparvata lugens (brown plant-hopper)[J]. Proceeding of the National Academy of Sciences, 2005, 102(24): 8420-8425.
[13]BASS C, PUINEAN A M, ANDREWS M, et al. Mutation of a nicotinic acetylcholine receptor β subunit is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae [J/OL]. BMC Neuroscience, 2011, 12: 51. DOI: 10.1186/1471-2202-12-51.
[14]ZHUANG Huamei, WANG Kuanfu, ZHENG Lin, et al. Identification and characterization of a cytochrome P450 CYP6CX1 putatively associated with insecticide resistance in Bemisia tabaci [J]. Insect Science, 2010, 18(5): 484-494.
[15]YANG Xin, XIE Wen, WANG Shaoli, et al. Two cytochrome P450 genes are involved in imidacloprid resistance in field populations of the whitefly, Bemisia tabaci, in China [J]. Pesticide Biochemistry and Physiology, 2013, 107(3): 343-350.
[16]KARUNKER I, BENTING J, BETTINA L, et al. Over-expression of cytochrome P450 CYP6CM1 is associated with high resistance to imidacloprid in the B and Q biotypes of Bemisia tabaci (Hemiptera: Aleyrodidae)[J]. Insect Biochemistry & Molecular Biology, 2008, 38(6): 634-644.
[17]KARUNKER E, MOROUB D, NIKOUB R, et al. Structural model and functional characterization of the Bemisia tabaci CYP6CM1vQ, a cytochrome P450 associated with high levels of imidacloprid resistance [J]. Insect Biochemistry & Molecular Biology, 2009, 39(10): 697-706.
[18]XIE Wen, YANG Xin, CHEN Chunhai, et al. The invasive MED/Q Bemisia tabaci Genome: A tale of gene loss and gene gain [J/OL]. BMC Genomics, 2018, 19(1): 68. DOI: 10.1186/s12864-018-4448-9.
[19]FENG Y T, WU Q J, XU B Y, et al. Fitness costs and morphological change of laboratory-selected thiamethoxam resistance in the B-type Bemisia tabaci (Hemiptera: Aleyrodidae)[J]. Journal of Applied Entomology, 2009, 133(6): 466-472.
[20]LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and Clustal X version 2.0 [J]. Bioinformatics, 2007, 23(21): 2947-2948.
[21]楊鑫. Q型烟粉虱对噻虫嗪抗性机制研究 [D]. 长沙:湖南农业大学,2015.
[22]PAN Huipeng, CHU Dong, GE Daqing, et al. Further spread of and domination by Bemisia tabaci (Hemiptera: Aleyrodidae) biotype Q on field crops in China [J]. Journal of Economic Entomology, 2011, 104(3): 978-985.
[23]YANG Xin, DENG Shun, WEI Xuegao, et al. MAPK-directed activation of the whitefly transcription factor CREB leads to P450-mediated imidacloprid resistance [J]. Proceeding of the National Academy of Sciences, 2020, 117(19): 10246-10253.
[24]YANG Xin, HE Chao, XIE Wen, et al. Glutathione S-transferases are involved in thiamethoxam resistance in the field whitefly Bemisia tabaci Q (Hemiptera: Aleyrodidae)[J]. Pesticide Biochemistry and Physiology, 2016, 134: 73-78.
[25]HE Chao, LIANG Jingjing, LIU Shaonan, et al. Changes in the expression of four ABC transporter genes in response to imidacloprid in Bemisia tabaci Q (Hemiptera: Aleyrodidae)[J]. Pesticide Biochemistry and Physiology, 2019, 153: 136-143.
[26]EDI C V, DJOGBENOU L, JENKINS A M, et al. CYP6 P450 enzymes and ACE-1 duplication produce extreme and multiple insecticide resistance in the malaria mosquito Anopheles gambiae [J/OL]. PLoS Genetics, 2014, 10(3): e1004236. DOI: 10.1371/journal.pgen.1004236.
[27]廖逊.褐飞虱对氟啶虫胺腈的抗性及其机理研究 [D]. 武汉:华中农业大学,2019.
[28]刘蔓文.赤拟谷盗CYP346基因家族介导磷化氢抗性的机理研究 [D]. 南京:南京财经大学,2019.
[29]PUINEAN A M, FOSTER S P, OLIPHANT L, et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae[J/OL]. PLoS Genetics, 2010, 6(6): e1000999. DOI: 10.1371/journal.pgen.1000999.
[30]DABORNP J, BOUNDY S, YEN J, et al. DDT resistance in Drosophila correlates with Cyp6g1 over-expression and confers cross-resistance to the neonicotinoid imidacloprid [J]. Molecular Genetics and Genomics, 2001, 266(4): 556-563.
[31]MARKUSSEN M D K, KRISTENSEN M. Cytochrome P450 monooxygenase-mediated neonicotinoid resistance in the house fly Musca domestica L. [J]. Pesticide Biochemistry and Physiology, 2010, 98(1): 50-58.
(責任编辑:田 喆)

