6-BA对铝胁迫杉木幼苗抗氧化酶活性的研究
吕蒙蒙 陈 宇 林思祖
(福建农林大学林学院,国家林业和草原局杉木工程技术研究中心,福建 福州 350002)
杉木(Cunninghamia lanceolata),又名沙木、沙树等,亚热带地区优质速生针叶树种,林业价值高,且分布广阔,杉木的主要栽培区遍及包括台湾省在内的南方17个省区,而我国南方土壤以酸性红壤为主,加之近几十年来工业化发展和人类活动等,导致我国大面积受到酸雨的侵害,进而加剧土壤酸化[1-2]。土壤酸化往往与铝毒相伴而生,酸性条件下土壤中的固定铝不断溶出,活性铝不断增加,对植物的生长造成严重的抑制作用。随着杉木人工林连载代数增加,土壤pH值下降,将进一步加剧土壤的铝毒害[3-6]。
植物体内存在着清除活性氧(ROS)的抗氧化系统,可以减轻逆境胁迫对植物的氧化伤害,对提高植物抗逆性有着重要的作用。丙二醛(MDA)是膜脂过氧化最重要的产物之一,可以间接测定膜系统受损程度以及植物的抗逆性。过氧化氢酶(CAT)、过氧化物酶(POD)和多酚氧化酶(PPO)作为最重要的抗氧化酶,在抗氧化系统起到至关重要的作用[7-8]。6-卡氨基腺嘌呤(6-BA)是第1个人工合成的细胞分裂素,主要作用是诱导芽的分化和诱导愈伤组织发生,促进细胞分裂,具有抑制衰老、保绿作用[9-10]。此外,外源6-BA在缓解植物逆境胁迫,提高植物抗逆性方面也具有重要作用[11-13]。有研究[7]表明,叶面喷施一定浓度的6-BA可以提高Hg2+胁迫下小麦幼苗叶片的POD、超氧化物歧化酶(SOD)活性及抗坏血酸(AsA)和谷胱甘肽(GSH)含量,有效减轻Hg2+胁迫对小麦的伤害;刘清玮[14]等发现,适当浓度的6-BA处理菘蓝种子,可明显提高其在盐碱胁迫环境下的萌发。研究表明,适宜浓度的6-BA有利于高温胁迫下抗氧化酶活性的升高,降低有害物质MDA积累[15]。铝胁迫对杉木生长、生理等方面的影响已有大量研究,但外源6-BA对杉木铝胁迫的研究鲜有报道。本研究以杉木实生苗为材料,探究不同浓度的6-BA对铝胁迫下杉木幼苗不同组织MDA含量及抗氧化酶活性的影响,为进一步提高杉木耐铝机制的研究提供参考依据[16]。
1 材料与方法
1.1 试验材料
以福建尤溪国有林场提供的杉木3代种子园种子为原始材料,经培育后获得的长势较一致的实生苗,试验地点位于福建农林大学林学楼,地 处119°19′E,26°07′N,试 验于2019年9月开始。
1.2 试验处理
杉木种子用去离子水将种子清洗3遍后,置于初始温度为45 ℃的超纯水中浸泡24 h,期间用玻璃棒搅动。然后去掉浮于水面的瘪粒和涩粒,用0.3% KMnO4消毒0.5 h,再用去离子水清洗干净,静置待用。将浸泡好的种子放在滤纸板上,置于光照14 h(25 ℃)、黑暗10 h(22 ℃),光强110 μmol/(m2·s),相对湿度75%的气候箱中。萌发15 d后,挑选长势良好的幼苗移栽至盛有Hoagland-Arnon营养液(pH为5.5)的培养框中,置于温室进行水培。控制温度25 ℃,光照时间12 h/d,光照强度为12 000 lx。每7 d更换1次营养液,培养1个月后选取长势一致的幼苗进行处理[17]。参考黄鹏[18]及马志慧[19]的研究成果,以1 mmol/L Al3+(铝源为AlCl3·6H2O),pH 4.5的Hoagland-Arnon营养液作为CK,6-BA浓度设为0、10、30、50 mg/L,胁迫开始后pH均为4.5,在胁迫结束后分别采集根、茎、叶测定各指标。
1.3 测定指标
MDA含量采用硫代巴比妥酸比色法测定,POD活性采用愈创木酚法测定,CAT活性采用紫外吸收法测定,PPO活性采用邻苯二酚法测定[20-21]。
1.4 数据整理分析
原始数据采用SPSS 17.0进行单因素方差分析,采用WPS 2019软件作图。
2 结果与分析
2.1 铝胁迫下6-BA对杉木幼苗MDA含量的影响
由图1可知,与CK相比,杉木幼苗根部的MDA含量随着浓度的增加呈逐渐降低的趋势,各浓度处理均低于CK,当浓度为50 mg/L时MDA含量达到最低值,相比CK降低了60.7%;杉木茎部的MDA含量随着浓度的增加先降低后升高,且30 mg/L时达到最低值,与CK相比降低了30.2%;杉木叶片的MDA含量随着浓度的增加变化趋势与茎相一致,且30 mg/L时达到最低值,与CK相比降低了33.8%。总的来说,在同一处理水平下的MDA含量,叶片中含量最高,茎次之,根部含量最低。

图1 铝胁迫下6-BA对杉木幼苗MDA含量的影响Fig. 1 Effects of 6-BA on MDA content in C. lanceolata seedlings under aluminum stress
由表1可知,就同一组织不同浓度而言,杉木根中的MDA含量在CK和50 mg/L时存在显著差异(P<0.05),其他处理水平差异不显著;茎部在CK和10 mg/L、CK和30 mg/L、CK和50 mg/L间存在显著差异(P<0.05),其他处理水平上差异不显著;叶片在CK和10 mg/L、CK和30 mg/L、CK和50 mg/L、10 mg/L和30 mg/L、10 mg/L和50 mg/L、30 mg/L和50 mg/L 间存在显著差异(P<0.05),其他处理水平差异不显著。就同一浓度不同组织而言,杉木幼苗根茎叶的MDA含量均存在显著差异(P<0.05)。
2.2 铝胁迫下6-BA对杉木幼苗CAT活性的影响
由图2可知,杉木根部的CAT活性随着浓度的增加呈现逐渐降低的趋势,当浓度为10 mg/L时活性最高,与CK相比提高了33.2%;杉木茎部的CAT活性随着浓度的增加先升高后降低,当浓度为30 mg/L时活性最高,相比CK提高了36.2%;杉木叶片的CAT活性对的变化趋势与根部相同,当浓度为10 mg/L时活性最高,相比CK提高了36.6%。总的来说,在同一处理水平上,根部CAT活性最高,茎次之,叶片活性最低。

图2 铝胁迫下6-BA对杉木幼苗CAT活性的影响Fig. 2 Effects of 6-BA on CAT activity in C. lanceolata seedlings under aluminum stress
由表2可知,就同一组织不同浓度水平而言,杉木幼苗根、茎、叶的CAT活性在各浓度处理水平上的差异均不显著。就同一浓度不同组织而言,当6-BA浓度为10 mg/L时,根和茎之间的CAT活性存在显著差异(P<0.05),其他各部位之间差异不显著。
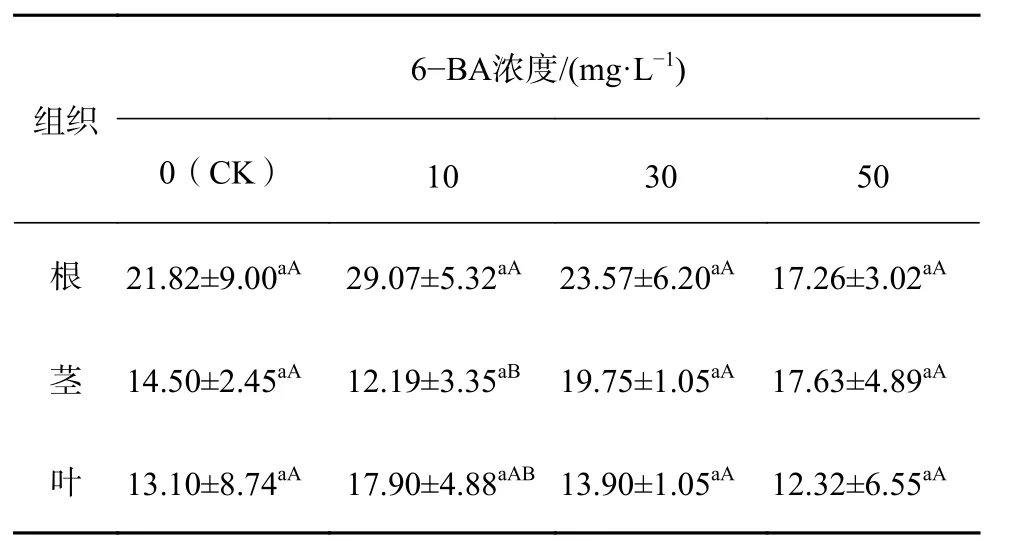
表2 铝胁迫下6-BA对杉木幼苗CAT活性的多重比较Table 2 Multiple comparison of CAT activity of 6-BA in C. lanceolata seedlings under aluminum stress
2.3 铝胁迫下6-BA对杉木幼苗PPO活性的影响
由图3可知,杉木根部的PPO活性随着浓度的增加呈现先降低后升高的趋势,各浓度处理下的PPO活性均低于CK,且当浓度为30 mg/L时达最低值,相比CK降低了31.8%;杉木茎部的PPO活性随着浓度的增加先升高后降低,且当浓度为30 mg/L时活性最高,相比CK提高了125.3%;杉木叶片的PPO活性随着浓度的增加逐渐升高,且50 mg/L时达到最高值,相比CK提高了76.3%。总的来说,同一处理水平上,茎部的PPO活性最高,根次之,叶片活性最低。
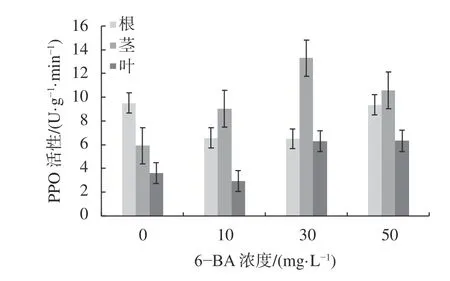
图3 铝胁迫下6-BA对杉木幼苗PPO活性的影响Fig. 3 Effects of 6-BA on PPO activity in C. lanceolata seedlings under aluminum stress
由表3可知,就同一组织不同浓度而言,杉木幼苗根部的PPO活性在CK和50 mg/L间存在显著差异(P<0.05),其他处理水平上差异不显著;茎部的PPO活性在CK和30 mg/L间存在显著差异(P<0.05),其他处理水平上差异不显著;叶片中的PPO活性均差异不显著。就同一浓度不同组织而言,当6-BA浓度为0 mg/L时,根和叶之间PPO活性存在显著差异(P<0.05);当浓度为30 mg/L时,根和茎、茎和叶之间存在显著差异,其他各组织之间差异不显著。

表3 铝胁迫下6-BA对杉木幼苗PPO活性的多重比较Table 3 Multiple comparison of PPO activity of 6-BA in C. lanceolata seedlings under aluminum stress
2.4 铝胁迫下6-BA对杉木幼苗POD活性的影响
由图4可知,杉木根部的POD活性随着浓度的增加呈现先降低再升高的趋势,且浓度为10 mg/L时达最高值,相比CK提高了34.7%;杉木茎部的POD活性的变化趋势与根部相一致,且10 mg/L时达最高值,相比CK提高了37.2%;杉木叶片的POD活性的变化趋势与根、茎相一致,且10 mg/L时达最高值,相比CK提高了26.1%。总的来说,同一处理水平上,叶片的POD活性最高,茎部次之,根系活性最低。
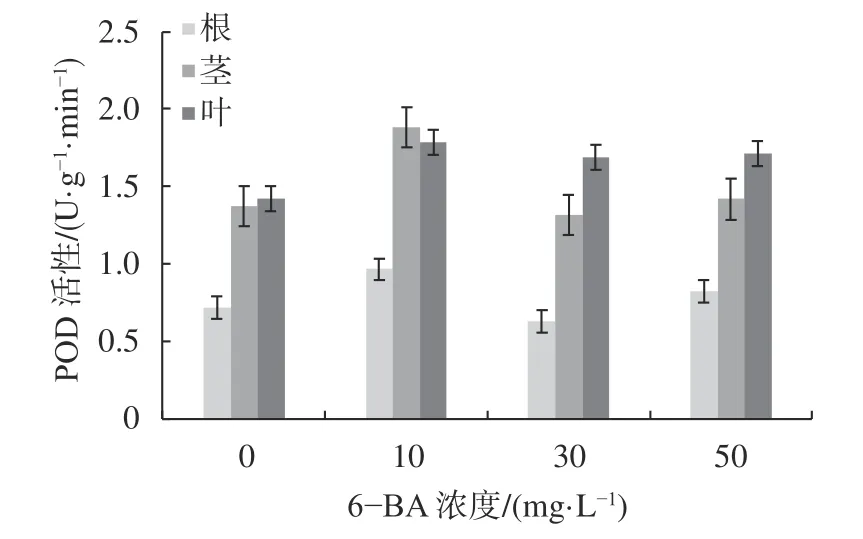
图4 铝胁迫下6-BA对杉木幼苗POD活性的影响Fig. 4 Effects of 6-BA on POD activity in C. lanceolata seedlings under aluminum stress
由表4可知,就同一组织不同浓度而言,杉木幼苗根、茎、叶的POD活性在各浓度处理水平上的差异均不显著。就同一浓度不同组织而言,当6-BA浓度为30 mg/L时,根和茎、根和叶之间POD活性存在显著差异(P<0.05);当浓度为50 mg/L时,根和叶之间存在显著差异(P<0.05);其他各组织之间差异不显著。
3 结论与讨论
MDA是膜脂过氧化最重要的产物之一,它的产生能加剧膜的损伤,因此可通过MDA了解膜脂过氧化的程度,可以间接测定膜系统受损程度以及植物的抗逆性,一般受到逆境胁迫时,植物体内MDA含量会增加[22-24]。有研究表明,铝胁迫使白苦瓜幼苗的膜脂过氧化程度逐渐增强,MDA含量显著升高,从而对植物的生长产生抑制作用[25]。本研究发现,铝胁迫下添加一定浓度的6-BA,可以减少杉木幼苗根茎叶中MDA含量的积累,减轻膜脂过氧化程度,从而缓解铝毒对杉木的伤害。
抗氧化系统是植物体内主要的防御系统,POD和CAT是植物抗氧化酶系统中的关键酶,可以消除ROS,减轻脂质过氧化物作用,因此其活性的高低正影响着植株本身的抗逆性的强弱[26-29]。PPO在植物组织受伤时活性会明显增强,且PPO活性和增长速率越高其抗性越强,对于杉木不同家系来说,PPO活性的强弱代表着其抗性的强弱[21,30]。徐莉莉等[31]的研究发现,喷施6-BA降低了叶片MDA含量,促进了叶片POD和CAT活性的升高,说明6-BA对镉胁迫玉米幼苗的伤害有一定缓解作用。吴雪霞等[32]也发现,外源6-BA可通过提高茄子幼苗的抗氧化酶活性(POD、CAT和SOD),来缓解Cd胁迫对茄子的毒害作用。这与本研究结果基本一致,添加外源6-BA可以有效提高杉木幼苗根、茎、叶中的CAT、PPO以及POD活性,表明一定浓度6-BA可以通过提高杉木幼苗抗氧化酶活性,进而增强其清除ROS的能力,缓解铝对杉木幼苗生长的抑制作用。
综上所述,与CK相比,随着6-BA浓度的增加,杉木幼苗根、茎、叶中的MDA含量及抗氧化酶活性呈现出不同的变化规律;具体而言,在6-BA处理下,叶片中的MDA含量和POD活性最高,其次是茎和根;CAT活性在根中最强,其次是茎和叶;PPO活性在叶片中最弱,其次是根和茎。总的来说,6-BA降低了不同组织中MDA的含量,提高了CAT,PPO和POD的活性,表明6-BA可以在一定程度上减轻铝对杉木的毒害,本研究可为丰富杉木耐铝机制的研究提供一定的理论基础。目前,关于6-BA对于杉木铝胁迫的研究,在设计和方法还可能存在一些不足,有关外源6-BA对杉木铝胁迫抗氧化酶活性影响的内在机理还有待研究,以期在之后的研究中进一步完善。

