miR-143介导ADAM17基因对子宫内膜癌细胞生物活性的作用机制
王秋宇 姜 平 朱军义 许 静 李和丽 郭 哲
(南阳市中心医院妇科,南阳 473000)
子宫内膜癌是发生在子宫内膜上的疾病,发病人群趋于年轻化[1]。目前,对子宫内膜癌发生的危险因素及其生物学行为尚不明确。随着子宫内膜癌的发展,癌细胞浸润程度的增加,生存率不断降低,阐明其发病机制对子宫内膜癌防治具有重要作用[2]。微小RNA(microRNA,miRNA)是由18~24个核苷酸组成的非编码RNA,对多种基因具有调节作用,能够进行DNA调节,诱发mRNA降解,调节细胞生物活性。以往研究文献表明,miRNA与肿瘤的发生发展具有相关性。miR-143属于其中之一,已经证实其在宫颈癌及肾癌中具有抑制癌细胞活性的作用[3]。解整合素金属蛋白酶17 (disintegrin and metalloproteinase domaincontaining protein 17,ADAM17)生物活性广泛,具有解聚素和金属蛋白酶的作用。众多学者认为在多种恶性肿瘤中ADAM17阳性率显著高于癌旁组织[4]。目前,关于miR-143对子宫内膜癌及ADAM17作用的研究较少。本研究通过体外培养子宫内膜癌细胞并转染miR-143,观察其生物活性和对ADAM17水平的影响。
1 材料和方法
1.1 细胞来源和主要试剂
人子宫内膜癌HEC-1B细胞购自中国医学科学院细胞中心。miR-143 mimics,miR-143-NC(上海生工);兔抗人ADAM17多克隆抗体(北京来福赛思科技生物);MTT、DMSO(上海研谨生物科技)。
1.2 HEC1B细胞培养及分组
将低温冷藏的HEC1B细胞株,快速移入37℃水中溶解,离心后,离弃上清液,加入培养基,每隔1 d更换培养液,生长到85%~90%时,消化传代,取对数生长细胞分为内膜癌组、NC组、miR-143 mimics干预组,内膜癌组为HEC1B细胞株,NC组为HEC1B细胞株转染miR-143-NC,干预组为HEC1B细胞株转染miR-143 mimics。
1.3 细胞转染
将数量为1×104个的HEC1B细胞株接种到96孔中,15 h后,待HEC1B细胞重复融合,在EP管中放入200 μL转染液体和4 μL脂质体,后加入5 μg的miR-143 mimics、miR-143-NC,充分混合后,转染9 h后,用含血清、双抗的培养液继续培养。
1.4 RT-PCR检测细胞miR-143表达水平
取105/mL HEC1B细胞悬液,采用0.25%胰蛋白酶消化,采用TRIzol法提取总RNA,无核酸酶溶解。将提取的RNA进行转录为cDNA,获得反体系,条件为:42℃作用60 min,72℃作用5 min,4℃终点。每个细胞设置6个复孔,以GAPDH为内参,反应条件为95℃预作用3 min,95℃作用5 s,58℃退火,40个循环,miR-143内参上游序列为5'- TGAGATGAACCACTGTAGGTC-3',下游序列为5'-GCGAGCACAGAATTAATACGAC-3';内参GAPDH上游序列为5'-CCATGCAGAAGG CTGGGG-3',下游序列为5'-CAAAGTTGTCATGG ATGACC-3',用相对定量2-ΔΔCT计算miR-143表达。
1.5 MTT法检测细胞株活性抑制率
取0.6×104个/mL HEC1B细胞接种在96孔板中,消化后,加入1%的血清继续培养,将3组细胞置于5%CO2的饱和湿度箱中培养,培养0、24、48、72 h及96 h后加入MTT(5 g/L),每孔20 μL。4 h后离弃上清液,加入200 μL的DMSO,在490 nm检测吸光度(OD值),取3次平均值。
1.6 流式细胞仪检测各组HEC1B细胞凋亡
取2×105个/mL HEC1B细胞悬液,PBS溶液予以洗涤,离心5 min,运用100 μL 结合缓冲液,对细胞进行重悬,用 5 μL 标记FITC的AnnexinⅤ与5 μL PI 染色混匀,无光条件下,孵育15 min后注入400 μL 结合缓冲液混匀,予以洗涤,次数3次,记录细胞凋亡情况。
1.7 Transwell小室检测细胞侵袭能力
取1.5×104个/mL HEC1B细胞悬液,将50 mg/L的基质胶稀释后加入小室上层,37℃下呈凝胶状态,细胞数目为1×105/mL,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,37.5℃,培养48 h,取出培养基,拭去残留细胞,0.1%结晶紫染色,计算HEC1B细胞侵袭细胞数。
1.8 划痕实验检测细胞迁移能力
1 mL细胞悬液接种于6孔板,加无血清DMEM培养6 h,单层生长。用10 μL Eppendorf Tip在细胞板上划痕,无血清培养液洗3次,加新鲜的无血清培养基。用Image-Pro Plus 6.0软件测量划痕距离。
1.9 免疫印迹检测细胞兔抗人ADAMl7蛋白水平
1 mL的HEC1B细胞悬液,加入胰蛋白裂解液,4 000 r/min离心后,将上清液放入EP管中。在血清样品中加入样孔。进行电泳,PVDF膜TBS浸泡10 min,反复PBS冲洗,每次5 min,分别加入兔抗人ADAM17,GAPDH抗体(1∶500)、过氧化物酶标记二抗(1∶2 000),PBS冲洗。后将膜浸入ECL工作液,随后进行检测,获取图像。
1.10 统计学处理
采用SPSS 23.0软件对数据进行分析,HEC1B细胞OD值、凋亡侵袭、迁移及ADAM17蛋白水平以±s表示,组间比较用t检验,多组间比较采用方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组细胞中miR-143相对表达量
内膜癌组、NC组及干预组HEC1B细胞的miR-143相对表达量分别为1.00±0.00,1.02±0.03及1.63±0.12;干预组HEC1B细胞的miR-143相对表达显著高于内膜癌组、NC组(均P<0.05),说明转染成功。
2.2 过表达miR-143对各组细胞活性的影响
内膜癌组及NC组HEC1B细胞活性OD值的差异无统计学意义;处理48、72、96 h时,干预组分别与内膜癌组及NC组相比,HEC1B细胞活性OD降低,差异具有统计学意义(均P<0.05),显示过表达miR-143能够抑制HEC1B细胞活性(表1)。
表1 各组HEC1B细胞活性OD值比较(±s)

表1 各组HEC1B细胞活性OD值比较(±s)
*P<0.05 vs内膜癌组;#P<0.05 vs NC组
组别 0 h 24 h 48 h 72 h 96 h内膜癌组 0.250±0.060 0.351±0.070 0.600±0.060 1.030±0.100 1.790±0.150 NC组 0.247±0.080 0.347±0.090 0.559±0.070 0.998±0.090 1.700±0.130干预组 0.252±0.076 0.348±0.082 0.404±0.070*# 0.607±0.100*# 1.020±0.110*#P值 0.998 0.997 <0.001 <0.001 <0.001
2.3 过表达miR-143对各组细胞凋亡率的影响
内膜癌组及NC组HEC1B细胞凋亡率分别为4.55%±0.38%及5.00%±0.51%,差异无统计学意义;干预组HEC1B细胞凋亡率为29.89%±1.60%,较内膜癌组及NC组显著增加,(P<0.05)(图1)。

图1 各组HEC1B凋亡率比较。
2.4 过表达miR-143对各组细胞侵袭数目的影响
内膜癌组及NC组HEC1B细胞侵袭数目分别为(230.45±17.20) 个及(227.90±20.15) 个,差异无统计学意义(P>0.05);干预组HEC1B细胞侵袭数目为(75.95±10.55) 个,与内膜癌组及NC组相比侵袭数目降低,差异均有统计学意义(P<0.05)(图2)。
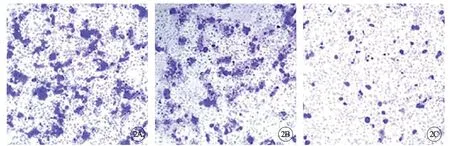
图2 各组HEC1B细胞侵袭数目比较。
2.5 过表达miR-143对各组细胞迁移距离的影响
内膜癌组及NC组HEC1B细胞迁移距离分别为 (265±75) μm和 (260±80) μm,组间比较差异无统计学意义(P>0.05);干预组HEC1B细胞迁移距离为(152±43)μm,与内膜癌组及NC组相比迁移距离减小,组间比较差异均有统计学意义(P<0.05)(图3)。

图3 各组HEC1B细胞迁移数目比较。
2.6 过表达miR-143对各组细胞ADAMl7蛋白水平的影响
内膜癌组及NC组HEC1B细胞ADAMl7蛋白相对水平分别1.00±0.00及0.95±0.03,比较无差异(P>0.05);干预组ADAMl7蛋白相对水平0.45±0.06,与内膜癌组及NC组相比HEC1B细胞中ADAMl7蛋白表达降低,组间比较差异均有统计学意义(P<0.05)(图4)。
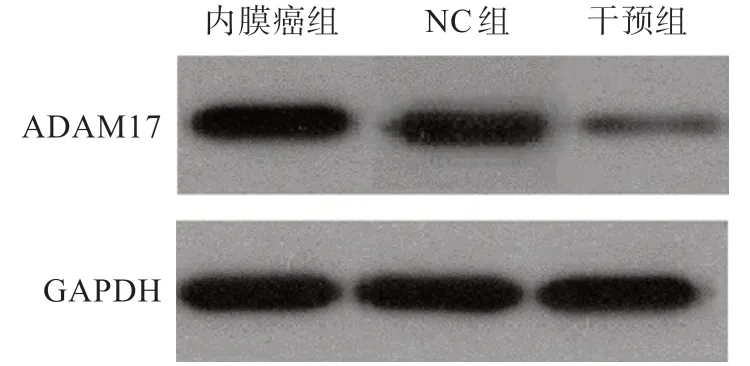
图4 各组HEC1B细胞ADAM17蛋白相对表达
3 讨论
子宫内膜癌是女性恶性肿瘤中的常见疾病,根据最新数据显示,每年有20万新增患者,是导致女性患者死亡的主要原因。目前,早期患者治疗预后较好,但中晚期患者生存率较低,了解其生物活性机制及寻找有效治疗方案用于改善生存率及预后具有重要作用[5-6]。近些年,随着分子领域研究的不断深入,miRNA从最初的表达谱的差异分析到现在对生物功能的研究均发挥了显著作用。miRNA在全基因组中呈现低表达,但是研究表示在恶性肿瘤中具有非随机性,具有改变疾病状态下的RNA形式,介导其水平升高或降低,改善调控系统紊乱现象[7]。miR-143已经被证实能够抑制结肠癌、胃癌及胰腺癌中细胞生物活性,但是在子宫内膜癌女中研究还相对有限,因此,本研究建立上述实验研究,分析其研究机制。
子宫内膜癌是在多环境、多致癌因素的作用诱导机体免疫功能障碍时,细胞生长失调,导致异常增生,加快癌细胞产生。HEC1B细胞侵袭能力较强,能够通过减少细胞凋亡,诱导DNA快速复制,加大癌细胞有丝分裂,加快新病灶形成及向旁癌组织扩散[8]。研究表示,子宫内膜癌疾病发展具有时间依赖性,能够通过不同增生方式产生浸润性癌,加快术后患者残留癌细胞的转移及侵袭,恶化病情[9]。癌属于一种基因病变,子宫内膜癌产生机制与癌基因、抑癌基因及DNA修复损伤相关。miRNA与多种肿瘤形成及发展具有相关性。研究表示,有超过50%的miRNA在癌症相关基因组附近。miRNA具有双重作用,既可以是抑癌基因,也可以是致癌基因[10]。miR-143起初在直肠癌细胞中被发现,经过多项研究证实,多种恶性肿瘤均存在miR-143异常表达,在卵巢癌及乳腺癌中表达降低,主要通过其靶基因来发挥功能。miR-143在胚胎组织水平显著升高,具有保护子宫组织的作用。当在子宫内膜癌中表达降低时,往往意味着抑癌基因作用失效。王颖等[11]研究显示,随着子宫内膜癌病情的发展,伴随淋巴转移及肿瘤分级越高,miR-143表达水平越低。Chang等[12]研究表明,过表达miR-143能够降低乳腺癌及宫颈癌细胞活性,加快凋亡。本研究结果显示,过表达miR-143能够降低HEC1B细胞活性,减少侵袭及迁移数目,加快凋亡,说明miR-143能够降低HEC1B细胞生物活性,这与Zhang等[13]的研究结果相似。
ADAM17属于为肿瘤坏死因子转换酶,能够水解多种TGF-α、HB-EGF等因子,ADAM17在乳腺癌、前列腺癌等疾病中显著高于癌旁组织,已经证明,ADAM17能够参与癌细胞发生及发展[14-15]。ADAM17生物活性较广泛,能够释放多种结构差异的活性物质,进而调节细胞生物活性。柳新等[16]研究显示,子宫内膜增生患者ADAM17的阳性低于子宫内膜癌患者,表示ADAM17升高,说明子宫内膜癌患者疾病加重,并能够作为判断疾病轻重的有效指标。欧奇志等[17]研究表明,ADAM17能够加快肿瘤细胞生长及侵袭是通过增加EGFR配体功能而发挥作用的。目前,关于子宫内膜癌中miRNA所调控的相关信号及靶基因对于了解子宫内膜癌生物活性具有重要意义[18]。研究显示,在鼻咽癌细胞中miR-140-5p能调控ADAM10蛋白水平,减少鼻咽癌细胞迁移及侵袭[19]。本研究结果显示,通过过表达miR-143能够抑制ADAM17蛋白水平减少HEC1B增殖,加快凋亡。说明升高miR-143水平,抑制HEC1B生物活性可能与抑制ADAM17水平相关,可能通过减少Notch 1信号逆转ADAM17活性相关,但是具体机制还需要进一步探讨[20]。
综上所述,过表达miR-143模拟物能够抑制子宫内膜癌细胞生物活性,抑制癌症发展可能与抑制ADAM17基因表达相关。