胡萝卜软腐果胶杆菌lux发光菌株的构建和应用
钟灵坤,徐翠虹,黄泽铭,安千里,梁岩
(浙江大学农业与生物技术学院生物技术研究所/农业农村部作物病虫分子生物学重点实验室,杭州 310058)
细菌性软腐病是世界范围内重要的细菌性病害,其病原物主要是果胶杆菌属(Pectobacterium)和狄克氏菌属(Dickeya)的细菌,其中胡萝卜软腐果胶杆菌(P. carotovorum)的寄主十分广泛,包括重要经济作物和一些观赏性花卉等,还可造成蔬果腐烂,导致严重的产后损失[1-2]。在田间及仓储环境中,高湿度有利于细菌性软腐病的发生。胡萝卜软腐果胶杆菌在20~35 ℃之间具有较高的致病力,在50 ℃以上无法存活[3-4]。胡萝卜软腐果胶杆菌一般通过伤口和自然孔口侵入寄主,侵染初期能明显观察到水渍状病斑,然后病部迅速扩展,最终导致侵染部位腐烂,整株植物萎蔫[5]。胡萝卜软腐果胶杆菌是一种死体营养型细菌,相对于活体和半活体营养型细菌的研究,其致病机制以及植物的抗性机制都不是很清楚,还有待进一步研究。
植物病原细菌的检测方法包括平板菌落计数法、生理生化法、血清学和核酸定量法。目前针对胡萝卜软腐果胶杆菌,常用的方法是平板菌落计数法和核酸定量法,但这2 种方法都需要首先获取植物发病部位,然后破碎植物组织,稀释涂板统计菌落数或提取核酸再扩增。而胡萝卜软腐果胶杆菌接种后,通过分泌果胶裂解酶、聚半乳糖醛酸酶和纤维素酶等多种细胞壁降解酶造成叶片快速坏死腐烂,出现症状时往往发病已经很重,甚至很多叶片掉落在土壤中,导致取材困难,难以精确定量[6]。
近年来,发光成像技术已逐渐应用到植物病原细菌的检测中。生物活体发光成像主要采用2种发光系统,即荧光(fluorescence)发光系统和生物发光(bioluminescence)系统。荧光发光是基于荧光蛋白的系统,比如,绿色荧光蛋白(green fluorescence protein,GFP),通过激发光激发荧光基团到达高能量状态,从而产生发射光[7]。生物发光主要是基于荧光素酶的系统,比如,常用的萤火虫荧光素酶(firefly luciferase, FLuc)和海肾荧光素酶(renilla luciferase,Rluc)标记哺乳动物和植物细胞后,当外源添加荧光素底物时,荧光素酶与底物反应,产生发光现象[8]。而lux系统包含了编码荧光素酶及其底物合成酶的基因,因此,无需外源添加底物,可自主发光[9]。其中luxCDABE基因操纵子已被应用于生物活体发光成像和生物传感器等研究领域[10-11]。
luxCDABE基因操纵子通常来自发光杆菌属(Photobacterium)、弧菌属(Vibrio)以及异短杆菌属(Xenorhabdus)的细菌[12],其中luxA与luxB编码了异质二聚体荧光素酶,luxC、luxD和luxE负责合成脂肪醛,作为荧光素酶发光反应的底物[13-14]。荧光素酶催化脂肪醛氧化,产生波长为450~490 nm 的可见蓝绿光。luxCDABE基因标记的细菌会持续发光,不需要外源添加底物,荧光素酶也不影响细菌的正常功能。另外,luxCDABE产生的光信号寿命较长,灵敏度高,特异性强,其标记的病原菌接种植物后,无需破坏植物组织即可直接观察,并精确定量[15],因此,luxCDABE标记病原菌对研究植物与病原菌互作机制提供了便利条件。
为了实现对胡萝卜软腐果胶杆菌的实时追踪和定量分析,本研究构建了表达luxCDABE的胡萝卜软腐果胶杆菌发光菌株。研究表明,该发光菌株在不影响细菌自身特性的前提下能够稳定表达luxCDABE元件,光信号强度与细菌的浓度呈线性相关,因此,通过光信号量化,可进行统计分析,为细菌性软腐病的防治以及农药药效评价等相关研究提供新的研究工具。
1 材料与方法
1.1 供试菌株及植物材料
从中国林业微生物菌种保藏管理中心(China Forestry Culture Collection Center, CFCC)获得胡萝卜软腐果胶杆菌(Pectobacterium carotovorumsubsp.carotovorum)LMG2404(CFCC 10814);发光丁香假单胞菌番茄致病变种(Pseudomonas syringaepv.tomato[Pst])DC3000-LUX 受赠于美国密苏里大学Gary Stacey 教授;大肠埃希菌(Escherichia coli)DH5α和农杆菌(Agrobacterium tumefaciens)GV3101为实验室常用菌株。以上细菌均用LB(Lutia broth)培养基进行培养。植物材料包括拟南芥(Arabidopsis thaliana)Columbia(Col-0)以及购买于农贸市场的白菜(Brassica rapa)、胡萝卜(Daucus carota)、马铃薯(Solanum tuberosum)。
1.2 质粒及引物信息
质粒pBBR1MCS2 受赠于浙江大学连佳长教授。本研究中所用引物信息见表1。

表1 引物序列信息Table 1 Information of primer sequences
1.3 主要试剂和仪器
质粒小提试剂盒、凝胶回收试剂盒和细菌DNA提取试剂盒购于天根生化科技(北京)有限公司;T4 DNA连接酶、BamHⅠ和EcoRⅠ购于宝日医生物技术(北京)有限公司;2 mmol/L dNTPs、25 mmol/L MgSO4和高效高保真聚合酶链反应(polymerase chain reaction, PCR)酶(KOD-Plus-Neo)购于东洋纺(上海)生物科技有限公司;GreenTaq混合物购于诺唯赞生物科技(南京)股份有限公司。
离心机购自英国Eppendorf 公司;电穿孔仪和PCR 仪购自美国Bio-Rad 公司;HRPCS5 光学成像仪购自英国Photek公司;体式荧光显微镜购自日本Nikon公司。
1.4 实验方法
1.4.1 重组质粒pBBR1MCS2-luxCDABE的构建
通过NCBI网站(https://www.ncbi.nlm.nih.gov/)获取luxCDABE序列(GenBank 登录号为JF420888.1),以PstDC3000-LUX菌株的DNA为模板扩增获得带BamH Ⅰ和EcoR Ⅰ酶切位点的luxCDABE基因片段,将片段与质粒进行双酶切后,使用T4 DNA 连接酶将luxCDABE片段插入到pBBR1MCS2载体中,插入片段经测序验证无突变,该重组质粒命名为pBBR1MCS2-luxCDABE。
1.4.2 LMG2404 感受态的制备及电击转化
将保存在-80 ℃的LMG2404 菌种于LB 固体培养基上活化,在28 ℃条件下培养24 h 后,挑取单菌落接种于液体培养基中,在28 ℃、200 r/min 条件下振荡培养16 h 后,离心收集菌液,清洗后用300 mmol/L 蔗糖溶液重悬,制备成LMG2404 电击感受态。pBBR1MCS2-luxCDABE质粒通过电击转化入LMG2404 感受态,电击条件设为电压2.2 kV、电容25µF、电阻400 Ω,电击后加入液体培养基复苏1 h,然后涂布于含有卡那霉素抗性的固体培养基上,在28 ℃条件下培养过夜,获得含pBBR1MCS2-luxCDABE质粒的LMG2404 转化子,命名为LMG2404-LUX。
1.4.3 LMG2404-LUX菌株的分子检测及信号采集
通过PCR 验证LMG2404-LUX 菌株是否构建成功。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸5 min,30 个循环。PCR 产物通过琼脂糖凝胶电泳检测,阳性菌落用50%丙三醇在-80 ℃条件下保存。LMG2404-LUX光信号通过HRPCS5光学成像仪采集。
1.4.4 LMG2404-LUX 菌株的特性分析
1.4.4.1 生长曲线测定
取1 mL 菌液在5 000 r/min 条件下离心5 min,去上清液后用1 mL无菌水重悬,反复清洗3次后调整为在600 nm波长下的光密度为0.5,按照1%的比例用新鲜液体培养基稀释后继续培养,每半小时测定一次D(600 nm),测定总时长为25 h。
1.4.4.2 生物膜测定
用结晶紫染色法对细菌生物膜进行测定,取100 μLD(600 nm)=0.5 的菌液加入到96 孔细胞培养板中,于30 ℃条件下静置孵育3 d后,小心倒掉菌液,用去离子水清洗,然后加入125 μL 0.1%结晶紫溶液染色1 h,吸出染液后室温晾干,最后用1%的十二烷基硫酸钠(SDS)溶解结晶紫,通过测定D(570 nm)值定量。
1.4.4.3 游动性测定
吸取5 μLD(600 nm)=0.6 的菌液滴在0.3%的半固体LB 培养基平板中心,在28 ℃条件下培养3 d,然后测量菌落直径。
1.4.5 LMG2404-LUX 接种寄主后的致病性检测及光信号观察
1.4.5.1 LMG2404-LUX接种拟南芥
选取在短光照(8 h 光照/16 h 黑暗)下生长4 周的拟南芥Col-0 生态型第5、6、7 片叶,用细针扎一小孔,吸取5 μL 1×108CFU/mL LMG2404-LUX 菌液滴于针孔处,继续在相同光照、22 ℃、90%相对湿度条件下观察发病情况,将无病斑到全叶腐烂分为0~4 个发病等级:0 级表示没有症状;1 级表示接种部位存在水渍状病斑;2 级表示病斑已扩散到叶的一半左右;3 级表示病斑已扩散到整个叶片;4 级表示病叶软烂并且已经蔓延到植物的其他部分[6-7]。接种LMG2404-LUX 的拟南芥植株可以直接通过HRPCS5光学成像仪采集光信号。
1.4.5.2 LMG2404-LUX接种白菜、胡萝卜和马铃薯
将白菜叶片分开,胡萝卜和马铃薯切片,经75%乙醇消毒后自然晾干,将10 μL 1×106CFU/mL LMG2404-LUX 菌液注射入白菜帮、胡萝卜和马铃薯切片的圆心。接种后病斑观察条件和光信号采集方法与拟南芥的相同。
1.4.6 数据处理
采用HRPCS5光学成像仪配置的Image 32软件进行光信号强度统计;采用Image J 软件(https://imagej.nih.gov/ij/)进行伤口面积图像处理;采用Excel 2016、SPSS 20.0进行数据整理及分析,结果表示为平均值±标准差;采用GraphPad Prism 8作图。
2 结果与分析
2.1 质粒pBBR1MCS2-luxCDABE 的构建结果
以菌株PstDC3000-LUX 基因组为模板,扩增带有酶切位点EcoRⅠ和BamHⅠ的luxCDABE片段,大小为5 817 bp。通过酶切及质粒连接,得到pBBR1MCS2-luxCDABE重组质粒(图1),luxCDABE基因簇位于多克隆位点内,可由LacZ 和T3 启动子起始,质粒上携带NeoR/KanR抗性基因、复制起始位点oriⅤ和调节因子Rep序列(图1)。琼脂糖凝胶电泳确认DNA大小(图2)后,重组质粒经测序验证无突变。

图1 重组质粒图谱Fig.1 Recombinant plasmid map

图2 重组质粒的电泳检测Fig.2 Detection of the recombinant plasmid using agarose gel electrophoresis
2.2 LMG2404-LUX 菌株的分子鉴定结果
试验通过快速制备感受态及电击转化,将pBBR1MCS2-luxCDABE重组质粒转入胡萝卜软腐果胶杆菌LMG2404,获得发光菌株,命名为LMG2404-LUX。首先通过PCR扩增16S rRNA,测序验证为胡萝卜软腐果胶杆菌;其次通过PCR检测荧光素基因片段,以luxC基因为模板设计引物进行扩增,重组质粒作为正对照,扩增片段大小为588 bp,凝胶电泳结果显示,以LMG2404-LUX 为模板的扩增片段大小与正对照一致(图3),说明已成功获得LMG2404-LUX菌株。

图3 luxC基因的PCR产物电泳图Fig.3 Detection of the amplified luxC products using agarose gel electrophoresis
2.3 LMG2404-LUX 的菌落形态及光信号检测
本研究使用的检测系统为HRPCS5 光学成像仪,该系统采用高分辨率的照相机采集信号,红色表示光信号中等,白色表示光信号很强。通过光学成像仪检测发现,LMG2404-LUX 的菌落呈现很强的光信号,而相同条件下LMG2404 无光信号(图4A)。LMG2404-LUX 的菌落形态与LMG2404 相比无明显差异,菌落均为白色圆形,表面平滑湿润且边缘光滑(图4B~C)。

图4 LMG2404-LUX发光成像及菌落形态Fig.4 Luminescence imaging and colony morphology of LMG2404-LUX
2.4 LMG2404-LUX 菌株的基础生物学特性
为了检测luxCDABE基因表达是否改变了胡萝卜软腐果胶杆菌的生物学特性,本研究对比了LMG2404-LUX与LMG2404的生长曲线、生物膜和游动性3个指标。生长曲线测定结果显示:2个菌株在5 h 后都能进入对数生长期,15 h 后达到稳定期,因此,luxCDABE基因表达不影响LMG2404 的生长(图5A)。细菌生物膜是细菌分泌胞外多糖等物质黏附于接触表面而形成的细菌群体,是细菌适应环境的重要机制[16]。通过结晶紫方法检测发现,luxCDABE基因表达不影响LMG2404的生物膜形成(图5B)。此外,游动性也是细菌生长和致病的指标之一[17]。将相同量的LMG2404-LUX 与LMG2404菌液滴在半固体培养基平板中央并静置培养3 d,其菌落大小无显著性差异,说明luxCDABE基因表达不影响LMG2404的游动性(图5C)。
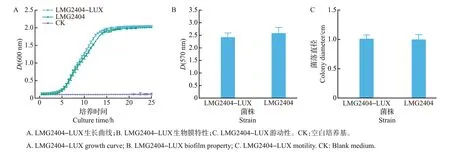
图5 LMG2404-LUX生长曲线、生物膜形成以及游动性检测Fig.5 Detection of growth curve,biofilm formation and motility of LMG2404-LUX
2.5 LMG2404-LUX 菌株的光信号稳定性
为了检测连续继代是否影响LMG2404-LUX的光信号,本研究将LMG2404 和LMG2404-LUX连续继代培养10次。当菌液生长至浓度约为5×108CFU/mL 时,按照1∶100 继代至新鲜液体培养基中继续培养,以此类推,继代培养10次,每一次继代后将菌液稀释至50 CFU/mL涂板,培养24 h后测量光信号。结果(图6A)发现,继代10 次不影响光信号强度。继代后有时光信号略微降低,如第2、8、9、10次继代,这可能是继代后的菌量差异所致。
另外,本研究也检测了固体培养基上LMG2404-LUX 的发光动力学。通过连续14 d 对固体培养基上生长的细菌光信号进行检测,发现在细菌对数生长期和稳定期的光信号强于衰老期,随着细菌的衰老,光信号逐渐减弱,说明lux光信号与细菌活力呈正相关(图6B)。

图6 连续继代培养及LMG2404-LUX衰老对光信号的影响Fig.6 Effects of continuous subculture and the aging of LMG2404-LUX on luminescent signals
胡萝卜软腐果胶杆菌在20~35 ℃条件下正常生长,为了检测此区间的温度对luxCDABE基因表达的影响,本研究将50 μL 5×108CFU/mL(pH=6)的LMG2404-LUX 菌液分别在不同温度条件下静止培养1 h 后检测光信号。结果表明:在正常空气环境中,25~35 ℃不影响luxCDABE基因表达,甚至在0 ℃条件下,LMG2404-LUX 仍然保留了大部分光信号;但在不利于菌生长的高温(≥45 ℃)条件下,光信号消失(图7A)。另外,室温、正常空气环境条件下,在5<pH<8的范围内luxCDABE基因表达也不受影响,在pH≥9 的碱性条件下,光信号消失(图7B)。这些结果说明,在适宜细菌生长的温度和pH范围内,luxCDABE基因表达不受影响,也进一步证明了lux光信号与细菌活力呈正相关的结论。

图7 温度和pH对LMG2404-LUX光信号强度的影响Fig.7 Effects of temperature and pH on luminescent signal intensity of LMG2404-LUX
2.6 LMG2404-LUX 光信号强度与菌液浓度的相关性
为了检测lux光信号强度与菌液浓度的关系,本研究将1×108CFU/mL 的菌液以1∶10 依次稀释5 个浓度梯度,然后同时检测其光信号(图8)。将菌液浓度1×104、1×105、1×106、1×107、1×108CFU/mL 和相应的光信号值取对数后做回归分析,发现光信号强度与菌液浓度呈线性相关(R2=0.995 6),在1×104~1×108CFU/mL菌液浓度范围内,lux光信号强度可以反映菌液浓度。

图8 LMG2404-LUX菌的光信号强度与菌液浓度的相关性Fig.8 Correlation of luminescent signal intensity of LMG2404-LUX with bacterial concentrations
2.7 LMG2404-LUX侵染拟南芥后的光信号检测
为了检测luxCDABE基因表达是否改变LMG2404 的致病性,本研究分别将1×108CFU/mL的LMG2404-LUX 和LMG2404 菌株接种到拟南芥Col-0生态型上,接种后连续3 d通过传统方法统计发病情况,并同时采集光信号。结果表明:拟南芥从第1天到第3天发病逐渐严重,第1天大部分叶片出现水渍状病斑(1级,图9A),第2天叶片出现坏死(2~4 级,图9B),第3 天叶片已全部腐烂(图9C);LMG2404-LUX 菌株侵染后病情指数与LMG2404侵染没有显著差异(图9),说明luxCDABE基因表达不影响LMG2404的致病性。

图9 LMG2404-LUX侵染拟南芥后不同天数的叶片病情指数Fig.9 Disease severity of Arabidopsis leaves at different days after infection with LMG2404-LUX
光信号强度分析表明,接种后第1 天和第2 天适宜采集光信号,当叶片腐烂时,光信号减弱。接种后第1 天,lux光信号强度达到5×105(图10A~B),说明该信号元件不仅可用于快速定量,而且可用于早期病菌侵染检测。因此,本研究对接种LMG2404-LUX 后的拟南芥叶片进行了早期动态监测。将1×108CFU/mL 的LMG2404-LUX 菌液接种到拟南芥叶片后,每6 h 采集光信号。结果(图10C)表明,接种后6~36 h,光信号逐渐增强,说明lux光信号强度与该菌的增殖呈线性相关,而且在侵染初期可以检测到光信号,但相比于菌液本身(0点),接种后6 h,光信号强度反而下降,说明即使应用高浓度菌液接种,侵入植物体内的菌量仍然有限。因此,本研究用相对低浓度的LMG2404-LUX(1×105CFU/mL)接种后进行动态监测。结果发现,接种后12 h 开始出现可检测的光信号,在12~36 h 之间光信号逐渐增强,与使用高浓度菌接种时的增殖速率相当。综上所述,LMG2404-LUX 菌株可用于该菌侵染拟南芥的动态监测以及拟南芥的抗病性定量分析。

图10 LMG2404-LUX侵染拟南芥后的光信号强度检测Fig.10 Detection of luminescent signal intensity in Arabidopsis leaves after infection with LMG2404-LUX
2.8 LMG2404-LUX 侵染白菜、马铃薯和胡萝卜后的光信号检测
胡萝卜软腐果胶杆菌有多种寄主,因此,本研究也检测了LMG2404-LUX对白菜、马铃薯和胡萝卜的致病性。将1×106CFU/mL 的LMG2404-LUX 和LMG2404菌株分别接种到上述植物,48 h后采集光信号。结果表明:在这3种寄主上,LMG2404-LUX与LMG2404 的致病性无显著差异(图11A~D);光信号强度为马铃薯上最强,然后依次为胡萝卜和白菜,说明LMG2404-LUX 在马铃薯上生长最快,其次是在胡萝卜上,在白菜上生长最慢(图11E~G)。

图11 LMG2404-LUX侵染白菜、胡萝卜和马铃薯后的症状及光信号检测Fig.11 Symptoms and luminescent signal detection of B.rapa,D.carota and S.tuberosum infected by LMG2404-LUX
2.9 luxCDABE 基因在大肠埃希菌DH5α 和农杆菌GV3101 菌株上的表达
pBBR1MCS2 质粒是一类广宿主蛋白表达载体,能够在大多数细菌中稳定表达。本研究尝试将该质粒转入到实验室常用的大肠埃希菌和农杆菌中,构建了DH5α-LUX 及GV3101-LUX 菌株,并观察到很强的光信号(图12),揭示该载体可广泛用于其他细菌发光菌株的构建。

图12 luxCDABE在大肠埃希菌和农杆菌中的表达Fig.12 Expressions of luxCDABE in E. coli and A.tumefaciens
3 讨论
原核生物表达luxCDABE基因通常可通过2 个途径,一是直接插入基因组[14],二是通过质粒表达luxCDABE。通常质粒表达比插入基因组的方式表达量更高,因此,质粒转化菌株表达luxCDABE后光信号更强,易于检测[12]。虽然外源质粒在继代过程中存在一定比例的丢失,但本研究中通过10次连续继代培养,LMG2404-LUX 的光信号依然很强,能稳定用于后续研究。另外,除了luxCDABE核心基因,有研究表明,其他lux元件也可以促进发光强度增大。比如,BRODL 等发现,luxF元件可以结合黄素衍生物产生发光反应的副产物,该类物质的存在会加强细菌的发光强度[18]。NIJVIPAKUL 等发现,luxG通过编码黄素还原酶来减少黄素单核苷酸,促进光化学反应正向进行[19]。在费氏弧菌(Vibrio fischeri)中还存在luxR,它能与调控lux基因的启动子结合,激活发光基因的转录[20]。因此,后续可以通过添加其他元件提高luxCDABE的发光强度,从而进一步提高该系统的灵敏度。
目前,植物软腐病发病程度的评价仍使用病情指数或者病斑大小进行描述,易在抗性品种评价中造成人为误差[21]。本研究结果显示,发光胡萝卜软腐果胶杆菌接种后,马铃薯的病斑较小,但光信号强度却比胡萝卜高,所以通过lux的光信号检测方法能更准确地反映真实的细菌量。虽然平板稀释法和核酸定量法可以相对精确定量细菌,但耗时耗力,且因取材部位不同,不能系统、全面地反映整株植物的发病情况。而luxCDABE标记的胡萝卜软腐果胶杆菌,可对其致病程度快速定量,而且可实现实时系统性监测,为抗病品种选育提供了有力工具。
luxCDABE元件标记细菌还在致病机制、药效评价、环境毒性物质检测等研究领域广泛应用。比如:通过luxCDABE标记不动杆菌(Acinetobacter baumannii)可观察该菌侵染小鼠肺部的动态过程[12];通过luxCDABE标记金黄色葡萄球菌(Staphylococcus aureus)快速检测羊毛硫和莫匹罗星等抗生素的药效[22];luxCDABE标记的大肠埃希菌制成磁珠,可用于定量检测土壤污染程度[23]。因此,本文luxCDABE标记的胡萝卜软腐果胶杆菌也可应用于农业相关领域的研究,比如,评估噻霉酮、叶枯唑、四霉素等化学药剂的药效[24]。此外,伴随着荧光检测酶标仪的逐渐普及,能够对不同处理下的细菌进行准确评估,实现高通量检测,也将扩大发光标记细菌的应用范围[25]。
4 结论
本文通过采用luxCDABE标记胡萝卜软腐果胶杆菌LMG2404,构建了LMG2404-LUX 发光菌株。结果发现,luxCDABE基因表达不影响LMG2404 的生长特性和致病性。侵染植物后,LMG2404-LUX的光信号强度与该菌侵染增殖速率呈线性相关。因此,LMG2404-LUX 可以用于该菌的快速定量以及在寄主体内的活体检测,为胡萝卜软腐果胶杆菌的相关研究提供了新的工具。
——一道江苏高考题的奥秘解读和拓展

