一种优化的提高质粒产量的提取方法
王宗宇,张晓瑛,张小玲,杨永广*,代相鹏*
(1. 吉林大学第一医院人类疾病动物模型国家地方联合工程实验室,吉林 长春 130021;2. 吉林大学第一人民医院器官再造与移植教育部重点实验室,吉林 长春 130021)
质粒(plasmid)是广泛存在于生物界的环状双链DNA分子[1]。质粒DNA作为最基本的基因载体工具,在分子生物学、生物化学与细胞生物学等学科中得到广泛的应用[2]。质粒载体含有3个共同的结构:复制子,选择性标志和克隆位点,它们在质粒的表达与复制中发挥重要作用[3]。
人们通过在质粒中插入目的基因,构建重组质粒,使目的基因在动物模型中表达,可以研究动物的生长发育、疾病发生等情况,如P53基因在犬乳腺恶性肿瘤中高表达[4],VIPR-1基因在高产太行鸡中高表达[5]。从分子与细胞层次上探究这些基因的作用机制就需要构建基因的重组质粒,建立转基因动物,以进行下一步的功能研究。现在广泛应用的基因编辑工具CRISPR/Cas9基因编辑技术,是以质粒作为表达载体和基因修复序列的供体,从而实现精准地敲除、插入或替换基因组中特定的DNA序列,在濒危物种保护、动物品种改良和基因功能研究与疾病的治疗中发挥重要的作用[6]。
疫苗是一种预防多种病毒性疾病的有效且通用的方法。从200年前首次成功应用牛痘疫苗抵抗天花到现在,疫苗已大大减少了许多重要疾病对动物的影响。核酸疫苗是一种具有极大发展潜力且安全有效的疫苗。首先通过质粒构建编码疫苗抗原的DNA,并通过多种途径传递给受体,然后DNA被宿主细胞吸收并转录为mRNA,翻译成疫苗蛋白,所表达的蛋白质被宿主免疫系统识别为外源蛋白质,并引发免疫反应从而在动物体内发挥作用。现在常用的核酸疫苗有猫免疫缺陷病毒疫苗、犬细小病毒疫苗、禽流感病毒疫苗等[7]。抗体治疗同样是动物疾病治疗的有效手段,而抗体制备时也需要构建重组质粒作为抗原基因的载体,如制备非洲猪瘟病毒抗体等[8]。
获得足够量的质粒是质粒应用的重要一步。生物学试验中质粒的获取方式主要是通过在大肠杆菌中扩增,从而获取大量的含有目的基因的载体质粒。其主要过程是对感受态细菌进行转化,挑取克隆菌落,LB培养基中摇菌扩增和质粒抽提[9]。目前科研工作者已经开发出很多质粒抽提的方案,包括碱裂解法、加热法、WELCH法、Brij法等。其中萨姆布鲁克提出的碱裂解法操作简单、提取质粒纯度高、质量好,是现今最为常用的质粒DNA提取方法,但该方法存在用时过长等不足[10]。针对这个不足,人们对该方法不断改良,尝试对反应条件进行优化以期缩短试验用时,但仍然存在提取DNA所需时间较长,抽提的质粒浓度不高等问题[11]。
基因工程相关的试验需要高浓度及高纯度的质粒DNA。然而质粒得率和质量会因目前使用的商业化试剂盒的不同而有较大的差异,从而影响了质粒载体的应用。低效率和低产量的质粒提取会对人力、物力造成极大的浪费,因此开发和优化新的质粒提取方法从而提高质粒产量和质量是基因工程等领域中的一个值得重视的技术问题。
本试验通过对商品试剂盒的质粒提取程序进行两步优化,显著提高了质粒提取的产量,并且没有影响质粒的质量。应用本试验方法,可以节省人力与物力,有助于解决某些质粒在细菌中拷贝数低和提取效率低的问题,为质粒载体更好地应用于生命科学研究提供了技术支持。
1 材料与方法
1.1 质粒载体和细胞系
试验所用的质粒有pCDNA3.0-HA-GCN5,pLenti-GFP-DOCK8,pCDNA3.0-HA-BIRC5,pCMV-Flag-SPOP,pCDNA3.0-HA-p300,pCDNA3.0-GFP-BRD2和pLenti-GFP。HEK293细胞系用DMEM+10%胎牛血清(FBS)在37 ℃,5%的CO2培养箱中培养。猪成纤维(porcine fibroblast, PFF)细胞系用α MEM +15% FBS在38.5 ℃,5%的CO2培养箱中培养。
1.2 主要试剂
试验中用到的主要试剂包括质粒提取试剂盒(QIAGEN,12362),抗HA-Tag抗体(BioLegend,MMS-101P),抗Vinculin抗体(Sigma,V4505),抗GFP抗体(Clontech,8371-2),抗BRD2抗体(Proteintech,22236-1-AP),高葡萄糖 DMEM培养基(Gibco,C11995500BT),αMEM培养基(Gibco,12571063),胎牛血清(Gemini,900-108),琼脂糖(Thermo,75510019),DNA 上样缓冲液(TaKaRa,9157),LB Agar(Invitrogen,22700025),Protease inhibitor cocktail (Roche, 04693159001),Phosphatase inhibitor(Bimake,B15001),细胞裂解液EBC buffer(50 mmol/L Tris pH=7.5, 120 mmol/L NaCl, 0.5% NP-40),SDS-PAGE蛋白上样缓冲液(SDS 33.3 g,Glycerol 167 mL,DTT 25 g,ddH2O 500 mL),ECL 发光液(Millipore,WBKLS0500),TransStbl3 Chemically Competent Cell(Transgen,CD521-02),P3 Primary Cell 4D-NucleofectorTMX Kit S(Lonza,V4XP-3032)。
1.3 质粒提取
1.3.1 转化
从-80 ℃冰箱中取出感受态细胞(TransStbl3 Chemically Competent Cell)迅速置于冰上,待感受态细胞融化后取25~50 μL于1.5 mL EP管中,加入100 ng质粒并混合均匀,冰上放置30 min后于42 ℃水浴中60 s,迅速置于冰上2 min,加入无抗菌素的400 mL LB液体培养基于37 ℃,200 r/min摇床孵育1 h,取100 μL该LB均匀涂布于相应抗性的平板上,于37 ℃生化培养箱孵育过夜。
1.3.2 质粒提取方法的优化
用试剂盒进行质粒提取,基本程序:取37 ℃ 孵育过夜的平板,用无菌枪头刮取菌落,放入400 mL 含相同抗生素的LB液体培养基中,200 r/min,37 ℃培养摇菌过夜(10~20 h)。离心收集菌体,10 mL P1悬浮菌体,10 mL P2裂解菌体,10 mL P3中和菌体以释放质粒,离心收集包含质粒的上清液(简称细菌裂解),上清液过柱(简称过柱),清洗液清洗2次柱子,用15 mL洗脱液从柱子上洗脱质粒(简称洗脱),加入10.5 mL的异丙醇沉淀质粒,离心沉降质粒后去掉上清液,70%乙醇洗1遍后用0.1×TE溶解质粒,收集到1.5 mL离心管10 000 r/min离心2 min,取上清。
为了优化质粒提取方法,设计了下面的试验:
组1(优化):在进行大量摇菌前,进行小管摇菌(优化步骤1),即取37 ℃孵育过夜的平板,用无菌枪头刮取一些菌体,放入5 mL 含相应抗生素的LB液体培养基中,200 r/min,37 ℃孵育6 h。在加入异丙醇后置于-20 ℃冰箱过夜然后进行后面的离心操作(优化步骤2)。
组2:只增加优化步骤1,不实行优化步骤2。
组3:不增加优化步骤1,实行优化步骤2。
组4(常规):不增加优化步骤1,不实行优化步骤2。
1.4 质粒的浓度和双酶切测定
用微量分光光度计(IMPLEN,NanoPhotometer P-Class)测定质粒浓度,计算不同质粒提取组中得到的质粒总量,记录A260/A280和A260/A230值,用1%琼脂糖凝胶电泳后,通过紫外照射检测质粒超螺旋情况,评判质粒质量。将提取的HA-BIRC5质粒用EcoRⅠ与XhoⅠ进行了双酶切,通过1%琼脂糖凝胶电泳鉴定酶切效率。
1.5 质粒的表达检测
将2种方法提取的5 μg pLenti-GFP-DOCK8质粒用Lipo2000(Invitrogen,11668019)根据说明书转染到前1 d准备好的6 cm细胞培养皿中的HEK293细胞中,48 h后通过荧光显微镜检测绿色荧光蛋白(GFP)的表达情况。将2种方法提取的5 μg pLenti-GFP-DOCK8,2 μg HA-GCN5,2 μg HA-BIRC5和2 μg pLenti-GFP质粒用Lipo2000(Invitrogen,11668019)根据说明书转染到前1 d准备好的6 cm细胞培养皿中的HEK293细胞中,48 h后收集细胞进行免疫印迹试验。将PFF细胞消化下来后,加入Lonza电转液,用电转仪(4D-Nucleofector Core Unit,Lonza)设置DT130电转条件将2种方法提取的5 μg pLenti-GFP质粒电转到PFF中。
转染或者电转48 h后收集细胞,加入EBC蛋白裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂)裂解细胞后离心,取上清液用酶标仪测定蛋白浓度,加入SDS-PAGE蛋白上样缓冲液,100 ℃煮5 min,样品保存于-20 ℃。用SDS-PAGE分离后,加入相应的抗体后显影检测蛋白表达。
1.6 体内泛素化试验
将2 μg His-ub,2 μg GFP-BRD2,2 μg不同方法提取的Flag-SPOP 转染到HEK293细胞中,36 h后加入20 μmol/L MG132处理6 h。细胞用裂解液A(6 mol/L guanidine-HCl, 0.1 mol/L Na2HPO4/PO4, 10 mmol/L imidazole[pH=8.0]) 裂解并进行超声破碎。10 000 r/min离心后取上清液与镍一三乙酸 (Ni-NTA) (QIAGEN) 在常温孵育3 h。用裂解液A 洗涤2遍后,用液体A/TI (1体积buffer A和3体积buffer TI)洗涤2遍,然后用溶液TI(25 mmol/L Tris-HCl,20 mmol/L imidazole[pH=6.8])洗涤1遍后加入SDS-PAGE蛋白上样缓冲液后进行免疫印迹。
1.7 体内乙酰化试验
将HEK293细胞转染0.5 μg Flag-P53,3 μg不同方法提取的HA-P300。细胞裂解后计算浓度取1 000 μg,用EBC蛋白裂解液将体积补至500 μL,加8 μL HA-beads (GE Healthcare),20 μL 5 mol/L NaCl。4 ℃旋转孵育3 h。用NETN buffer (20 mmol/L Tris, pH值8.0, 100 mmol/L NaCl, 1 mmol/L EDTA, 0.5% NP-40)洗涤4遍后加入SDS-PAGE蛋白上样缓冲液后进行免疫印迹。
1.8 统计学分析
荧光显微镜图片中的GFP荧光强度和Western blot结果的灰度等均由Image J软件进行分析。
2 结果
2.1 质粒提取方法的优化
以pLenti-GFP为目的质粒,用不同的方法对质粒进行提取。如表1所示,与组4相比,组1至组3在一定程度上都提高了质粒的产量,其中组1质粒产量提高的最多,表明两步优化能得到最佳的质粒提取效果。

表1 不同方法对质粒提取效率的影响
2.2 不同方法提取的质粒的产量的检测
如表2所示,常规提取方法获得的质粒总量为0.6~0.9 mg,而优化提取方法获得的质粒总量为0.8~1.2 mg。常规方法提取质粒的A260/A280和A260/A230比值(A260/A280=1.90±0.05,A260/A230=2.40±0.3) 与优化方法提取质粒的A260/A280和A260/A230比值(A260/A280=1.90±0.05,A260/A230=2.40±0.2)无显著差异。

表2 不同方法的质粒提取效率
2.3 质粒的琼脂糖凝胶电泳和双酶切
对2种方法提取的质粒进行1%琼脂糖凝胶电泳。结果表明,优化方法和常规方法提取质粒的超螺旋条带没有明显区别(图1A~1E)。2种方法提取的HA-BIRC5质粒用EcoRⅠ与XhoⅠ进行了双酶切,通过1%琼脂糖凝胶电泳鉴定酶切效率,结果表明优化方法没有影响质粒的酶切效率(图1F)。

M. DNA Marker;1. 常规方法提取的质粒;2. 优化方法提取的质粒。A. GFP-DOCK8;B. Flag-SPOP;C. HA-GCN5;D. HA-BIRC5;E. HA-P300;F. 质粒HA-BIRC5双酶切产物
2.4 质粒的细胞内表达效率的检测
用荧光显微镜检测pLenti-GFP-DOCK8在HEK293细胞中的表达,结果表明,优化方法提取的质粒表达升高(图2)。免疫印迹试验检测pLenti-GFP-DOCK8(图3A)、HA-GCN5(图3B)、HA-BIRC5(图3C)和pLenti-GFP(图3D)质粒在HEK293细胞的表达,结果表明优化方法提取的质粒的表达效率没有降低。用荧光显微镜检测pLenti-GFP质粒在PFF细胞中的表达,结果表明2种方法提取的质粒均能高效地转染到PFF细胞中(图4)。
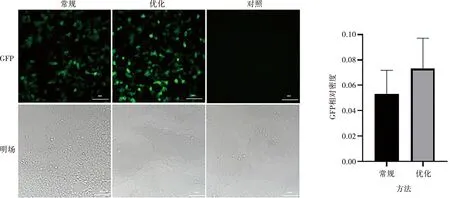
图2 荧光显微镜检测pLenti-GFP-DOCK8在HEK293细胞中的表达

A. GFP-DOCK8; B. HA-GCN5; C. HA-BIRC5; D. pLenti-GFP

图4 荧光显微镜检测pLenti-GFP在PFF中的表达
2.5 质粒生物学功能的检测
乙酰化试验、泛素化试验和细胞内降解试验的结果表明,2种方法提取的散斑型BTB/POZ蛋白(speckle type BTB/POZ protein, SPOP)具有相似的促进底物布罗莫结构域蛋白2(bromodomain containing 2, BRD2)泛素化(图5A)和降解的能力(图5B),2种方法提取的P300均能有效促进P53的乙酰化(图5C)。

A. Western blot检测SPOP促进BRD2泛素化;B. Western blot检测SPOP降解BRD2;C. 免疫共沉淀检测P300促进P53乙酰化
3 讨论
质粒DNA作为基因表达载体被广泛应用在基因工程中。所有提取质粒DNA的方法基本都包括培育菌体使质粒扩增,回收细菌并使其裂解,分离并纯化质粒这3个基本步骤。目前关于质粒提取的方法主要有碱裂解法、煮沸法、WELCH法等。质粒的产量和质量是影响质粒应用的重要因素。而质粒提取质量与效率受到菌体浓度、培育时间、提取方法等多个因素的影响。因此,研究者们通过尝试不同的方法对质粒的提取条件进行改良,以期提高质粒的提取产量,并缩短质粒的提取时间。
薛仁镐等[12]通过反应条件的改良,建立了一种极为快速的质粒DNA碱裂解法,改良方法大大缩短了质粒DNA制备时间,但质粒得率较低。胡小青等[13]在低温条件下进行质粒提取,以增加质粒抽提产量,并增加其在细胞中表达效率的方法,该方法发现质粒提取过程中各个步骤均对温度敏感,低温条件是增加质粒产量的最优选择,但是操作过程需全程在4 ℃条件下进行,需要冷库才能进行,时间也没有得到明显缩短。朱开春等[14]通过对在传统的煮沸裂解法进行改进,并选择质粒保有率高、适合发酵的 TOP10 菌株,在70 ℃的裂解温度下进行质粒提取,从而简化了抽提过程,缩短了提取时间,同时增加了质粒 DNA 的提取效率。但缺点是煮沸法较易破坏质粒 DNA 的结构,且不适用于没有氯霉素处理的培养物。吴韶光等[15]对WELCH法进行了改进,去掉加RNase和酚:氯仿抽提步骤,使WELCH法更为简捷、方便。但因为尚不清楚的原因,用这种方法粗提的质粒DNA在4 ℃存放时,DNA常常自行降解。本研究通过综合他人的试验优点,在常规的提取程序中增加了提前小管摇菌和异丙醇-20 ℃过夜孵育,其中小摇过程可能有助于细菌的扩增从而提高初始菌液的浓度,而异丙醇低温过夜步骤可能降低质粒DNA在异丙醇中的溶解度从而有助于质粒的醇沉,使质粒提取的产量提高了20%~40%,提取的质粒经过琼脂糖凝胶电泳、双酶切等试验,显示质量并没有降低。质粒的生物学功能通过蛋白泛素化和乙酰化试验进行了验证。SPOP是一种Cullin3家族的E3泛素连接酶,SPOP与底物结合后对底物蛋白质进行泛素化和降解。目前已经知道的SPOP的底物有多种,课题组前期的研究发现,SPOP能够结合、泛素化并降解BET(bromodomain and extra-terminal)蛋白质家族BRD2、BRD3、BRD4等[16]。本试验结果表明,优化方法没有降低SPOP促进底物泛素化和降解的能力。
虽然本研究优化了质粒的提取方法,但是质粒产量仍然有待提高,后面应该在该方法的基础上,进一步改进提取策略,以期更大地提高质粒产量。总之,本研究使用常见试剂盒,通过优化质粒的提取步骤,提高了质粒抽提效率,节省了时间和财力、物力,为进一步优化质粒提取方法和思路上提供重要的参考和指导,也为需要大量质粒DNA的试验,如腺相关病毒(AAV)介导的基因治疗等降低了质粒提取的成本。

