烧鸡中产芽孢菌的分离鉴定及耐受性比较研究
宋萌萌 黄天然 周兴虎 张亚莉 黄明

摘 要:從烧鸡中筛选出产芽孢菌,探究高温巴氏杀菌后烧鸡腐败的主要原因。利用划线纯化法、革兰氏染色法结合芽孢染色法从烧鸡及其卤汤中筛选出产芽孢菌,然后对菌株进行16S rRNA分析及生理生化鉴定,确定菌株的种属,并对菌株的生长曲线及耐盐、耐酸和耐热性进行研究。结果表明:从烧鸡及其卤汤中共筛选分离出4 株革兰氏阳性芽孢杆菌,分别为海水芽孢杆菌(Bacillus aquimaris)、黄海芽孢杆菌(Bacillus marisflavi)、甲基营养型芽孢杆菌(Bacillus methylotrophicus)和地衣芽孢杆菌(Bacillus licheniformis),其中,地衣芽孢杆菌的生长繁殖速度最快,至6 h就基本进入生长稳定期;海水芽孢杆菌和黄海芽孢杆菌的耐盐性最强,在NaCl质量浓度达到12 g/100 mL时仍然有部分存活;甲基营养型芽孢杆菌的耐酸性最强,在pH值4.5条件下培养6 h后菌落数能够达到约8(lg(CFU/mL));在4 株产芽孢菌中,地衣芽孢杆菌的耐热性最强,且不受处理温度和时间的影响。
关键词:烧鸡;产芽孢菌;分离鉴定;腐败;耐受性
Isolation and Identification of Spore-Forming Bacteria from Braised Chicken and Comparison of
Their Environmental Tolerance
SONG Mengmeng1,2, HUANG Tianran1, ZHOU Xinghu1, ZHANG Yali2, HUANG Ming1,2,*
(1.National R&D Center for Poultry Processing, Jiangsu Research Center for Livestock and Poultry Products Processing Engineering Technology, Nanjing Huangjiaoshou Food Science and Technology Co. Ltd., Nanjing 211225, China;
2.Key Laboratory of Meat Processing and Quality Control, Ministry of Education, College of Food Science and Technology,
Nanjing Agricultural University, Nanjing 210095, China)
Abstract: This study was conducted to select spore-forming strains from braised chicken for the purpose of figuring out the major cause of its spoilage after high-temperature pasteurization. The target strains were isolated from braised chicken and the remaining marinade by the streak plate method as well as through Gram staining and spore staining and were identified as Bacillus by 16S rRNA analysis and physiological and biochemical characterization. Their growth curves and tolerance to salt, acid and heat were investigated. The results indicated that a total of four Gram-positive Bacillus were obtained and they were identified as B. aqimaris, B. marisfavi, B. methyltrophicus and B. licheniformis. Among them, B. licheniformis grew fastest, which entered the stationary phase of growth at 6 h. In the presence of 12 g/100 mL NaCl solution, B. aquimaris and
B. marisflavi survived partially, showing the highest salt tolerance. B. methylotrophicus could grow to ~ 8 (lg (CFU/mL)) after 6 h cultivation at pH 4.5, having the highest acid resistance. B. licheniformis was the most heat resistant among the four strains , which was not affected by heat treatment temperature and time.
Keywords: braised chicken; spore-forming bacteria; isolation and identification; spoilage; tolerance
DOI:10.7506/rlyj1001-8123-20210817-203
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2021)10-0018-07
引文格式:
宋萌萌, 黄天然, 周兴虎, 等. 烧鸡中产芽孢菌的分离鉴定及耐受性比较研究[J]. 肉类研究, 2021, 35(10): 18-24. DOI:10.7506/rlyj1001-8123-20210817-203. http://www.rlyj.net.cn
SONG Mengmeng, HUANG Tianran, ZHOU Xinghu, et al. Isolation and identification of spore-forming bacteria from braised chicken and comparison of their environmental tolerance[J]. Meat Research, 2021, 35(10): 18-24. DOI:10.7506/rlyj1001-8123-20210817-203. http://www.rlyj.net.cn
烧鸡是我国典型的传统酱卤肉制品,至今已有几百年的历史,因其浓郁的香味以及独特的口感,备受中国消费者的喜爱和关注,有着“天下第一鸡”的美称[1]。烧鸡营养丰富,水分活度高,微生物很容易在其表面和内部大量繁殖而引起腐败。卤煮是烧鸡的主要加工步骤,其温度相对较低,虽然可以导致大部分细菌的死亡,但对于超耐热的微生物,尤其是一些细菌的芽孢,则难以杀灭[2]。
引起食品腐败的微生物,除了普通的假单胞菌、大肠杆菌、乳酸菌属等,还有芽孢杆菌属[3]。芽孢杆菌属是革兰氏阳性杆菌[4],在空气、土壤[5]甚至外太空[6]中都有分布,在不利条件下产生的芽孢能够存活数年[7],这种休眠体结构复杂[8],对热[9]、紫外线[10]、化学物质[11]、溶菌酶[12]、干燥[13]具有很强的抗逆性,是造成肉制品腐败[14]
和食源性疾病[15-16]的主要原因,并且很难通过巴氏杀菌方式除去[17]。芽孢在食品中存在的原因有以下几点:1)巴氏杀菌几乎杀死了所有具有潜在竞争作用的营养细胞;2)产芽孢菌会附着于不锈钢表面,形成生物膜,生物膜脱落时释放的芽孢会导致食品在加工过程中被污染。当外界环境适宜时,食品中残留的芽孢便开始萌发,导致食品腐败变质,甚至在代谢过程中产生毒素。芽孢主要通过以下2 种方式致病:1)存在于食品中的芽孢在萌发时产生毒素,消费者食用了被芽孢毒素污染的食品;2)消费者食用了有芽孢残留的食品,芽孢在人体肠道内萌发,产生毒素,从而诱发食源性疾病。并且,芽孢可污染多种食品,包括肉类、蔬菜、水果、粮食等,给食品行业带来巨大挑战。研究烧鸡中的产芽孢菌有助于了解烧鸡腐败的原因,改善烧鸡保鲜方法。
细菌种属的鉴定方法分为2 种,一种是经典法,即通过肉眼及显微镜观察菌落形态、染色结果,并检测碳、氮源的利用等;另一种是分子法,其中最常见的是16S rRNA测序。16S rRNA基因存在于所有细菌的基因组中,保守性高,可用来揭示菌种之间的亲缘关系。此外,多位点序列分型(multilocus sequence typing,MLST)也被用于菌种鉴定,是一种基于核酸序列测定的细菌分型方法,能够分析菌株的变异,具有较高的分辨能力。16S rRNA测序具有高度的灵敏性和特异性,且速度快,检测能力强,被广泛应用于菌种鉴定、菌群结构及数量测定等[18-19]。
因此,本研究从烧鸡及其老卤汤中分离筛选出其中的产芽孢菌,通过生理生化反应和16S rRNA鑒定确认分离出的产芽孢菌株的种类,然后对其生长曲线和耐酸、耐盐、耐热性进行研究,为肉品中产芽孢菌的控制提供理论依据。
1 材料与方法
1.1 材料与试剂
烧鸡由某食品科技有限公司提供。
营养琼脂、革兰氏染色试剂盒、生理生化鉴定管 南京丁贝生物科技有限公司;LB肉汤 南京沃博生物科技有限公司;芽孢染色试剂盒 南京迈博生物科
技有限公司;氯化钠(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SG403A生物安全柜 美国Baker公司;B1-150A生化培养箱 施都凯仪器设备(上海)有限公司;Multitron Standard振荡培养箱 伊孚森生物技术(中国)有限公司;Allegra-64R高速冷冻离心机 美国Beckman公司;HH-W恒温水浴箱 金坛市恒丰仪器制造有限公司;Scope.A1正置荧光显微镜 德国Carl Zeiss公司;FP-1100-C全自动生长曲线分析仪 芬兰Bioscreen公司。
1.3 方法
1.3.1 采样
老卤:吸取1 mL烧鸡卤汤于9 mL无菌生理盐水中,涡旋。
烧鸡:拭子蘸取无菌生理盐水,在烧鸡的口腔处选择合适的取样框进行涂抹,另取几只新的拭子,分别在腹腔、腿及表皮处涂抹,取样完成后将拭子放入10 mL生理盐水中,涡旋。
1.3.2 分离纯化
采用倾注法,吸取1 mL上述均质液于无菌培养皿中,37 ℃培养48 h,挑取可疑单菌落进行划线分离。观察并记录纯化单菌落的表面状况、凸起情况、边缘状况、菌落形状、表面光泽、菌落颜色、透明程度等。再次挑取可疑纯化单菌落进行液体培养(37 ℃、180 r/min、24 h)。
1.3.3 染色镜检
革兰氏染色:使用革兰氏染色试剂盒染色,油镜观察。
芽孢染色采用Schaeffer-Fulton法[20]:活化的菌悬液按体积分数1%接种于LB液体培养基,摇床(37 ℃、220 r/min)培养72 h,吸取1 mL用磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)离心(7 000 r/min、15 min、4 ℃)洗涤4 次,弃上清液,取沉淀重悬于PBS中,适量稀释。涂片,自然干燥后,吸取适量孔雀绿染色液覆盖涂片,弱火间断加热染色10 min后,冲洗去多余染色液;干燥后用芽孢复染液覆盖染色2~3 min,用水冲洗,晾干后镜检观察。
1.3.4 生理生化鉴定
参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》[21]中芽孢菌属鉴别特征,选择生理生化指标进行菌种的初步鉴定。
1.3.5 16S rRNA鉴定
纯化分离的菌悬液送至上海凌恩生物科技有限公司进行16S rRNA鉴定,使用NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序结果进行比对,确定菌种并上传获得登录号。
1.3.6 生长曲线测定
将活化的菌悬液接种于LB肉汤,调节菌悬液浓度为4(lg(CFU/mL))。吸取400 μL于全自动生长曲线分析仪自带的孔板中,用全自动生长曲线分析仪测定600 nm波长处光密度(OD600 nm)(仪器参数:温度37 ℃、时间24 h);剩余样品摇床(37 ℃、220 r/min)培养24 h,每3 h取一次样,进行适宜梯度稀释并涂板计数,绘制生长曲线[22]。
1.3.7 耐盐性测定
配制NaCl质量浓度分别为1、3、6、9、12 g/100 mL的LB营养肉汤,接入4(lg(CFU/mL))菌悬液,摇床(37 ℃、220 r/min)培养12 h,涂板计数[23]。
1.3.8 耐酸性测定
将约6(lg(CFU/mL))的菌悬液接种于pH值分别为2.5、3.5、4.5、6.5、7.0的LB营养肉汤中,摇床(37 ℃、220 r/min)培养6 h后,涂板计数[24]。
1.3.9 耐熱性测定
将活化的菌悬液以4(lg(CFU/mL))接种于LB营养肉汤中,37 ℃培养12 h。于85、90、95 ℃水浴分别处理0、5、15、25 min,迅速冰浴,平板计数,并求出D值[25]。D值是一定温度条件下杀死细菌中90%原有活菌所需要的时间,计算公式如下。
式中:t为处理时间/min;a为初始菌数/(CFU/mL);b为经一定时间(t)处理后的菌数/(CFU/mL)。
1.4 数据处理
数据结果表示为平均值±标准差(n=3)。微生物计数以菌落形成单位的对数值(lg(CFU/mL))表示,采用Origin 9.0软件进行绘图。
2 结果与分析
2.1 烧鸡及其卤汤中产芽孢菌的分离
共筛选出4 个可疑菌落,分别编号为T17、T19、T27和T29,对这4 株可疑菌株进一步鉴定。
2.1.1 分离菌株的单菌落形态观察及染色结果
观察记录4 个菌落的形态特点,如表1所示。
通过Schaeffer-Fulton法对培养菌液染色,由图1可知,可疑菌株T17、T19、T27、T29染色后,通过油镜均能观察到呈现绿色的芽孢,说明这4 株菌均能生成芽孢。此外,从菌体(红色)形态观察可知,4 株菌的菌体都呈杆状。
2.1.2 生理生化鉴定结果
依据《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》,进行生理生化指标测定,结果如表2所示。结合菌落形态(表1)可初步判断筛选出的菌株T17、T19、T27、T29均属于芽孢杆菌属。
2.1.3 16S rRNA鉴定结果
将分离出的4 株菌进行16S rRNA鉴定,并上传序列至Genbank以获得登录号。由表3可知,4 株菌的相似度均达到99%以上,说明16S rRNA鉴定结果较好。4 株菌分别为海水芽孢杆菌、黄海芽孢杆菌、甲基营养型芽孢杆菌和地衣芽孢杆菌。
2.2 烧鸡及其卤汤中芽孢杆菌的生长特性
2.2.1 不同芽孢杆菌的生长曲线
通过绘制生长曲线,了解各芽孢杆菌生长特性,为后续各菌培养时间提供参考。由图2可知,各株芽孢杆菌在LB肉汤中的生长特性有所不同,但菌落数最终都能达到9~10(lg(CFU/mL))。菌株T17(海水芽孢杆菌)在0~12 h处于增长期,12~18 h生长缓慢,18 h后生长较为稳定(图2A);T19(黄海芽孢杆菌)前6 h生长缓慢,6~12 h为快速生长期,12 h后菌落数缓慢增加(图2B);T27(甲基营养型芽孢杆菌)在0~6 h为生长迟缓期,6~15 h为生长对数期,而后生长缓慢(图2C);T29(地衣芽孢杆菌)在前6 h呈对数增长,6 h后生长缓慢(图2D)。
海水芽孢杆菌、黄海芽孢杆菌和甲基营养型芽孢杆菌3 株芽孢杆菌在3~12 h期间生长最快,12 h基本稳定,符合芽孢杆菌的生长特性[26]。陈秀秀等[27]分离的凝结芽孢杆菌也有类似的生长趋势,菌株在4 h进入对数生长期,14 h进入稳定期。并且,4 株芽孢杆菌在37 ℃培养结束后菌落数能达到8~10(lg(CFU/mL)),这与游佳欣等[28]实验结果相似,枯草芽孢杆菌在35 ℃条件下培养,菌落数可达8.56(lg(CFU/mL)),其中地衣芽胞杆菌的生长繁殖速度较快,6 h之后缓慢增长,魏强等[29]也得出了类似结果,地衣芽孢杆菌在3 h开始快速增长。
2.2.2 不同芽孢杆菌的耐盐性实验结果
将初始菌落数约为4(lg(CFU/mL))的菌液接种于含不同质量浓度NaCl的LB营养肉汤中,摇床培养12 h后计数。由图3可知,在低质量浓度NaCl(≤3 g/100 mL)培养肉汤中,对4 株芽孢杆菌的生长几乎无影响,其菌落数可达到8~10(lg(CFU/mL))。当NaCl质量浓度达到6 g/100 mL时,4 株芽孢杆菌的生长均受到不同程度的抑制作用,其中菌株T19(黄海芽孢杆菌)和T27(甲基营养型芽孢杆菌)受到的抑制作用较小,而T29(地衣芽孢杆菌)的菌落数小于初始菌落数。NaCl质量浓度为9 g/100 mL时,除了T19,其余芽孢杆菌的菌落数均低于初始值。而T17(海水芽孢杆菌)和T19(黄海芽孢杆菌)在NaCl质量浓度达到12 g/100 mL时依然有约3(lg(CFU/mL))的菌存活。
含低质量浓度NaCl(≤3 g/100 mL)的LB营养肉汤对本研究中芽孢杆菌的生长没有影响,高质量浓度NaCl(>6 g/100 mL)不利于芽孢杆菌的生长,这与骆琦[30]从烧鸡老汤中筛选出的枯草芽孢杆菌的耐盐性一致,NaCl质量浓度高于5 g/100 mL时,枯草芽孢杆菌的生长受到抑制,当NaCl质量浓度达到12 g/100 mL时,有些芽孢杆菌则不生长。陈蒙恩等[31]分离的一株产香芽孢杆菌在NaCl质量浓度小于10 g/100 mL时有生长,NaCl质量浓度大于10 g/100 mL时则无生长,与本研究结果类似。菌株T17(海水芽孢杆菌)和T19(黄海芽孢杆菌)表现出高耐盐性,其耐盐机制可能是通过调节自身耐盐基因的表达来实现[32]。
2.2.3 不同芽孢杆菌的耐酸性实验结果
将初始菌落数约为6(lg(CFU/mL))的菌液在不同pH值条件下培养6 h。由图4可知,当培养基pH值为6.5时,4 株芽孢杆菌的生长基本不受影响。当pH<4.5时,所有芽孢杆菌的菌落数均小于初始菌落数。在分离出的4 株芽孢杆菌中,菌株T27(甲基营养型芽孢杆菌)耐酸能力最强,当pH值为4.5时,仍能生长良好且菌落数最终达到约8(lg(CFU/mL))。菌株T17(海水芽孢杆菌)和T19(黄海芽孢杆菌)耐酸能力较弱,当培养基pH值为5.5时,培养6 h后,其菌落数低于初始菌落数。而T29(地衣芽孢杆菌)在pH≥5.5时,生长繁殖不受影响,说明地衣芽孢杆菌耐酸能力较好。4 株菌在pH值为2.5时菌落数很少,李新等[33]分离的沙福芽孢杆菌的耐酸性实验也有类似的结果,在pH值为2左右时,菌株的生长很微弱。
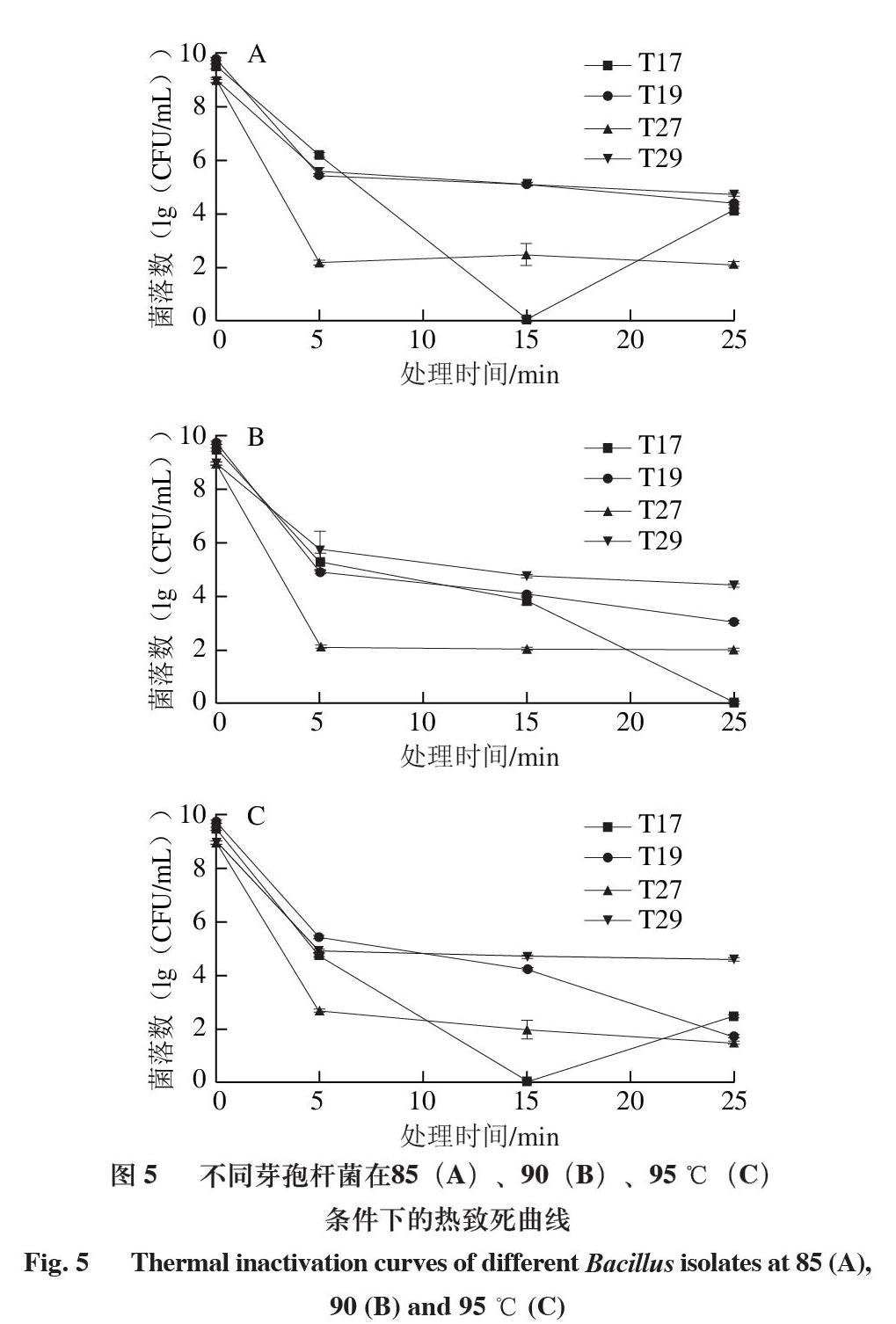
2.2.4 不同芽孢杆菌的耐热性实验结果
由图5可知,4 株芽孢杆菌经过85、90、95 ℃水浴处理5 min后,菌落数下降4~8(lg(CFU/mL))。且随着处理温度的升高,芽孢杆菌的存活率下降。85 ℃和95 ℃热处理菌株T17时,15 min前菌落数呈下降趋势,但是当处理时间大于15 min后,残存菌落数不降反升;而在90 ℃条件下,T17菌落数随着处理时间的延长而减少,当处理时间达到25 min时,T17营养体细胞被全部杀灭。菌株T19在3 个不同温度条件下,菌落数均随着处理时间的延长而减少,但处理5 min后,菌落数减少缓慢。相对于其他3 株菌,T27处理5 min能得到最大致死数,菌落数下降约8(lg(CFU/mL)),但继续持续加热时,T27的菌落数基本不变。在不同温度热处理5 min时,T29的菌落数减少值(4(lg(CFU/mL)))远远低于T27的减少值(8(lg(CFU/mL)));且隨着处理时间延长,T17和T19的残存菌落数都呈现不同程度的下降,而处理5 min之后,T29的菌落数随着处理温度的升高及处理时间的延长减少较小。
5 min的热处理可以有效杀灭大部分芽孢杆菌营养体,但5 min后,不同的芽孢杆菌对温度呈现出不同程度的抗性。这可能是由于随着温度和处理时间的变化,菌株细胞膜中的长链饱和脂肪酸比例升高,增加其耐热性[34]。
85 ℃处理下芽孢杆菌的存活率高于90 ℃和95 ℃,这与谢晓佩等[35]从西藏牦牛的新鲜粪便中分离出的枯草芽孢杆菌的耐热性相似。另外,由于T29(地衣芽孢杆菌)在不同温度条件下处理5 min时的存活率整体较高,且处理5 min后其菌落数基本不受处理温度和时间的影响,说明地衣芽孢杆菌在4 株菌中的耐热性最强。在90 ℃条件下处理5 min后,T29(地衣芽孢杆菌)的耐热性在每个时间点均高于其余菌株,这与罗鹏[36]的结果类似,即地衣芽孢杆菌在90 ℃的耐热性较好。
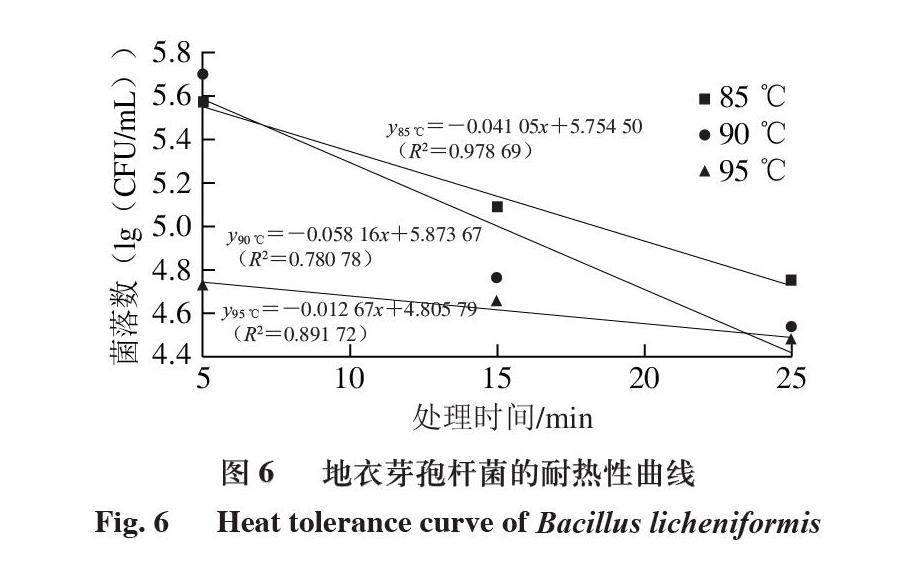
2.2.5 地衣芽孢杆菌的D值
T29(地衣芽孢杆菌)的耐热性优于其他3 株菌,因此,制作T29的耐热性曲线。由图6可知,不同温度热处理条件下T29的D值分别为:D85 ℃=24.36 min(R2=0.978 69)、D90 ℃=17.19 min(R2=0.780 78)、D95 ℃=78.93 min(R2=0.891 72)。在95 ℃时,D值不降反升,而罗鹏[36]所分离的地衣芽孢杆菌在90 ℃条件下的D值大于100 ℃条件下;吴霜[37]发现,蜡样芽孢杆菌的D值随着温度的升高而降低,这与本研究结果不符,可能是由于在95 ℃处理时,部分营养体裂解生成芽孢,芽孢的抗热性是营养细胞的104 倍,主要是由于芽孢核内2,6-吡啶二羧酸的存在,此种成分的积累使芽孢核内水分排出,导致芽孢核水分含量极低,从而增加了抗热性[38-39]。
3 结 论
经纯化筛选,烧鸡及其卤汤中共分离得到4 株芽孢杆菌,通过生理生化鉴定以及16S rRNA鉴定确认为海水芽孢杆菌、黄海芽孢杆菌、甲基营养型芽孢杆菌和地衣芽孢杆菌。测定4 株菌的生长曲线,并分别进行耐受性实验。结果表明:地衣芽孢杆菌最快进入生长对数期,到6 h基本稳定;4 株菌都呈现出不同程度的耐酸和耐盐能力,而地衣芽孢杆菌耐热性在4 株菌中最强,这为烧鸡中芽孢的防控及货架期的延长提供了很好的理论依据。
參考文献:
[1] DUAN Yan, ZHENG Fuping, CHEN Haitao, et al. Analysis of volatiles in Dezhou braised chicken by comprehensive two-dimensional gas chromatography/high resolution-time of flight mass spectrometry[J]. LWT-Food Science and Technology, 2015, 60(2): 1235-1242. DOI:10.1016/j.lwt.2014.09.006.
[2] JUNEJA V K, OSORIA M, HWANG C A, et al. Thermal inactivation of Bacillus cereus spores during cooking of rice to ensure later safety of boudin[J]. LWT-Food Science and Technology, 2020, 122: 108955. DOI:10.1016/j.lwt.2019.108955.
[3] KORT R, OBRIEN A C, VAN STOKKUM I H M, et al. Assessment of heat resistance of bacterial spores from food product isolates by fluorescence monitoring of dipicolinic acid release[J]. Applied and Environmental Microbiology, 2005, 71(7): 3556-3564. DOI:10.1128/AEM.71.7.3556-3564.2005.
[4] 刘国红. 芽孢杆菌的分类鉴定及其相关属的分类系统演变研究[D]. 福州: 福建农林大学, 2009: 6-7. DOI:10.7666/d.y1515104.
[5] CANO R J, BORUCKI M K. Revival and identification of bacterial spores in 25- to 40-million-year-old Dominican amber[J]. Science, 1995, 268: 1060-1064. DOI:10.1126/science.7538699.
[6] CORTESAO M, FUCHS F M, COMMICHAU F M, et al. Bacillus subtilis spore resistance to simulated mars surface conditions[J]. Frontiers in Microbiology, 2019, 10: 333. DOI:10.3389/fmicb.2019.00333.
[7] SETLOW P. Observations on research with spores of Bacillales and Clostridiales species[J]. Journal of Applied Microbiology, 2019, 126(2): 348-358. DOI:10.1111/jam.14067.
[8] SETLOW P, JOHNSON E A. Spores and their significance[M]//DOYLE M P, DIEZ-GONZALEZ F, HILL C. Food microbiology: fundamentals and frontiers. 5th Ed. Washington DC: ASM Press, 2019: 23-63. DOI:10.1128/9781555819972.
[9] SUNDE E P, SETLOW P, HEDERSTEDT L, et al. The physical state of water in bacterial spores[J]. Proceedings of the National Academy of Sciences, 2009, 106(46): 19334-19339. DOI:10.1128/AEM.66.2.620-626.2000.
[10] NAKPAN W, YERMAKOV M, LNDUGULA R, et al. Inactivation of bacterial and fungal spores by UV irradiation and gaseous iodine treatment applied to air handling filters[J]. Science of the Total Environment, 2019, 671: 59-65. DOI:10.1016/j.scitotenv.2019.03.310.
[11] SETLOW P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals[J]. Journal of Applied Microbiology, 2010, 101(3): 514-525. DOI:10.1111/j.1365-2672.2005.02736.x.
[12] RIESENMAN P J, NICHOLSON W L. Role of the spore coat layers in Bacillus subtilis spore resistance to hydrogen peroxide, artificial UV-C, UV-B, and solar UV radiation[J]. Applied and Environmental Microbiology, 2000, 66(2): 620-626. DOI:10.1128/AEM.66.2.620-626.2000.
[13] GRANGER A C, GAIDAMAKOVA E K, MATROSOVA V Y, et al. Effects of Mn and Fe levels on Bacillus subtilis spore resistance and effects of Mn2+, other divalent cations, orthophosphate, and dipicolinic acid on protein resistance to ionizing radiation[J]. Applied and Environmental Microbiology, 2011, 77(1): 32-40. DOI:10.1128/AEM.01965-10.
[14] PATEIRO M, MUNEKATA P E S, SANTANA A S, et al. Application of essential oils as antimicrobial agents against spoilage and pathogenic microorganisms in meat products[J]. International Journal of Food Microbiology, 2021, 337: 108966. DOI:10.1016/j.ijfoodmicro.2020.108966.
[15] BENEDICT K, CHILLER T M, MODY R K. Invasive fungal infections acquired from contaminated food or nutritional supplements: a review of the literature[J]. Foodborne Pathogens and Disease, 2016, 13(7): 343-349. DOI:10.1089/fpd.2015.2108.
[16] KANEKO I, MIYAMOTO K, MIMURA K, et al. Detection of enterotoxigenic Clostridium perfringens in meat samples by using molecular methods[J]. Applied and Environmental Microbiology, 2011, 77(21): 7526-7532. DOI:10.1128/AEM.06216-11.
[17] HIGGINS D, DWORKIN J. Recent progress in Bacillus subtilis sporulation[J]. FEMS Microbiology Reviews, 2015, 36(1): 131-148. DOI:10.1111/j.1574-6976.2011.00310.x.
[18] 趙小永. 荔波喀斯特洞穴细菌多样性及两株细菌的新种鉴定和性质初探[D]. 贵阳: 贵州师范大学, 2021: 8-9. DOI:10.27048/d.cnki.ggzsu.2021.000211.
[19] 黄鑫. 基于16S rRNA测序对树鼩自发性肿瘤与肠道菌群的分析研究[D]. 昆明: 昆明医科大学, 2020: 9. DOI:10.27202/d.cnki.gkmyc.2020.000844.
[20] SCHAEFFER A B, FULTON M D. A simplified method of staining endospores[J]. Science, 1933, 77: 194. DOI:10.1126/science.77.1990.194.
[21] 阮继生. “伯杰氏系统细菌学手册(第二版)”第5卷与我国的放线菌系统学研究[J]. 微生物学报, 2013, 53(6): 521-530. DOI:10.13343/j.cnki.wsxb.2013.06.009.
[22] 李荞荞. 重离子辐照诱变干酪乳杆菌优良菌株选育及在抗结肠癌中的应用[D]. 兰州: 中国科学院大学, 2020: 13.
[23] 余培斌, 杜晶, 陈建新. 高温好氧堆肥过程中芽孢杆菌的筛选、鉴定及应用[J]. 食品与发酵工业, 2020, 46(12): 199-205; 212. DOI:10.13995/j.cnki.11-1802/ts.022652.
[24] 张琳, 张也, 王如福, 等. 大曲中高产糖化酶菌株的筛选及环境耐受性分析[J]. 山西农业大学学报(自然科学版), 2016, 36(10): 740-744. DOI:10.13842/j.cnki.issn1671-8151.2016.10.010.
[25] 巴翠玉, 张林波, 张培军, 等. 2 株枯草芽孢杆菌的分离鉴定及特性研究[J]. 华南农业大学学报, 2017, 38(3): 46-51. DOI:10.7671/j.issn.1001-411X.2017.03.008.
[26] 田曼丽, 王杰. 微生物生长特性的实验研究[J]. 科学技术创新, 2021(8): 81-82. DOI:10.3969/j.issn.1673-1328.2021.08.038.
[27] 陈秀秀, 孙洪浩, 孙小涵, 等. 一株凝结芽孢杆菌的分离鉴定及益生性分析[J]. 饲料博览, 2020(11): 1-5; 9. DOI:10.3969/j.issn.1001-0084.2020.11.001.
[28] 游佳欣, 应文俊, 杨倩倩, 等. 杨木酶水解液培养枯草芽孢杆菌实验[J]. 林业工程学报, 2021, 6(4): 94-100. DOI:10.13360/j.issn.2096-1359.202012023.
[29] 魏强, 张薇, 石黑虎, 等. 地衣芽孢杆菌(Bacillus licheniformis)10236发酵条件的优化[J]. 河北农业科学, 2019, 23(5): 65-70.
[30] 骆琦. 肉制品中产芽孢菌的分离鉴定及抑菌方法研究[D]. 天津: 天津科技大学, 2017: 28.
[31] 陈蒙恩, 李建民, 韩素娜, 等. 陶融型酒醅中产香芽孢杆菌的筛选、鉴定及发酵产物分析[J]. 中国酿造, 2020, 39(9): 75-79. DOI:10.11882/j.issn.0254-5071.2020.09.014.
[32] 胡玉婕, 朱秀玲, 丁延芹, 等. 芽孢杆菌的耐盐促生机制研究进展[J]. 生物技术通报, 2020, 36(9): 64-74. DOI:10.13560/j.cnki.biotech.bull.1985.2020-0746.
[33] 李新, 卜菁, 沈静雯. 蓝莓果浆中耐酸耐高温微生物的分离与鉴定[J]. 食品安全导刊, 2021(6): 110-114. DOI:10.16043/j.cnki.cfs.2021.06.067.
[34] 贾宪波. 嗜热脂肪芽孢杆菌CHB1耐热机制初步研究[D]. 福州: 福建农林大学, 2011: 49.
[35] 谢晓佩, 王琦, 孔新平, 等. 西藏牦牛源枯草芽孢杆菌的分离培养及鉴定[J]. 家畜生态学报, 2021, 42(3): 26-31. DOI:10.3969/j.issn.1673-1182.2021.03.005.
[36] 罗鹏. 针对一株地衣芽孢杆菌部分耐受性的探讨[J]. 科学养鱼, 2019(9): 43-45. DOI:10.14184/j.cnki.issn1004-843x.2019.09.024.
[37] 吴霜. 乳粉加工环境中蜡样芽孢杆菌分型及耐热性的研究[D]. 哈尔滨: 东北农业大学, 2018: 29.
[38] BARIL E, COROLLER L, COUVERT O, et al. Modeling heat resistance of Bacillus weihenstephanensis and Bacillus licheniformis spores as function of sporulation temperature and pH[J]. Food Microbiology, 2012, 30(1): 29-36. DOI:10.1016/j.fm.2011.09.017.
[39] CHRISTIE G, SETLOW P. Bacillus spore germination: knowns, unknowns and what we need to learn[J]. Cellular Signalling, 2020, 74: 109729. DOI:10.1016/j.cellsig.2020.109729.
收稿日期:2021-08-17
基金項目:国家现代农业(肉鸡)产业技术体系建设专项(CARS-41-Z06);
南京市科技计划项目(国际联合研发项目)(202002040)
第一作者简介:宋萌萌(1998—)(ORCID: 0000-0002-4993-132X),女,硕士研究生,研究方向为畜产品加工和质量控制。
E-mail: 2020108022@stu.njau.edu.cn
*通信作者简介:黄明(1970—)(ORCID: 0000-0001-9026-1850),男,教授,博士,研究方向为畜产品加工和质量控制。
E-mail: mhuang@njau.edu.cn

