镁负载CaO基吸附剂捕集CO2性能及抗烧结机理
孙荣岳,彭超,陈宇皇,朱洪亮
(南京工程学院能源与动力工程学院,江苏 南京 211167)
钙循环技术[1]与化学链燃烧技术[2]并称为第二代CO2捕集技术,由于其吸附剂具有成本低廉且分布广泛、理论捕集容量大以及反应器工艺成熟等优点,被认为是最有可能实现大规模CO2减排的技术之一。以石灰石为代表的钙基吸附剂循环捕集CO2性能随循环次数增加迅速衰减,是限制该技术发展的主要问题[3]。为保证较高的CO2捕集效率,在运行过程中需要不断补充新鲜钙基吸附剂,同时排出大量失活吸附剂。一台350MW 机组满负荷运行,每天需要补充450t 新鲜石灰石,并排出252t 失活CaO[4]。这不仅增加了运行成本,而且会加剧炉膛的磨损、积灰和腐蚀等,对运行造成不良影响。排出如此大量的失活吸附剂,一方面导致了钙资源的浪费,另一方面也带来了如何合理处理及有效回收再利用失活吸附剂的问题。
钙基吸附剂高温煅烧过程中发生了烧结,CaO晶粒相互融合长大,包覆在晶粒内部的CaO更不易发生碳酸化反应,导致吸附剂活性降低[5]。合成能有效抗烧结的高活性CaO代替石灰石作为钙循环技术中的吸附剂,可以有效降低循环反应过程中的吸附剂总量以及补充的新鲜吸附剂耗量,提高CO2捕集效率,降低捕集成本。研究者提出了多种高活性CaO 基吸附剂的制备方法,如添加剂修饰[6]、沉淀碳酸钙(PCC)[7]、惰性载体负载[8]和有机酸改性[9]等。其中,惰性载体负载法向钙基吸附剂中掺杂具有更高烧结温度的金属氧化物作为骨架支撑材料,可以有效延缓CaO晶粒的熔融长大、抑制钙基吸附剂烧结,是一种非常具有应用前景的高活性复合钙基吸附剂的制备方法。常用的金属氧化物有TiO2[10]、MgO[11]、ZrO2[12]、SiO2[13]、Al2O3[14]等。在 这些常用的惰性载体中,MgO 在自然界中含量最高,分布最为广泛,以其为骨架支撑制备的复合钙镁吸附剂具有良好的抗烧结和循环捕集CO2性能。吸附剂中钙镁的分散程度对复合钙镁吸附剂循环反应活性起决定性作用,钙镁来源及制备方法对钙镁分散程度存在显著影响。综合比较来看,物理混合[15]和共沉淀法[16]制备得到的吸附剂钙镁分散均匀性差,所以循环捕集CO2性能提高幅度相对较小。溶胶凝胶法制备得到的钙镁复合吸附剂钙镁分散性好,制备得到的吸附剂循环反应活性最强,但是制备工艺比较复杂,吸附剂制备成本也最高[17]。燃烧合成法制备工艺相对简单,并且得到的吸附剂具有比较高的CO2捕集活性及循环稳定性,是一种比较有工业应用前景的制备方法。目前大部分研究中,普遍采用可溶性盐类作为钙镁来源制备复合吸附剂[18-19]。但是可溶性钙镁盐类在自然界中含量少,造成吸附剂成本较高。因此,如能利用主要成分为CaCO3的天然矿石通过燃烧合成法制备得到高活性钙镁复合吸附剂,无疑更具工业应用前景。
本研究提出以不可溶的CaCO3或Ca(OH)2作为钙源,以甘油作为溶剂及燃料,通过燃烧合成法制备钙镁复合吸附剂,研究了复合吸附剂循环捕集CO2性能及微观结构特性。
1 实验部分
1.1 实验样品
复合吸附剂合成所需要的化学试剂均为从上海泰坦科技有限公司采购的商用试剂,级别为分析纯(AR)。采用CaCO3(AR,≥99%)或Ca(OH)2(AR,≥95%) 为 钙 源, 采 用 Mg(NO3)2·6H2O(AR,≥99%)为镁源,采用甘油(C3H8O3,AR,≥99%)为溶剂和燃料,通过燃烧合成法制备钙镁复合吸附剂,具体过程如下:钙源与甘油和去离子水的比例关系为0.1mol钙源+100mL甘油+100mL去离子水;通过量筒分别量取100mL 甘油和100mL 去离子水置于烧杯中;CaCO3、Ca(OH)2和Mg(NO3)2·6H2O 等固体颗粒经过筛分后,取颗粒度≤0.125mm的样品进行实验;称取适量的钙源和镁源,加入烧杯;在磁力搅拌器上60℃恒温搅拌1h 后,将烧杯中混合溶液(或悬浊液)分置于刚玉坩埚中,放入马弗炉在750℃条件下恒温煅烧30min 合成得到钙镁复合吸附剂,具体制备条件及样品命名如表1所示。合成温度此处设置为750℃,是因为本文作者课题组前期研究证明在750℃条件下合成得到的复合吸附剂循环捕集CO2性能最佳[20]。Ca8Mg2-CC 表示以CaCO3为钙源制备的Ca/Mg摩尔比为8∶2的钙镁复合吸附剂,Ca7Mg3-CH表示以Ca(OH)2为钙源制备的Ca/Mg 摩尔比为7∶3 的钙镁复合吸附剂,其余依此类推。

表1 钙镁复合吸附剂制备条件
1.2 循环煅烧/碳酸化实验
利用自制的双固定床反应器研究了制备的钙镁复合吸附剂循环捕集CO2性能。自制双固定床反应器由两台管式炉(分别为碳酸化炉和煅烧炉)及相应的配气机构组成,如图1所示。钙循环工艺中为了保证CaCO3能快速完全地分解,煅烧温度一般取850~900℃[21],此处选择850℃纯N2气氛煅烧。为了保证循环煅烧过程中CaCO3能完全分解,在循环反应之前进行了预实验以确定煅烧时间。预实验结果显示,无论是未循环的还是多次循环后的复合钙基吸附剂和分析纯CaCO3,经过10min 煅烧后,吸附剂质量基本不再发生变化,表明CaCO3已经完全分解,所以此处煅烧时间取为10min。钙基吸附剂在600~725℃之间能取得较高的碳酸化速率和转化率,而受CO2平衡压力的限制,当碳酸化温度过高时,钙循环能取得的CO2捕集效率会下降,因此综合考虑碳酸化速率和CO2捕集效率,钙循环工艺一般将碳酸化温度设为650~700℃[21]。此处选择碳酸化温度为700℃,碳酸化气氛为模拟电厂烟气中CO2含量,选为15%CO2(N2平衡)。钙基吸附剂碳酸化一般分为两个阶段:反应快速的化学反应控制阶段和反应速度很慢的扩散控制阶段[22]。进入扩散控制阶段后碳酸化转化率在几分钟的时间内增幅很小,所以碳酸化阶段要保证快速反应阶段能进行完全。快速反应阶段一般持续3~5min,而10min足够保证快速反应阶段进行完全,所以此处碳酸化时间选取为10min。实验进行前,以30℃/min 的升温速率将碳酸化炉和煅烧炉分别升至700℃和850℃,然后保持恒温直至实验结束,实验过程中吸附剂在两个反应器间交替往复实现循环。吸附剂首先在煅烧炉内高温煅烧,CaCO3或Ca(OH)2完全分解为CaO,煅烧后的吸附剂被送至碳酸化炉内进行碳酸化实验。利用电子天平(METTLER,ME204)称量煅烧后和碳酸化后吸附剂样品质量,通过样品质量变化计算得到碳酸化转化率(XN)和CO2吸附量(CN),通过这两个参数评价其循环捕集CO2性能,计算公式如式(1)和式(2)所示。型号为梅特勒ME204 的电子天平精度为0.1mg,而实验过程中煅烧后吸附剂样品质量为300~400mg,每次循环吸收的CO2质量为80~160mg,天平误差相对较小,不会对结果产生较大影响。为进一步确认,以分析纯CaCO3为例,进行了重复性实验,如图2所示。发现同一种样品重复性实验结果基本一致,可以充分说明天平误差不会对实验结果产生较大影响。

图1 自制双固定床反应器系统


图2 分析纯CaCO3循环捕集CO2重复性验证实验
式中,N为循环反应次数;XN为第N次循环后吸附剂碳酸化转化率,代表碳酸化生成CaCO3与吸附剂中CaO 的摩尔比;mN为第N次循环后吸附剂质量,mg;mcal为吸附剂煅烧后的质量(吸附剂每次循环煅烧后质量都相同),mg;MCaO和MCO2分别为CaO和CO2的摩尔质量,g/mol;CN为第N次循环后CO2吸附量,代表单位质量煅烧后吸附剂能吸附的CO2质量,g/g;a为初始吸附剂中CaO 质量分数,%,根据制备吸附剂中钙镁摩尔比进行计算得到,如式(3)所示,计算结果如表1所示。
式中,r为吸附剂中CaO的摩尔分数,%。
1.3 微观分析
对初次煅烧和经过20 次循环煅烧后的样品进行取样,采用美国FEI Quanta 250 FEG多用途扫描电镜对不同循环次数煅烧后的吸附剂样品进行了SEM和EDS分析。
2 结果与讨论
2.1 钙镁复合吸附剂循环捕集CO2性能
分别以CaCO3或Ca(OH)2为钙源,选取Ca/Mg摩尔比为8∶2,通过燃烧合成法制备了钙镁复合吸附剂,其循环捕集CO2性能如图3 所示。钙镁复合吸附剂循环捕集CO2能力明显优于CaCO3。第1次循环,Ca8Mg2-CC 和Ca8Mg2-CH 碳酸化转化率分别为0.84 和0.86,比CaCO3高13.5%和16.2%。随循环次数增加,CaCO3碳酸化转化率衰减较快,钙镁复合吸附剂表现出更强的循环稳定性。第20 次循环,Ca8Mg2-CC 和Ca8Mg2-CH 碳酸化转化率仍可达0.48和0.57,比CaCO3高92.0%和128%。制备钙镁复合吸附剂过程中,向吸附剂中添加了MgO。MgCO3在450~500℃及以上温度会发生煅烧反应分解生成MgO 和CO2[23],而此处设定实验条件中,碳酸化温度为700℃,煅烧温度为850℃,均远高于MgCO3的煅烧分解温度,MgO 无法与CO2发生碳酸化反应。因此通常在钙循环捕集CO2过程中,均认为MgO 为惰性成分,不参与循环捕集CO2[24],所以导致了钙镁复合吸附剂活性成分减少,会一定程度上降低单位质量吸附剂吸附CO2的量。如图3(b)所示,第1 次循环Ca8Mg2-CC 和Ca8Mg2-CH 的CO2吸附量略低于CaCO3,但是从第2 次循环开始明显高于CaCO3。经过20 次循环后,Ca8Mg2-CC 和Ca8Mg2-CH 的CO2吸附量为0.32g/g 和0.38g/g,分别 比CaCO3高60% 和90%。对 比Ca8Mg2-CC 和Ca8Mg2-CH 可以发现,第1 次循环Ca8Mg2-CH 碳酸化转化率和CO2吸附量略优于Ca8Mg2-CC,20次循环后Ca8Mg2-CH 碳酸化转化率和CO2吸附量比Ca8Mg2-CC 高18.6%。这说明以Ca(OH)2为钙源制得的钙镁复合吸附剂循环捕集CO2性能优于以CaCO3为钙源制得的吸附剂。

图3 钙镁复合吸附剂循环捕集CO2性能
2.2 钙镁摩尔比对复合吸附剂循环捕集CO2性能的影响
以Ca(OH)2为钙源,研究了Ca/Mg 摩尔比对复合吸附剂循环捕集CO2性能的影响,结果如图4 所示。随着Ca/Mg摩尔比降低,制备钙镁复合吸附剂过程中添加Mg的量越多,得到的复合吸附剂中Mg的骨架支撑作用更强,所以循环碳酸化转化率也越高。如图4(a)所示,第1次循环Ca7Mg3-CH碳酸化转化率为0.93,比Ca8Mg2-CH 和Ca9Mg1-CH 分别高7.8%和47.8%。经过20 次循环后,Ca7Mg3-CH碳酸化转化率仍比Ca8Mg2-CH和Ca9Mg1-CH分别高11.1%和41.6%。当高于7.5∶2.5 后,虽然减小Ca/Mg摩尔比仍能提高复合吸附剂的转化率,但是提高幅度很小。第1 次和第20 次循环Ca7Mg3-CH碳酸化转化率仅比Ca7.5Mg2.5-CH高4.3%和3.1%。Ca7Mg3-CH 和Ca8Mg2-CH 碳酸化转化率随循环次数增加逐渐降低,而Ca9Mg1-CH 第1 次循环转化率较低,在初始几次循环存在自活化的现象。这主要是因为Ca9Mg1-CH中Mg含量较低,在制备过程最后的煅烧阶段产生了比较严重的预烧结,所以第1次转化率较低,而在后续几次循环中有一定程度自活化,然后又随循环次数增加转化率降低。
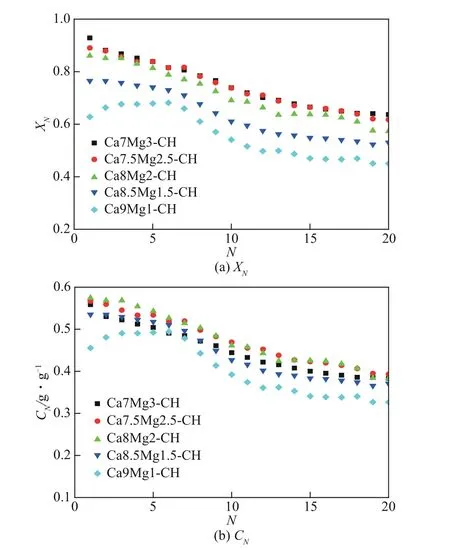
图4 钙镁摩尔比对钙镁复合吸附剂循环捕集CO2性能的影响
虽然Mg 添加量越多,复合吸附剂循环碳酸化转化率越高,但是MgO 在循环反应过程中属于惰性成分,添加过多的MgO反而会导致活性成分CaO含量降低,吸附剂CO2吸附量下降。如图4(b)所示,虽然Ca7Mg3-CH比Ca8Mg2-CH循环碳酸化转化率略高,但是由于其CaO 含量更少,CO2吸附量反而小于Ca8Mg2-CH,并且更多的Mg添加量也意味着吸附剂制备成本会更高。对比图4(b)可以发现,除前几次循环稍低以外,Ca/Mg 摩尔比为7.5∶2.5 时复合吸附剂循环反应过程中CO2吸附量与摩尔比为8∶2时相差不大。综合比较来看,最佳的Ca/Mg摩尔比范围为(8∶2)~(7.5∶2.5)。
2.3 钙镁复合吸附剂长循环捕集CO2性能
以Ca8Mg2-CH 为例,研究了钙镁复合吸附剂长循环捕集CO2性能,结果如图5所示。可以看出,Ca8Mg2-CH 长循环捕集CO2性能明显优于CaCO3。Ca8Mg2-CH 在前20 次循环捕集CO2性能有一定幅度衰减后趋于稳定,20~50 次循环基本不再衰减。CaCO3前20次循环捕集CO2性能衰减更加剧烈,同时20 次循环后仍有一定幅度衰减。50 次循环后Ca8Mg2-CH 的CO2吸附量为0.37g/g,是CaCO3的2.7 倍。表2 对比了本文制备得到的Ca8Mg2-CH 与其他文献中报道的钙镁复合吸附剂循环捕集CO2性能。本研究制备得到的Ca8Mg2-CH 捕集CO2性能明显优于罗聪等[15]和Lan 等[24]等通过物理混合方法制备得到的钙镁复合吸附剂;比溶胶凝胶法制备得到的钙镁复合吸附剂稍差,但胜在制备工艺更加简单,成本更低[25]。Ca8Mg2-CH 与Yan等[26]通过燃烧合成法制备得到的钙镁复合吸附剂相比捕集CO2性能相差不多,比之稍低的原因可能是由于碳酸化时间选取更短所致。综合来看,本文制备得到的钙镁复合吸附剂成本和循环捕集CO2性能方面都具有较强的竞争力,有较强的工程应用前景。

表2 不同方法合成钙镁复合吸附剂循环捕集CO2性能对比

图5 钙镁复合吸附剂长循环捕集CO2性能
2.4 微观结构分析
图6 和图7 为不同循环次数煅烧后钙镁复合吸附剂和CaCO3的SEM 图。如图6(a)所示,第1 次煅烧后的CaCO3晶粒更大、更加密实,这种微观结构不利于CO2扩散到吸附剂晶粒表面发生碳酸化反应。在燃烧合成过程中,甘油燃烧的同时会伴随大量的挥发分析出,在吸附剂的表面生成大量的孔隙。如图6(b)和(c)所示,制备得到的钙镁复合吸附剂经过第1次煅烧后,晶粒更加细小,孔隙分布更多,孔与孔之间的连通性更强,与CaCO3相比更有利于碳酸化反应的进行,所以能取得更高的碳酸化转化率。对比图6(a)和图7(a)可以发现,在循环反应过程中CaCO3发生了严重的烧结,晶粒融合导致孔隙减少,导致转化率随循环次数增加迅速降低。如图7(b)和(c)所示,钙镁复合吸附剂在循环反应过程中烧结较轻,经过20 次循环后保持了较好的孔隙结构。通过氮吸附对第1次和第21次煅烧后钙镁复合吸附剂分布在1~80nm 范围内比孔容和比表面积进行了定量分析,结果如图8所示。通过燃烧合成制备的钙镁复合吸附剂,其煅烧后的比表面积和比孔容均比分析纯CaCO3高。第1 次煅烧后Ca8Mg2-CH 和Ca8Mg2-CC 的比孔容分别比分析纯CaCO3高33.3%和23.3%,比表面积分别比分析纯CaCO3高68.5%和58.5%。MgO 的添加增强了钙镁复合吸附剂抗烧结性能,在循环反应过程中孔结构更加稳定,比孔容和比表面积衰减幅度更小。相比于第1次煅烧,第21次煅烧后分析纯CaCO3的比孔容和比表面积分别衰减了71.7% 和59.4%。而Ca8Mg2-CH 和Ca8Mg2-CC 经过20 次循环煅烧后,比孔容分别衰减了25.0%和37.8%,比表面积分别衰减了42.9%和44.8%,幅度较分析纯CaCO3要小得多。

图6 钙镁复合吸附剂及CaCO3第1次煅烧后SEM分析

图7 钙镁复合吸附剂及CaCO3第21次煅烧后SEM分析
图9 和图10 是煅烧后钙镁复合吸附剂表面Ca和Mg 元素分布情况,可以发现通过本文方法制备得到的钙镁复合吸附剂表面Ca 和Mg 分布均匀。MgO均匀地分布于CaO晶粒之间,有效抑制了循环煅烧过程中CaO晶粒的融合长大,所以钙镁复合吸附剂经过多次循环后仍能保持较好的孔隙结构并取得更高的碳酸化转化率。Ca和Mg的均匀分散程度决定了惰性载体MgO 在抑制CaO 烧结过程中的作用。当用Ca(OH)2作为钙源制备钙镁复合吸附剂时,Ca(OH)2可溶于甘油,Mg(NO3)2可溶于水,而水和甘油又可互溶。因此,Ca(OH)2、Mg(NO3)2、水和甘油混合搅拌后可形成一种均相溶液,在燃烧合成过程中Ca 和Mg 均匀地同时析出,使得Ca8Mg2-CH 中Ca 和Mg 分布均匀,其循环捕集CO2能力也更强。当用CaCO3作为钙源制备钙镁复合吸附剂时,由于CaCO3不可溶于甘油,因此最终CaCO3、Mg(NO3)2、水和甘油混合搅拌后形成一种悬浊液,Mg(NO3)2、水和甘油的溶液经搅拌后进入CaCO3孔隙内部。在燃烧合成的过程中,MgO在CaCO3或CaO内部的孔隙中析出,这就导致了在CaCO3或CaO内部较大孔隙中存在MgO 团聚分布的情况,如图10(b)所示。所以与Ca8Mg2-CH 相比,Ca8Mg2-CC 中的MgO 分布均匀性更差,其在循环反应过程中的骨架支撑作用也稍弱。图8中的孔结构参数数据也证明了这一点,在循环反应过程中,Ca8Mg2-CH 的比孔容和比表面积的衰减幅度要小于Ca8Mg2-CC,说明Ca8Mg2-CH的孔结构更加稳定,因此循环捕集CO2活性更优。

图8 不同循环次数煅烧后钙镁复合吸附剂的孔结构参数

图9 Ca8Mg2-CH的SEM-EDS分析

图10 Ca8Mg2-CC的SEM-EDS分析
3 结论
(1) 分 别 以CaCO3或Ca(OH)2为 钙 源,以Mg(NO3)2为镁源,以甘油为燃料通过燃烧合成法制备得到了高活性钙镁复合吸附剂,在循环反应过程中表现出明显优于CaCO3的循环捕集CO2性能。以Ca(OH)2为钙源制得的钙镁复合吸附剂循环捕集CO2性能优于以CaCO3为钙源制得的吸附剂,50次循环后CO2吸附量仍可达0.37g/g,具有较强的工程应用前景。
(2)随着Ca/Mg摩尔比降低,制备钙镁复合吸附剂过程中添加Mg 的量越多,得到的复合吸附剂中Mg 的骨架支撑作用更强,碳酸化转化率越高;但添加Mg的量越多,捕集CO2活性成分含量越少。综合比较,Ca/Mg 最佳摩尔比为(8∶2)~(7.5∶2.5),此时钙镁复合吸附剂CO2吸附量最高。
(3)本文通过燃烧合成法制备得到的钙镁复合吸附剂表面Ca 和Mg 分散均匀,MgO 均匀分布在CaO晶粒中间,有效提高了钙镁复合吸附剂抗烧结性能及其循环捕集CO2性能。由于在燃烧合成过程中Ca和Mg同时均匀析出,其分布更加均匀,所以以Ca(OH)2为钙源制备得到的Ca8Mg2-CH孔结构更加稳定,循环捕集CO2性能更佳。

