两种新型聚丙烯酰胺电泳胶电泳特性及保质期研究*
李戈辉, 吴 玮, 邸铭洋, 王长城, 杨桂朋, 丁海兵**
(1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100;2. 中国海洋大学化学化工学院, 山东 青岛 266100; 3. 迪申生物技术(上海有限公司), 上海 201201)
电泳[1]是带电粒子在电场作用下向电性相反的电极移动的过程。电泳过程中,粒子所带电荷数、分子大小、形状等各不相同,从而在电场中有不同的移动速度而分离。聚丙烯酰胺电泳胶简称PAGE(Polyacrylamide gel electrophoresis),以聚丙烯酰胺凝胶作为支持介质,利用分子筛效应分离蛋白质和寡核苷酸。电泳过程中的蛋白质迁移率与分子量、形状、电荷量均相关[2]。Shapiro于1967年提出SDS-PAGE(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis)法,可仅凭分子量不同分离蛋白质[3]。1970年,Laemmli完善了不连续电泳技术,用于分离大分子蛋白。不连续缓冲体系由电泳缓冲液、堆积胶、分离胶组成。蛋白质样品在堆积胶中经过大孔径凝胶的堆积效应被浓缩在一个狭窄的区带,形成相同的分离起点;蛋白质进入分离胶后,较小孔径凝胶的分子筛效应将它们分离开[4]。经过多年发展,SDS-PAGE具备了分辨率高、重复性较好、灵敏度高、上样量少等特点,成为广泛应用的蛋白质分离方法[2]。
目前实验室常用的Laemmli法配制的SDS-PAGE胶虽然优点突出,但存在保质期短、耐受电压较低、电泳时间长等问题。一些生命科学公司研发了预制胶产品,在保持Laemmli胶良好分离性能的基础上,缩短了电泳时间,延长了电泳胶的保质期。例如Bio-Rad公司的一种蛋白质凝胶适用电压为200~300 V,电泳时间在30 min左右,在2~8 ℃时保质期为12个月;EZBiolab的预制胶适用电压为150 V,电泳时间在40~50 min,4 ℃时可保存18个月。但目前市场上流行的预制胶价格较高,电泳时间仍然较长,且使用时受限于与之相匹配的电泳系统。制备一种兼备Laemmli胶分离性能和易制备特性,且拥有商业预制胶较长保质期优点的电泳胶十分必要。到目前为止,这方面的主要进展是邸铭洋等用三异丙醇胺代替Laemmli胶中的三羟甲基氨基甲烷-盐酸盐(Tris-HCl)作为缓冲物质,制备了聚丙烯酰胺浓度为7.5%的电泳胶[5]。初步研究表明,这种电泳胶对蛋白质标准有良好的分离效果并具有较长的保质期。
本研究在探究影响电泳胶的保质期关键因素的基础上,以三异丙醇胺和三乙醇胺代替Tris-HCl作为缓冲物质,制备了含有不同浓度聚丙烯酰胺的两种新型电泳胶。对它们性能的全面研究表明,这两种新型电泳胶均保持了Laemmli胶良好的蛋白质分离性能,适用电压和耐受的最高电压均高于目前市场上流行的商业电泳胶,电泳速度更快,保质期更长,具备良好的应用前景。
1 实验部分
1.1 仪器与试剂
仪器 pH计(PB-10,赛多利斯科学仪器有限公司);电泳仪(BG-Power 600K,北京百晶生物技术有限公司);垂直槽制胶支架、垂直电泳槽(VE-180,上海天能科技有限公司);分析天平(CP214,奥豪斯仪器(上海)有限公司);电子天平(TD20002A,余姚市金诺天平仪器有限公司);光照培养箱(GXZ-250A,宁波江南仪器厂);真空封口机(DZ-280/2SE,东莞市金桥科技电器制造有限公司);超声波清洗机(SB-5200,宁波新芝生物科技股份有限公司)。
试剂 三羟甲基氨基甲烷盐酸盐(Tris-HCl,99.9%)、十二烷基硫酸钠(SDS,99.9%)、盐酸(优级纯)、冰醋酸(分析纯)、甲醇(分析纯)(国药集团化学试剂有限公司);N,N-亚甲基二丙烯酰胺单体(Bis,99%)、过硫酸铵(APS,98%)、牛磺酸(99%)、三乙醇胺(97%)、三异丙醇胺(99.5%)、乙醇酸(99%)、甘氨酸(98.5%)(Sigma-Aldrich有限公司);丙烯酰胺单体(Acr,99.9%)、N,N,N(,N(-四甲基乙二胺(TEMED,98%),考马斯亮蓝R250(Decentbio公司);预染色蛋白质标准和未染色蛋白质标准(BBI生命科学有限公司);预制电泳胶(Bio-Rad公司,分离胶浓度分别为7.5%、10%、12%、15%)。
1.2 实验方法
1.2.1 电泳胶的制备 制备分离胶浓度为7.5%、10%、12%、15%的Laemmli胶、新型I、新型II电泳胶若干块,用于检验其最大耐受电压和保质期。电泳胶配方如表1、2所示。通常浓度为3%~5%的堆积胶对蛋白质有明显的浓缩作用[6],本研究配制堆积胶浓度为4%。制备电泳胶时,APS和TEMED最后加入,其他溶液需要先充分混合均匀并排气,否则影响电泳胶凝固速度。灌入分离胶后用Milli-Q水液封,以减少空气对APS产生自由基反应的不利影响,加速凝固过程。待分离胶凝固完全,冲洗残留试剂,灌入堆积胶,插入梳子。堆积胶凝固后,若当天进行电泳,则将梳子取出并冲洗加样孔,备用。在检验电泳胶保质期实验中,电泳胶梳子保留,放入塑料封口袋中,填充适量电泳缓冲液,用真空封口机抽气并密封,置于恒温培养箱中。

表1 4%堆积胶配方(总体积10 mL)

续表1
1.2.2 电泳胶最大耐受电压测定 电泳缓冲液含有25 mmol/L Tris,192 mmol/L 甘氨酸,0.1% SDS。将电泳胶安装在电泳槽内,电泳槽注入缓冲液,使电泳胶的上端和下端浸入其中,取5 μL预染色蛋白质标准或未染色蛋白质标准注入上样孔。电泳开始时,采用较低电压使蛋白质在堆积胶中浓缩成狭窄的区带。增大电压使蛋白质进入分离胶。当蛋白质标准的指示剂前沿接近电泳胶底部时,电泳结束。测量蛋白质条带到指示剂的长度,以及两胶界面到指示剂的长度,由二者比值计算相对迁移率m。
未染色蛋白质标准经15~20 min染色、4~6 h脱色后测量计算m(染色液为0.25%的考马斯亮蓝R250溶液,溶剂为水、甲醇、冰醋酸按照约5∶5∶1体积比混合;脱色液成分为水、甲醇、冰醋酸按照约6∶3∶1体积比混合)[7]。
当蛋白质分子量在15~200 kD时,蛋白质的分子量的对数与相对迁移率的关系符合下式:
lgMW=km+b。
式中:MW为蛋白质相对分子量,在15~200 kD之间时,MW与相对迁移率m呈线性关系;k为斜率;b为截距,该方法测定蛋白质分子量的相对误差为±10%[8]。根据蛋白质分子量对迁移率曲线拟合度R2的数值,结合电泳条带图像,以判断蛋白质的分离效果。测试不同浓度Laemmli胶、新型I和新型II电泳胶以及预制胶的最大耐受电压(即能维持mvs. lgMW曲线拟合度不低于0.990 0的电压),并在最大电压下对比各电泳胶对蛋白质的分离情况。
1.2.3 电泳胶的加速寿命实验 加速寿命实验用以检验的Laemmli胶、新型I、新型II电泳胶以及预制胶的保质期。将Laemmli胶、新型I、新型II电泳胶和Bio-Rad预制胶置于恒温培养箱中(分离胶浓度均为10%),调节至37 ℃恒温保存。在第6、9、12、15天分别将胶取出进行电泳,检验其对蛋白质的分离效果。若电泳胶出现气泡、漏胶或变形,则不进行电泳,视作该电泳胶已经达到最长保质期。
1.2.4 电泳胶变质过程中表观活化能的估算 电泳胶变质是复杂的反应。依据阿伦尼乌斯公式,结合不同保存温度条件下电泳胶的保质期,可计算几种电泳胶变质过程中的表观活化能。活化能反映化学反应速度,在本研究中可作为比较几种电泳胶的变质速度的一种依据。重复1.2.3中步骤,但将电泳胶保存温度设置为45 ℃,检验它们在该温度下的保质期。跟据电泳胶在37和45 ℃的保质期,计算电泳胶的表观活化能,从而能够从理论上计算电泳胶在一般储存条件(4 ℃)下的变质时间。
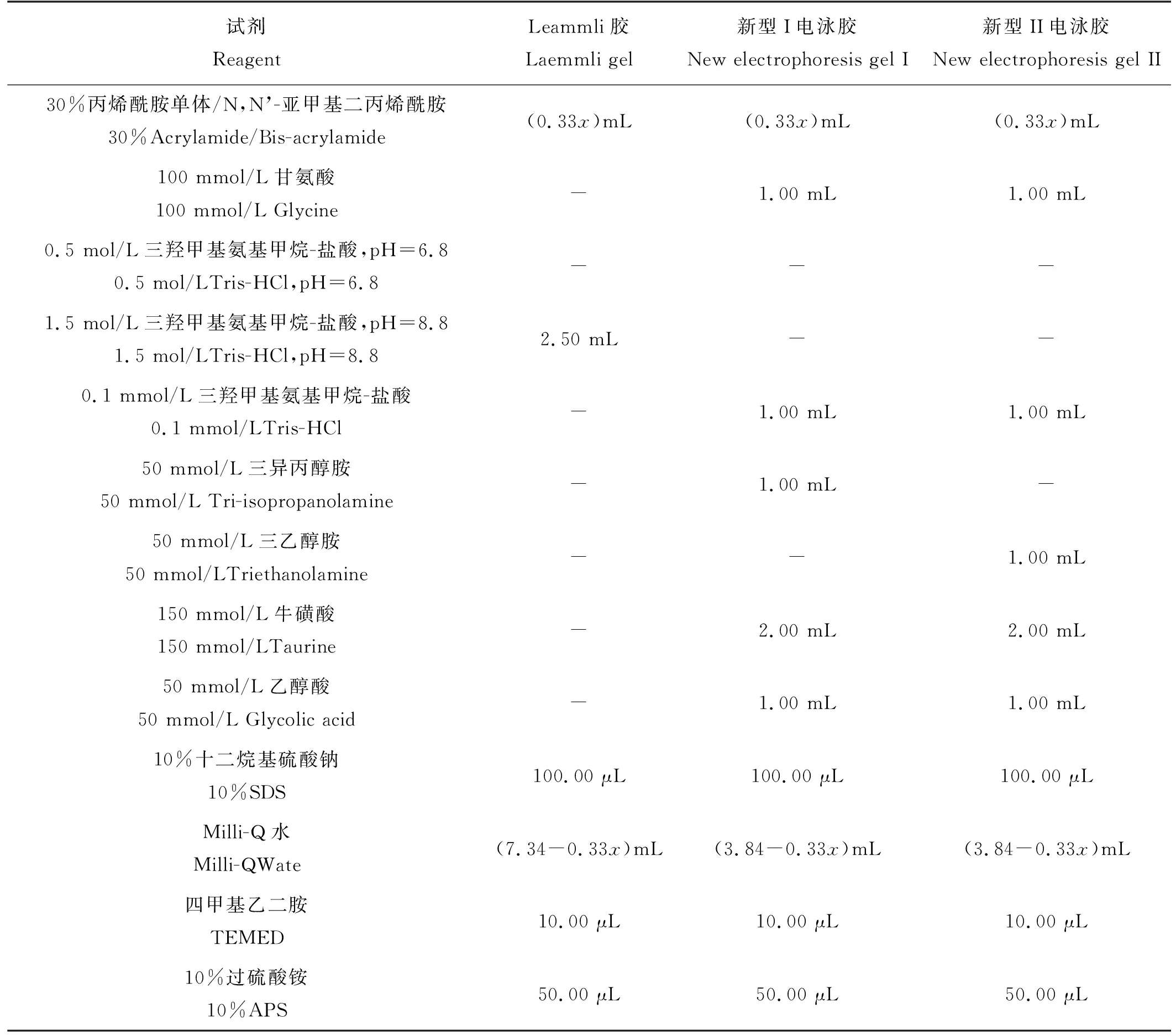
表2 x%分离胶配方(总体积10 mL)Table 2 Formulation of x% separation gel(Total volume 10 mL)
表观活化能计算方法如下:
式中:k是温度为T时的反应速率常数;R是气体摩尔常数;A是指前因子;Ea为表观活化能。
A是与T无关的常数,两边求微分:
当温度分别为T1和T2时,反应速率常数分别为k1和k2,则:
两式相减得:
(1)
设温度为T1时的反应速率为k1,反应时间为t1;温度T2的反应速率为k2,反应时间为t2。假设几种电泳胶变质的反应程度基本相同,则
t1k1=t2k2。
(2)
将实验温度、相应的保质期代入(a) (b)式,联立得到表观活化能Ea的估算值。
2 结果与讨论
2.1 电泳胶凝固时间
在室温下(25 ℃),制备的各类电泳胶凝固时间如表3所示。新型I电泳胶所需的凝固时间最短,Laemmli胶所需时间最长。新型I、新型II电泳胶相对于Laemmli胶凝固速度更快,主要与牛磺酸的加入量有关。在一定范围内,牛磺酸浓度越高,电泳胶凝固速度越快[5]。此外,经实验验证,未排气的新型电泳胶混合液难以凝固。

表3 电泳胶凝固时间(体积10 mL,浓度10%)
2.2 电泳胶的最大耐受电压和分离性能
实验结果表明,不同浓度的Bio-Rad预制胶、新型I、新型II电泳胶的最大耐受电压均在350 V左右,各类电泳胶在一般工作电压和最大耐受电压下的电泳耗时如表4所示。Laemmli胶最大耐受电压约为240 V,不宜在350 V电压条件下电泳。
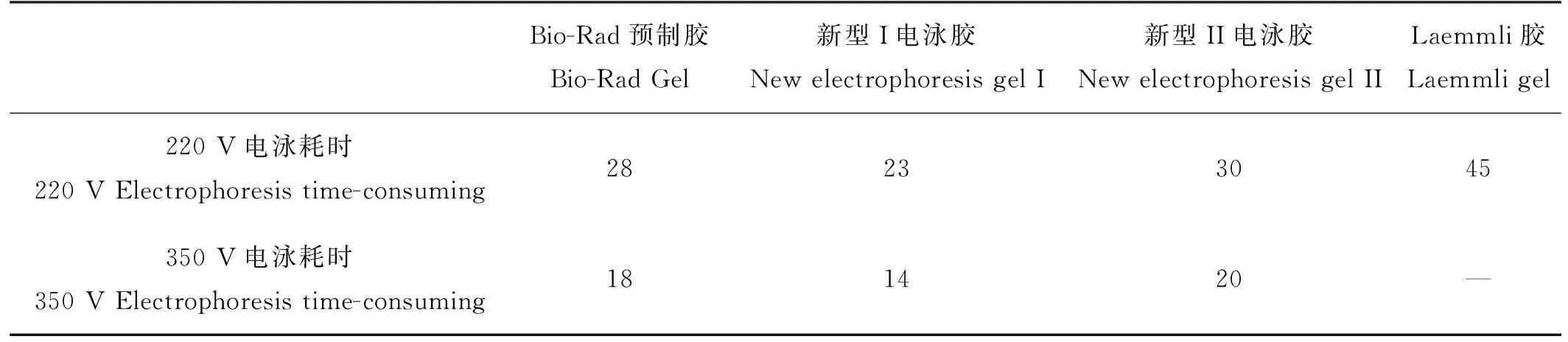
表4 不同电压下电泳耗时(10%分离胶)
在最大耐受电压350 V下的各类电泳胶的电泳时间如表5所示,电泳图像如图1所示。表5中拟合度R2为2~3次电泳结果的平均值。图1中,各条带分子量(kDa)从上到下依次为:130,100,70(橙色),50,35,25,20,15。
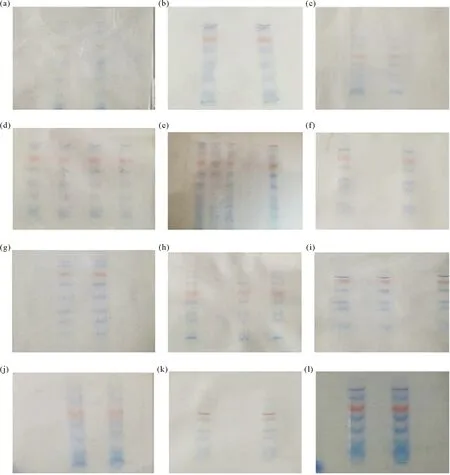
((a),(d),(g),(j)为7.5%、10%、12%、15%的Bio-Rad预制胶;(b),(e),(h),(k) 为7.5%、10%、12%、15%的新型Ⅰ电泳胶;(c),(f),(i),(l) 为7.5%、10%、12%、15%的新型II电泳胶。(a),(d),(g),(j): 7.5%, 10%, 12%, 15% Bio-Rad Gel;(b),(e),(h),(k):7.5%, 10%, 12%, 15% New electrophoresis gel I; (c),(f),(i),(l): 7.5%, 10%, 12%, 15% New electrophoresis gel II.)

表5 标准曲线拟合度及电泳用时
在350 V电压下,预染色标准蛋白的电泳时间随分离胶浓度升高而增加。在同等浓度分离胶中,标准蛋白在新型I电泳胶中电泳速度最快,在预制胶中次之,在新型II电泳胶中电泳速度最慢。电泳过程中蛋白质的迁移速度与缓冲体系、支持介质性质等密切相关,由于新型I、II新型电泳胶中分别以三异丙醇胺和三乙醇胺作为缓冲组分,相同条件下两种电泳胶的电泳时间差异显著。
表5、图1结果表明,350 V电压条件下,不同浓度新型I和新型II电泳胶均能获得清晰的分离条带,标准曲线拟合度良好,其中新型I电泳胶R2波动范围最小,Bio-Rad预制胶的拟合度波动范围最大。比较几种电泳胶的R2平均值,新型I电泳胶的平均分离性能最佳。分离胶浓度较高时(15%),Bio-Rad预制胶、新型II电泳胶的部分蛋白质条带出现模糊、扩散的现象,可能是电泳耗时较长,产生热量较多,电泳系统温度升高导致电泳胶分离能力下降。根据mvs. lgMW曲线方程,计算出的蛋白质分子量,与已知的标准分子量对比的结果表明,实验测得的分子量在Bio-Rad预制胶、新型I电泳胶、新型II电泳胶中的相对误差分别为0.45%、0.26%、0.36%,新型I电泳胶测定蛋白质分子量时的相对误差最小。新型I、新型II电泳胶和Bio-Rda预制胶中的未染色蛋白质标准的迁移率曲线与上述结果相近,两种新型电泳胶染色、脱色效果良好,条带清晰。
2.3 电泳胶保质期的确定
将在37 ℃恒温保存的Laemmli胶、新型I、新型II电泳胶和Bio-Rad预制胶在第6、9、12天取出进行电泳,电泳图片如图2所示。各类电泳胶保质期如表6所示。在37 ℃条件下加速寿命实验结果表明,第6天Laemmli胶对蛋白质的分离能力明显下降,蛋白质条带出现模糊、扩散和变形,并且存在拖尾现象。6天之后的Laemmli胶出现气泡和漏胶现象,不宜进行电泳。

表6 电泳胶加速寿命实验保质期与表观活化能
第6天时两种新型电泳胶分离蛋白质的条带均比较清晰,且标准曲线拟合度均优于Laemmli胶,新型I电泳胶的线性关系最好。Bio-Rad预制胶标准曲线拟合度较好,但蛋白质条带出现扩散现象。第9天新型I、新型II电泳胶的标准曲线拟合度仍在0.980 0以上,所得蛋白质条带较清晰;而Bio-Rad预制胶中所得的蛋白质条带出现明显的模糊扩散现象,对蛋白质分离效果明显降低。第12天新型I、新型II电泳胶中所得的蛋白质条带出现轻微扩散和拖尾,标准曲线拟合度略有下降,分离能力仍然较好。新型I电泳胶标准曲线的拟合度更高。两种新型电泳胶均未出现变形、气泡,表明它们性质稳定,能在较长时间内保持蛋白质分离性能,保质期显著优于Bio-Rad公司的预制胶。Bio-Rad预制胶在保存第9天后出现变形和气泡,而新型I、新型II电泳胶分别在第15、14天出现气泡。
理论上,Laemmli胶中的Tris-HCl,以及两种新型电泳胶中的三乙醇胺和三异丙醇胺都属于胺类。胺类是典型的亲核试剂,能够亲核攻击酰胺基团带正电的碳原子,进行胺交换反应。因此,这三种胺都有破坏聚丙烯酰胺三维网状结构的可能性。这三种亲核试剂中,Tris-HCl是伯胺,发生胺交换反应相对更容易,但反应条件也比较苛刻(在酸性或碱性条件使酰胺键的稳定性受到破坏);经过较长的时间,其—NH2基团与聚丙烯酰胺会逐渐发生反应,如图3(a)所示,反应使交联结构的酰胺键断开,三维网状结构遭到破坏,电泳胶逐渐失去了分子筛效应,分离能力下降[5]。三乙醇胺和三异丙醇胺都是叔胺,对酰胺进行亲核攻击非常困难,甚至无法进行。同时,两种新型电泳胶中的甘氨酸成分有利于保持它们的空间网状结构,并减轻蛋白质条带的拖尾情况。两种新型电泳胶配方中Tris的含量远低于Laemmli胶,并采用牛磺酸、乙醇酸作为缓冲成分,通过调节pH减少聚丙烯酰胺的中酰胺键在酸性条件下被破坏的程度,从而延长了电泳胶的保质期[5]。从图3(b,c)可以看出,三异丙醇胺与三乙醇胺虽然性质相似,但三异丙醇胺立体空间结构相对于三乙醇胺具有更强的支撑、分散性能,且与酰胺键发生反应时的空间位阻更大,变质过程更加缓慢。以上分析表明,新型I电泳的保质期应该长于新型II电泳胶并远远长于Laemmli胶,与我们的实验结果相符。电泳胶稳定性的增强也有助于其耐受更高的电压,使两种新型电泳胶能够承受350 V的电压,耐压性能显著高于Laemmli胶。
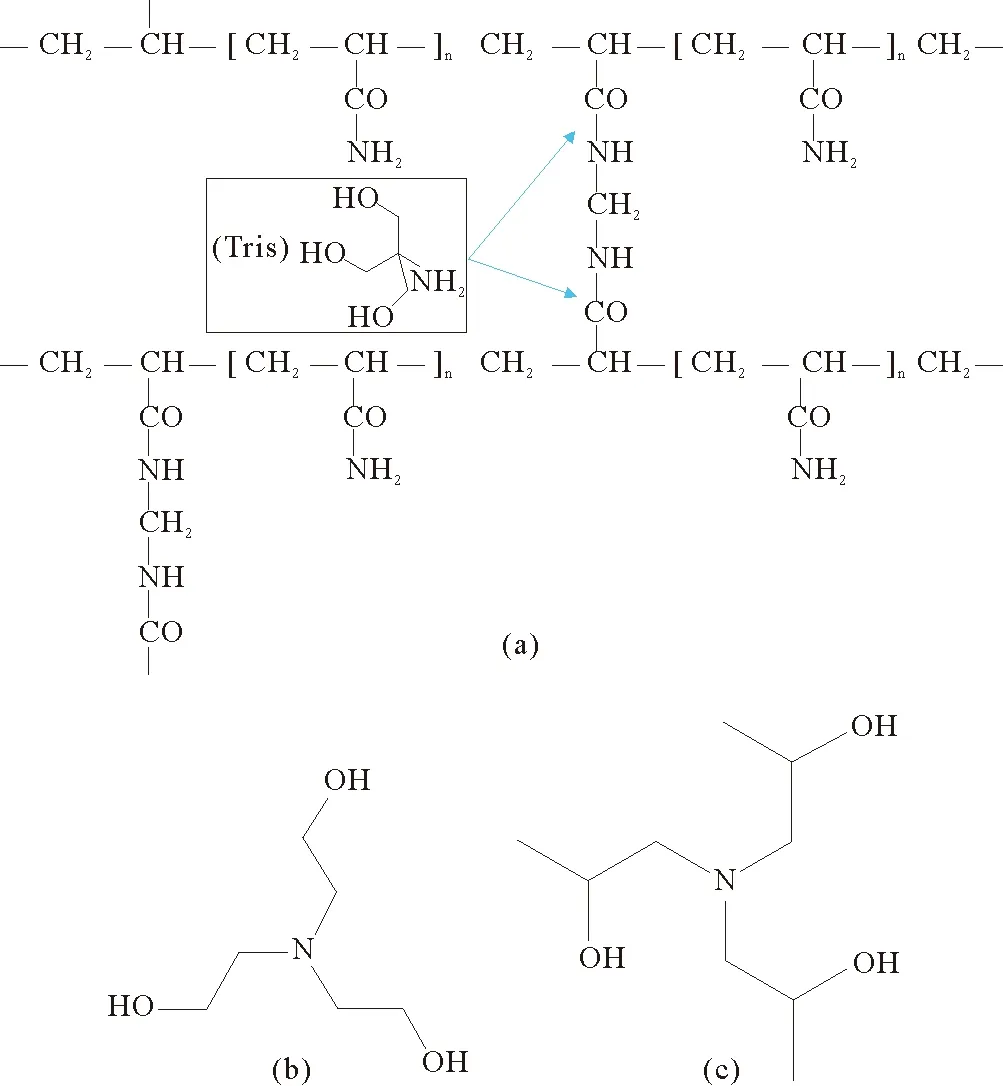
图3 (a) 酸性条件下Tris与酰胺键反应;(b)三乙醇胺结构和(c)三异丙醇胺结构
Rowell 等人的研究表明,SDS-PAGE在37 ℃下恒温保存1天约等于4 ℃下恒温保存1个月[9]。由于Bio-Rad预制胶使用时,距离生产日期约2个月,通过换算后该预制胶保质期为11~12个月,与产品说明基本相符。根据Rowell的结果推断,在4 ℃冷藏条件下,新型I、新型II电泳胶可以分别保存约15、14个月,保质期较Bio-Rad预制胶更长,明显长于Laemmli胶。
2.4 电泳胶变质过程的表观活化能
两种新型电泳胶和Laemmli胶保质期的结果都是根据较高温度下加速实验的结果推定的。通过计算电泳胶变质过程中的表观活化能,能够推算电泳胶在理论上的保质期。四种电泳胶变质过程的表观活化能如表6所示。几种电泳胶表观活化能由大到小排序为:新型I电泳胶、新型II电泳胶、Bio-Rad预制胶、Laemmli胶。表观活化能数值越高,反应进行越慢,这进一步说明了新型I电泳胶具有更加稳定的化学性质,从而具有较长的保质期。根据表观活化能推算电泳胶在4 ℃储存条件下的理论保质期列于表6,其中新型I电泳胶保质期最长,可达3年以上。根据表观活化能计算的四种电泳胶的保质期比根据Rowell研究结果推算的保质期明显偏长,因此需要进一步通过实验验证这四种电泳胶在4 ℃下的确切的保质期。
2.5 Laemmli胶和两种新型电泳胶的理化参数
Laemmli胶和两种新型电泳胶的部分理化参数如表7所示。
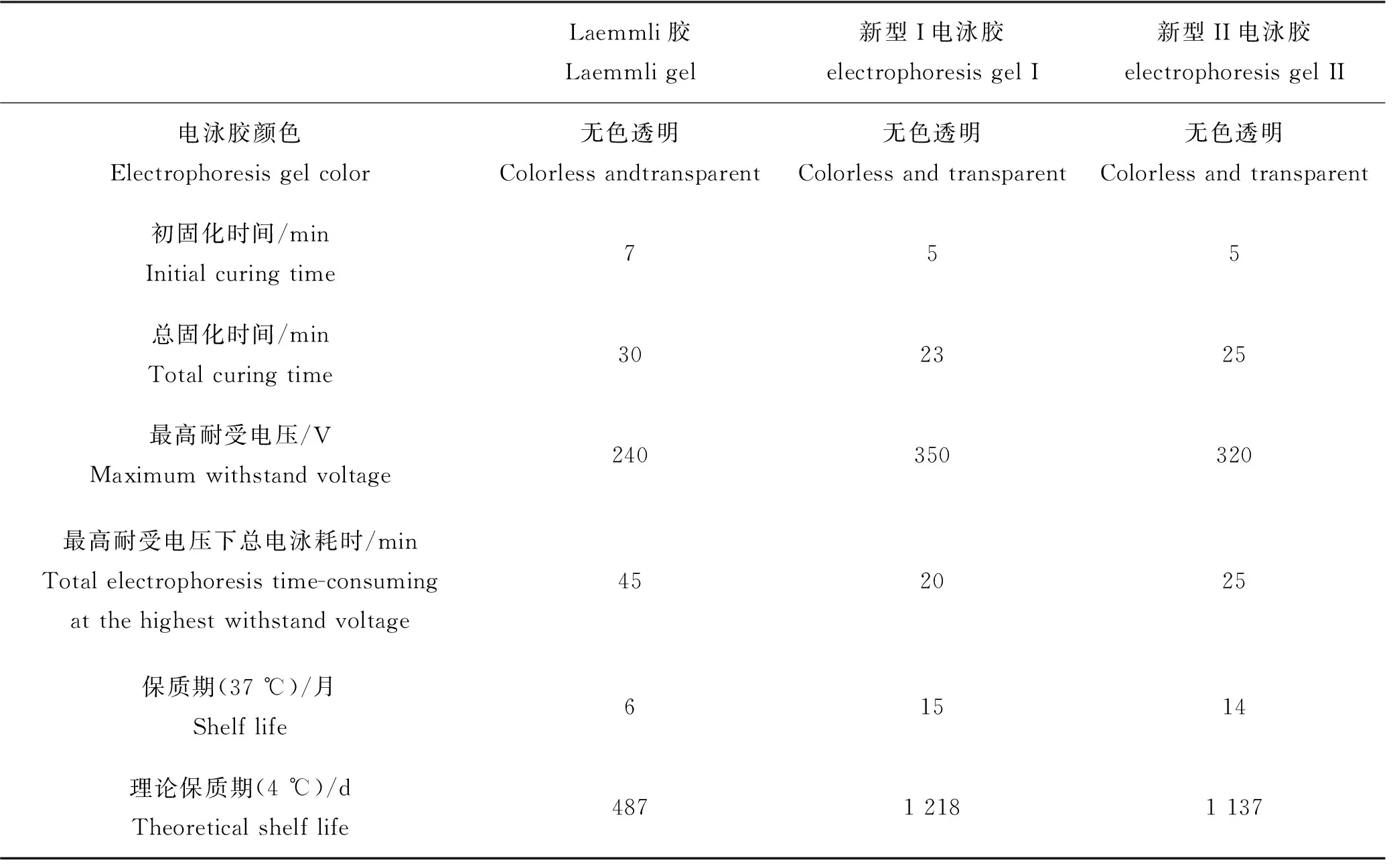
表7 三种电泳胶部分理化参数(10%分离胶)
3 结语
最大电压耐受实验和加速寿命实验结果表明,新型I和新型II电泳胶具备了Laemmli胶对蛋白质良好的分离性能,并且制胶时凝固速度更快;耐受工作电压高达350 V,完成电泳时间更短;新型I和新型II电泳胶配方中的缓冲物质三异丙醇胺和三乙醇胺能有效保护聚丙烯酰胺的三维网状结构,保质期超过现有的商业预制胶,具有良好的应用前景。

